Crestor 10mg, 20mg, 5mg Rosuvastatin Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Crestor on ja miten sitä käytetään?
Crestor on reseptilääke, jota käytetään alentamaan veren LDL-kolesterolia (matalatiheyksinen lipoproteiini) ja triglyseridejä, hidastamaan plakin etenemistä verisuonissa sekä vähentämään aivohalvauksen ja sydänkohtauksen riskiä. Crestor 20 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Crestor on lipidejä alentavia aineita, statiineja ja HMG-CoA-reduktaasin estäjiä.
Ei tiedetä, onko Crestor turvallinen ja tehokas alle 8-vuotiaille lapsille.
Mitkä ovat Crestorin mahdolliset sivuvaikutukset?
Crestor voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- selittämätön lihaskipu
- lihasten arkuus
- lihas heikkous
- hämmennystä
- muistiongelmia
- ylävatsan kipu
- väsymys
- ruokahalun menetys
- tumma virtsa
- ihon tai silmien keltaisuus (keltaisuus)
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Crestorin yleisimmät sivuvaikutukset ovat:
- päänsärky
- heikkous
- lihassäryt
- pahoinvointi
- vatsakipu
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Crestorin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
CRESTOR (rosuvastatiinikalsium) on synteettinen lipidejä alentava aine suun kautta annettavaksi.
Rosuvastatiinikalsiumin kemiallinen nimi on bis[(E)-7-[4-(4-fluorifenyyli)-6-isopropyyli-2-[metyyli(metyylisulfonyyli)amino]pyrimidin-5-yyli](3R,5S)-3 ,5-dihydroksihept-6-eenihappo]kalsiumsuola, jolla on seuraava rakennekaava:
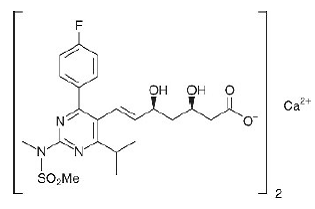
Rosuvastatiinikalsiumin empiirinen kaava on (C22H27FN3O6S)2Ca ja molekyylipaino on 1001,14. Rosuvastatiinikalsium on valkoinen amorfinen jauhe, joka liukenee niukasti veteen ja metanoliin ja liukenee heikosti etanoliin. Rosuvastatiinikalsium on hydrofiilinen yhdiste, jonka jakaantumiskerroin (oktanoli/vesi) on 0,13 pH:ssa 7,0.
Suun kautta annettavat CRESTOR-tabletit sisältävät 5, 10, 20 tai 40 mg rosuvastatiinia ja seuraavia inaktiivisia aineita: Jokainen tabletti sisältää: mikrokiteistä selluloosaa NF, laktoosimonohydraattia NF, kolmiemäksistä kalsiumfosfaattia NF, krospovidonia NF, magnesiumstearaattia NF, hypromelloosia NF triasetiini NF, titaanidioksidi USP, keltainen rautaoksidi ja punainen rautaoksidi NF.
INDIKAATIOT
Hyperlipidemia ja sekamuotoinen dyslipidemia
CRESTOR on tarkoitettu ruokavalion lisähoitoon kohonneiden kokonaiskolesteroli-, LDL-kolesteroli-, ApoB-, ei-HDL-kolesteroli- ja triglyseridien pitoisuuksien vähentämiseksi ja HDL-kolesterolin lisäämiseksi aikuispotilailla, joilla on primaarinen hyperlipidemia tai sekamuotoinen dyslipidemia. Rasvapitoisuutta muuttavia aineita tulee käyttää tyydyttyneitä rasvoja ja kolesterolia rajoittavan ruokavalion lisäksi, kun pelkkä ruokavalio ja ei-farmakologiset toimenpiteet eivät ole olleet riittäviä.
Lapsipotilaat, joilla on familiaalinen hyperkolesterolemia
CRESTOR 10 mg on tarkoitettu ruokavalion lisäaineeksi seuraaviin tarkoituksiin:
- alentaa kokonaiskolesteroli-, LDL-kolesteroli- ja ApoB-tasoja 8–17-vuotiailla lapsilla ja nuorilla, joilla on heterotsygoottinen familiaalinen hyperkolesterolemia, jos riittävän ruokavaliohoitotutkimuksen jälkeen havaitaan seuraavat löydökset: LDL-kolesteroli >190 mg/dl tai >160 mg/dl sekä positiivinen suvussa ennenaikainen sydän- ja verisuonitauti (CVD) tai kaksi tai useampia muita sydän- ja verisuonisairauksien riskitekijöitä.
- vähentää LDL-kolesterolia, kokonaiskolesterolia, nonHDL-kolesterolia ja ApoB-arvoja 7–17-vuotiailla lapsilla ja nuorilla, joilla on homotsygoottinen familiaalinen hyperkolesterolemia joko yksinään tai muiden lipidejä alentavien hoitojen (esim. LDL-afereesi) kanssa.
Hypertriglyseridemia
CRESTOR on tarkoitettu ruokavalion lisähoitona hypertriglyseridemiaa sairastavien aikuispotilaiden hoitoon.
Primaarinen dysbetalipoproteinemia (tyypin III hyperlipoproteinemia)
CRESTOR on tarkoitettu ruokavalion lisänä aikuispotilaille, joilla on primaarinen dysbetalipoproteinemia (tyypin III hyperlipoproteinemia).
Aikuiset potilaat, joilla on homotsygoottinen familiaalinen hyperkolesterolemia
CRESTOR on tarkoitettu muiden lipidejä alentavien hoitojen (esim. LDL-afereesin) lisähoitona tai yksinään, jos tällaisia hoitoja ei ole saatavilla LDL-kolesterolin, kokonaiskolesterolin ja ApoB:n alentamiseksi aikuispotilailla, joilla on homotsygoottinen familiaalinen hyperkolesterolemia.
Ateroskleroosin etenemisen hidastuminen
CRESTOR 5 mg on tarkoitettu ruokavalion lisähoitoon ateroskleroosin etenemisen hidastamiseksi aikuisilla potilailla osana hoitostrategiaa kokonaiskolesterolin ja LDL-kolesterolin alentamiseksi tavoitetasoille.
Sydän- ja verisuonisairauksien ensisijainen ehkäisy
Henkilöillä, joilla ei ole kliinisesti ilmeistä sepelvaltimotautia, mutta joilla on lisääntynyt sydän- ja verisuonitautien riski miehillä ≥50-vuotiailla ja naisilla ≥60-vuotiailla, hsCRP ≥2 mg/l ja vähintään yksi muu sydän- ja verisuonisairaus riskitekijät, kuten verenpainetauti, alhainen HDL-kolesteroli, tupakointi tai suvussa ennenaikainen sepelvaltimotauti, CRESTOR on tarkoitettu:
- vähentää aivohalvauksen riskiä
- vähentää sydäninfarktin riskiä
- vähentää valtimoiden revaskularisaatiotoimenpiteiden riskiä
Käyttörajoitukset
CRESTORia ei ole tutkittu Fredricksonin tyypin I ja V dyslipidemioissa.
ANNOSTELU JA HALLINNOINTI
Yleiset annostelutiedot
CRESTOR 5 mg:n annosalue aikuisille on 5-40 mg suun kautta kerran vuorokaudessa. Tavallinen aloitusannos on 10-20 mg kerran vuorokaudessa. Tavallinen aloitusannos aikuispotilailla, joilla on homotsygoottinen familiaalinen hyperkolesterolemia, on 20 mg kerran vuorokaudessa.
CRESTORin 20 mg:n enimmäisannosta 40 mg tulee käyttää vain niille potilaille, jotka eivät ole saavuttaneet LDL-kolesterolitavoitetta käyttämällä 20 mg:n annosta [ks. VAROITUKSET JA VAROTOIMET ].
CRESTOR 5 mg voidaan antaa kerta-annoksena mihin aikaan päivästä tahansa, ruoan kanssa tai ilman. Tabletti tulee niellä kokonaisena.
CRESTOR-hoitoa aloitettaessa tai toisesta HMG-CoA-reduktaasin estäjähoidosta vaihdettaessa tulee ensin käyttää sopivaa 10 mg:n CRESTOR-aloitusannosta ja vasta sitten titrata potilaan vasteen ja yksilöllisen hoidon tavoitteen mukaan.
CRESTOR-hoidon aloittamisen tai titrauksen jälkeen lipiditasot tulee analysoida 2–4 viikon kuluessa ja annostusta muuttaa vastaavasti.
Lasten annostelu
Heterotsygoottisessa familiaalisessa hyperkolesterolemiassa suositeltu annosalue on 5-10 mg suun kautta kerran vuorokaudessa 8-alle 10-vuotiaille potilaille ja 5-20 mg suun kautta kerran päivässä 10-17-vuotiaille potilaille.
Homotsygoottisessa familiaalisessa hyperkolesterolemiassa suositeltu annos on 20 mg suun kautta kerran vuorokaudessa 7–17-vuotiaille potilaille.
Annostelu aasialaisille potilaille
Aasialaisilla potilailla kannattaa harkita CRESTOR 20 mg -hoidon aloittamista annoksella 5 mg kerran vuorokaudessa, koska rosuvastatiinipitoisuus plasmassa on kohonnut. Lisääntynyt systeeminen altistus tulee ottaa huomioon hoidettaessa aasialaisia potilaita, joita ei saada riittävästi hallintaan annoksilla 20 mg/vrk asti [ks. Käyttö tietyissä populaatioissa ja KLIININEN FARMAKOLOGIA ].
Käytä samanaikaisen hoidon kanssa
Potilaat, jotka käyttävät syklosporiinia
CRESTOR 20 mg:n annos ei saa ylittää 5 mg kerran päivässä [katso VAROITUKSET JA VAROTOIMET , HUUMEIDEN VUOROVAIKUTUKSET ja KLIININEN FARMAKOLOGIA ].
Gemfibrotsiilia käyttävät potilaat
Vältä CRESTORin samanaikaista käyttöä gemfibrotsiilin kanssa. Jos samanaikaista käyttöä ei voida välttää, aloita CRESTOR annoksella 5 mg kerran vuorokaudessa. CRESTOR-annos ei saa ylittää 10 mg kerran päivässä [katso VAROITUKSET JA VAROTOIMET , HUUMEIDEN VUOROVAIKUTUKSET ja KLIININEN FARMAKOLOGIA ].
Potilaat, jotka käyttävät atatsanaviiria ja ritonaviiria, lopinaviiria ja ritonaviiria tai simepreviriä
Aloita CRESTOR 10 mg -hoito 5 mg:lla kerran vuorokaudessa. CRESTOR-annos ei saa ylittää 10 mg kerran päivässä [katso VAROITUKSET JA VAROTOIMET , HUUMEIDEN VUOROVAIKUTUKSET ja KLIININEN FARMAKOLOGIA ].
Annostelu potilaille, joilla on vaikea munuaisten vajaatoiminta
Potilaille, joilla on vaikea munuaisten vajaatoiminta (CLcr Käyttö tietyissä populaatioissa ja KLIININEN FARMAKOLOGIA ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
5 mg: keltaiset, pyöreät, kaksoiskuperit, päällystetyt tabletit. Tabletin toiselle puolelle on kaiverrettu "CRESTOR" ja "5".
10 mg: Vaaleanpunaiset, pyöreät, kaksoiskuperit, päällystetyt tabletit. Tabletin toiselle puolelle on kaiverrettu "CRESTOR" ja "10".
20 mg: Vaaleanpunaiset, pyöreät, kaksoiskuperit, päällystetyt tabletit. Tabletin toiselle puolelle on kaiverrettu ”CRESTOR” ja ”20”.
40 mg: Vaaleanpunaiset, soikeat, kaksoiskuperat, päällystetyt tabletit. Tabletin toiselle puolelle on kaiverrettu ”CRESTOR” ja toiselle puolelle ”40”.
Varastointi ja käsittely
CRESTOR® (rosuvastatiinikalsium) -tabletit toimitetaan seuraavasti:
NDC 0310-0755-90: 5 mg. Keltainen, pyöreä, kaksoiskupera, päällystetty tabletti. Toisella puolella kaiverrus "CRESTOR" ja "5"; 90 tabletin pullo
NDC 0310-0751-90: 10 mg. Vaaleanpunaiset, pyöreät, kaksoiskuperit, päällystetyt tabletit. Toisella puolella kaiverrus "CRESTOR" ja "10"; 90 tabletin pullo
NDC 0310-0751-39: 10 mg. Vaaleanpunaiset, pyöreät, kaksoiskuperit, päällystetyt tabletit. Toisella puolella kaiverrus "CRESTOR" ja "10"; 100 yksikköannospakkaukset
NDC 0310-0752-90: 20 mg. Vaaleanpunaiset, pyöreät, kaksoiskuperit, päällystetyt tabletit. Toisella puolella kaiverrus "CRESTOR" ja "20"; 90 pulloa
NDC 0310-0752-39: 20 mg. Vaaleanpunaiset, pyöreät, kaksoiskuperit, päällystetyt tabletit. Toisella puolella kaiverrus "CRESTOR" ja "20"; 100 yksikköannospakkaukset
NDC 0310-0754-30: 40 mg. Vaaleanpunaiset, soikeat, kaksoiskuperat, päällystetyt tabletit. Toisella puolella kaiverrus "CRESTOR" ja toisella puolella "40"; 30 pulloa
Varastointi
Säilytä kontrolloidussa huoneenlämmössä, 20-25 °C (68-77 °F) [katso USP-ohjattu huonelämpötila ]. Suojaa kosteudelta.
Jakelija: AstraZeneca Pharmaceuticals LP Wilmington, DE 19850. Tarkistettu: syyskuu 2018
SIVUVAIKUTUKSET
Seuraavia vakavia haittavaikutuksia käsitellään tarkemmin etiketin muissa osissa:
- Rabdomyolyysi, johon liittyy myoglobinuria ja akuutti munuaisten vajaatoiminta ja myopatia (mukaan lukien myosiitti) [ks. VAROITUKSET JA VAROTOIMET ]
- Maksaentsyymihäiriöt [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä tutkimuksista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida verrata suoraan toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta kliinisessä käytännössä havaittuja nopeuksia.
CRESTOR-kontrolloitujen kliinisten tutkimusten tietokannassa (plasebo- tai aktiivikontrolloitu) 5 394 potilaalla, joiden keskimääräinen hoidon kesto oli 15 viikkoa, 1,4 % potilaista keskeytti hoidon haittavaikutusten vuoksi. Yleisimmät hoidon lopettamiseen johtaneet haittavaikutukset olivat:
- myalgia
- vatsakipu
- pahoinvointi
Yleisimmin raportoidut haittavaikutukset (esiintyvyys ≥ 2 %) CRESTOR 5 mg:n kontrolloidussa kliinisessä 5 394 potilaan tutkimustietokannassa olivat:
- päänsärky
- myalgia
- vatsakipu
- astenia
- pahoinvointi
Haittavaikutukset, joita raportoitiin ≥ 2 %:lla potilaista lumekontrolloiduissa kliinisissä tutkimuksissa ja enemmän kuin lumelääkettä saaneilla, on esitetty taulukossa 1. Näiden tutkimusten hoidon kesto oli jopa 12 viikkoa.
Muita kliinisissä tutkimuksissa raportoituja haittavaikutuksia olivat vatsakipu, huimaus, yliherkkyys (mukaan lukien ihottuma, kutina, nokkosihottuma ja angioedeema) ja haimatulehdus. Seuraavia laboratoriopoikkeavuuksia on myös raportoitu: mittatikku-positiivinen proteinuria ja mikroskooppinen hematuria [ks. VAROITUKSET JA VAROTOIMET ]; kohonnut kreatiinifosfokinaasi, transaminaasit, glukoosi, glutamyylitranspeptidaasi, alkalinen fosfataasi ja bilirubiini; ja kilpirauhasen toimintahäiriöt.
METEOR-tutkimuksessa, johon osallistui 981 osallistujaa, jotka saivat 40 mg rosuvastatiinia (n=700) tai lumelääkettä (n=281) keskimääräisen hoidon keston ollessa 1,7 vuotta, 5,6 % CRESTOR 5 mg:lla hoidetuista koehenkilöistä verrattuna 2,8 % lumelääkettä saaneista. lopetettu haittavaikutusten vuoksi. Yleisimmät hoidon lopettamiseen johtaneet haittavaikutukset olivat: lihaskipu, maksaentsyymiarvojen nousu, päänsärky ja pahoinvointi [ks. Kliiniset tutkimukset ].
Haittavaikutukset, joita raportoitiin ≥ 2 %:lla potilaista ja useammin kuin lumelääkettä saaneilla, on esitetty taulukossa 2.
JUPITER-tutkimuksessa 17 802 osallistujaa hoidettiin rosuvastatiinilla 20 mg (n=8901) tai lumella (n=8901) keskimäärin 2 vuoden ajan. Korkeampi prosenttiosuus rosuvastatiinilla hoidetuista potilaista verrattuna lumelääkettä saaneisiin potilaisiin, vastaavasti 6,6 % ja 6,2 %, keskeytti tutkimuslääkityksen haittatapahtuman vuoksi, riippumatta hoidon syy-yhteydestä. Myalgia oli yleisin haittavaikutus, joka johti hoidon keskeyttämiseen.
JUPITER-tutkimuksessa diabetes mellitusta ilmoitettiin merkitsevästi useammin rosuvastatiinia saaneilla potilailla (2,8 %) verrattuna lumelääkettä saaneisiin potilaisiin (2,3 %). Keskimääräinen HbA1c nousi merkitsevästi 0,1 % rosuvastatiinilla hoidetuilla potilailla lumelääkettä saaneisiin potilaisiin verrattuna. Potilaiden määrä, joiden HbA1c oli >6,5 % tutkimuksen lopussa, oli merkittävästi suurempi rosuvastatiinilla hoidetuilla potilailla verrattuna lumelääkettä saaneisiin [ks. VAROITUKSET JA VAROTOIMET ja Kliiniset tutkimukset ].
Haittavaikutukset, joita raportoitiin ≥ 2 %:lla potilaista ja useammin kuin lumelääkettä saaneilla, on esitetty taulukossa 3.
Pediatriset potilaat, joilla on heterotsygoottinen familiaalinen hyperkolesterolemia
12 viikkoa kestäneessä kontrolloidussa tutkimuksessa 10–17-vuotiailla pojilla ja postmenarkeaalisilla tytöillä, joilla oli heterotsygoottinen familiaalinen hyperkolesterolemia CRESTOR-annoksella 5-20 mg päivässä [ks. Käyttö tietyissä populaatioissa ja Kliiniset tutkimukset ], seerumin kreatiinifosfokinaasi (CK) > 10 x ULN kohoamista havaittiin useammin rosuvastatiinilla kuin lumelääkettä saaneilla lapsilla. Neljällä 130:stä (3 %) rosuvastatiinilla hoidetusta lapsesta (2 10 mg:lla ja 2 20 mg:lla hoidetusta lapsesta) oli kohonnut CK > 10 x ULN, verrattuna 0:aan lumelääkettä saaneesta lapsesta 46:sta.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu CRESTORin hyväksymisen jälkeisen käytön aikana: nivelkipu, kuolemaan johtava ja ei-kuolemaan johtava maksan vajaatoiminta, hepatiitti, keltaisuus, trombosytopenia, masennus, unihäiriöt (mukaan lukien unettomuus ja painajaiset), perifeerinen neuropatia, interstitiaalinen keuhkosairaus ja gynekomastia. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Immuunivälitteisestä nekrotisoivasta myopatiasta, joka liittyy statiinien käyttöön, on raportoitu harvoin [katso VAROITUKSET JA VAROTOIMET ].
Markkinoille tulon jälkeen on raportoitu harvoin statiinien käyttöön liittyvää kognitiivista heikkenemistä (esim. muistin menetys, unohtaminen, muistinmenetys, muistin heikkeneminen ja sekavuus). Näitä kognitiivisia ongelmia on raportoitu kaikkien statiinien kohdalla. Raportit ovat yleensä ei-vakavia ja palautuvat statiinihoidon lopettamisen jälkeen, ja oireiden alkamisajat vaihtelevat (yhdestä päivästä vuosiin) ja oireiden häviämiseen (mediaani 3 viikkoa).
HUUMEIDEN VUOROVAIKUTUKSET
Syklosporiini
Siklosporiini lisäsi rosuvastatiinialtistusta ja voi lisätä myopatian riskiä. Siksi siklosporiinia käyttävien potilaiden CRESTOR 10 mg -annos ei saa ylittää 5 mg kerran vuorokaudessa [ks. ANNOSTELU JA HALLINNOINTI , VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ].
Gemfibrotsiili
Gemfibrotsiili lisäsi merkittävästi rosuvastatiinialtistusta. Koska myopatian/rabdomyolyysin riski on lisääntynyt, CRESTORin ja gemfibrotsiilin yhdistelmähoitoa tulee välttää. Yhdessä käytettynä CRESTOR 10 mg:n annos ei saa ylittää 10 mg kerran päivässä [katso KLIININEN FARMAKOLOGIA ].
Proteaasin estäjät
Rosuvastatiinin yhteiskäytöllä tiettyjen proteaasi-inhibiittoreiden kanssa on erilaisia vaikutuksia rosuvastatiinialtistukseen ja se voi lisätä myopatian riskiä. Simepreviiri, joka on C-hepatiittiviruksen (HCV) proteaasin estäjä, tai atatsanaviirin/ritonaviirin tai lopinaviirin/ritonaviirin yhdistelmät, jotka ovat HIV-1-proteaasin estäjiä, lisäävät rosuvastatiinialtistusta (katso taulukko 4). KLIININEN FARMAKOLOGIA ]. Näille proteaasi-inhibiittoreille CRESTOR 5 mg:n annos ei saa ylittää 10 mg kerran vuorokaudessa. Fosamprenaviirin/ritonaviirin tai tipranaviirin/ritonaviirin yhdistelmät, jotka ovat HIV-1-proteaasin estäjiä, aiheuttavat vain vähän tai ei lainkaan muutosta rosuvastatiinialtistuksessa. Varovaisuutta tulee noudattaa, kun rosuvastatiinia annetaan yhdessä proteaasi-inhibiittoreiden kanssa [katso ANNOSTELU JA HALLINNOINTI , VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ].
Kumariiniantikoagulantit
CRESTOR 20 mg nosti merkittävästi INR:ää potilailla, jotka saivat kumariiniantikoagulantteja. Siksi on noudatettava varovaisuutta, kun kumariiniantikoagulantteja annetaan yhdessä CRESTORin kanssa. Potilailla, jotka käyttävät kumariiniantikoagulantteja ja CRESTORia samanaikaisesti, INR on määritettävä ennen CRESTOR-hoidon aloittamista ja riittävän usein hoidon alkuvaiheessa sen varmistamiseksi, ettei INR-arvossa tapahdu merkittäviä muutoksia [ks. VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ].
Niasiini
Luustolihasvaikutusten riski voi lisääntyä, kun CRESTOR 5 mg:aa käytetään yhdessä lipidejä muuntavien niasiiniannosten (≥1 g/vrk) kanssa; varovaisuutta tulee noudattaa määrättäessä CRESTORin kanssa [katso VAROITUKSET JA VAROTOIMET ].
Fenofibraatti
Kun CRESTOR 20 mg annettiin samanaikaisesti fenofibraatin kanssa, rosuvastatiinin tai fenofibraatin AUC-arvossa ei havaittu kliinisesti merkitsevää nousua. Koska tiedetään, että myopatian riski HMG-CoA-reduktaasin estäjien hoidon aikana lisääntyy fenofibraattien samanaikaisen käytön aikana, varovaisuutta tulee noudattaa määrättäessä fenofibraatteja CRESTORin kanssa [ks. VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ].
Kolkisiini
Myopatiatapauksia, mukaan lukien rabdomyolyysi, on raportoitu HMG-CoA-reduktaasin estäjien, mukaan lukien rosuvastatiinin, yhteydessä annettuna kolkisiinin kanssa, ja varovaisuutta on noudatettava määrättäessä CRESTORia kolkisiinin kanssa [ks. VAROITUKSET JA VAROTOIMET ].
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Luustolihasvaikutukset
Myopatia- ja rabdomyolyysitapauksia, joihin liittyy myoglobinuriasta johtuva akuutti munuaisten vajaatoiminta, on raportoitu HMG-CoA-reduktaasin estäjien, mukaan lukien CRESTORin, käytön yhteydessä. Näitä riskejä voi esiintyä millä tahansa annostasolla, mutta ne lisääntyvät suurimmalla annoksella (40 mg).
CRESTOR 5 mg:aa tulee määrätä varoen potilaille, joilla on myopatialle altistavia tekijöitä (esim. ikä ≥65 vuotta, riittämättömästi hoidettu kilpirauhasen vajaatoiminta, munuaisten vajaatoiminta). Myopatian riski CRESTOR 5 mg -hoidon aikana voi lisääntyä, jos samanaikaisesti annetaan joitakin muita lipidejä alentavia hoitomuotoja (fibraatteja tai niasiinia), gemfibrotsiilia, siklosporiinia, atatsanaviiria/ritonaviiria, lopinaviiria/ritonaviiria tai simepreviiria [ks. ANNOSTELU JA HALLINNOINTI ja HUUMEIDEN VUOROVAIKUTUKSET ]. Myopatiatapauksia, mukaan lukien rabdomyolyysi, on raportoitu HMG-CoA-reduktaasin estäjien, mukaan lukien rosuvastatiinin, käytön yhteydessä kolkisiinin kanssa, ja varovaisuutta on noudatettava määrättäessä CRESTORia kolkisiinien kanssa [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
CRESTOR-hoito tulee lopettaa, jos kreatiinikinaasitasot kohoavat huomattavasti tai jos myopatiaa diagnosoidaan tai sitä epäillään. CRESTOR 5 mg -hoito tulee myös väliaikaisesti keskeyttää potilailla, joilla on akuutti vakava sairaus, joka viittaa myopatiaan tai altistaa rabdomyolyysin aiheuttaman munuaisten vajaatoiminnan kehittymiselle (esim. sepsis, hypotensio, nestehukka, suuri leikkaus, trauma, vaikea metabolinen, endokriininen, ja elektrolyyttihäiriöt tai hallitsemattomat kohtaukset).
Immuunivälitteisestä nekrotisoivasta myopatiasta (IMNM), autoimmuunimyopatiasta, on raportoitu harvoin statiinien käyttöön liittyen. IMNM:lle on tunnusomaista: proksimaalinen lihasheikkous ja kohonnut seerumin kreatiinikinaasi, jotka jatkuvat statiinihoidon lopettamisesta huolimatta; lihasbiopsia, jossa näkyy nekrotisoiva myopatia ilman merkittävää tulehdusta; parantaminen immunosuppressiivisilla aineilla.
Kaikkia potilaita tulee neuvoa ilmoittamaan viipymättä lääkärilleen selittämättömästä lihaskivusta, -arkuudesta tai -heikkoudesta, erityisesti jos niihin liittyy huonovointisuutta tai kuumetta tai jos lihasoireet jatkuvat CRESTOR-hoidon lopettamisen jälkeen.
Maksaentsyymihäiriöt
Maksaentsyymitestejä suositellaan ennen CRESTOR 10 mg -hoidon aloittamista ja jos maksavaurion merkkejä tai oireita ilmenee.
Seerumin transaminaasiarvojen [AST (SGOT) tai ALT (SGPT)] nousua on raportoitu käytettäessä HMG-CoA-reduktaasin estäjiä, mukaan lukien CRESTOR. Useimmissa tapauksissa nousut olivat ohimeneviä ja hävisivät tai paranivat hoidon jatkuessa tai lyhyen hoidon keskeytyksen jälkeen. Kaksi keltaisuustapausta, joiden yhteyttä CRESTOR-hoitoon ei voitu määrittää, parani hoidon lopettamisen jälkeen. Näissä tutkimuksissa ei havaittu maksan vajaatoimintaa tai peruuttamatonta maksasairautta. Plasebokontrolloitujen tutkimusten yhdistetyssä analyysissä seerumin transaminaasiarvot kohosivat yli kolminkertaiseksi normaalin ylärajaan verrattuna 1,1 %:lla potilaista, jotka saivat CRESTOR 5 mg:aa verrattuna 0,5 %:iin lumelääkettä saaneista potilaista.
Markkinoille tulon jälkeen on raportoitu harvoin kuolemaan johtaneesta ja ei-fataalista maksan vajaatoimintaa potilailla, jotka käyttävät statiineja, mukaan lukien rosuvastatiinia. Jos CRESTOR 20 mg -hoidon aikana ilmenee vakava maksavaurio, johon liittyy kliinisiä oireita ja/tai hyperbilirubinemiaa tai keltaisuutta, keskeytä hoito välittömästi. Jos vaihtoehtoista etiologiaa ei löydy, älä käynnistä CRESTORia uudelleen.
CRESTOR 5 mg:aa tulee käyttää varoen potilailla, jotka käyttävät suuria määriä alkoholia ja/tai joilla on ollut krooninen maksasairaus [ks. KLIININEN FARMAKOLOGIA ]. Aktiivinen maksasairaus, johon voi sisältyä selittämätöntä jatkuvaa transaminaasiarvojen nousua, on CRESTORin käytön vasta-aihe [ks. VASTA-AIHEET ].
Samanaikainen kumariiniantikoagulantit
Varovaisuutta on noudatettava, kun antikoagulantteja annetaan yhdessä CRESTORin kanssa, koska se voimistaa kumariinityyppisten antikoagulanttien vaikutusta protrombiiniaikaa/INR:ää pidentävässä muodossa. Potilailla, jotka käyttävät samanaikaisesti kumariiniantikoagulantteja ja CRESTORia, INR on määritettävä ennen CRESTOR 10 mg -hoidon aloittamista ja riittävän usein hoidon alkuvaiheessa sen varmistamiseksi, ettei INR-arvossa tapahdu merkittäviä muutoksia [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Proteinuria ja hematuria
Kliinisessä CRESTOR-tutkimusohjelmassa CRESTORilla hoidetuilla potilailla havaittiin mittatikku-positiivista proteinuriaa ja mikroskooppista hematuriaa. Nämä löydökset olivat yleisempiä potilailla, jotka saivat 40 mg CRESTORia, verrattuna pienempiin 20 mg CRESTOR-annoksiin tai vertailukelpoisiin HMG-CoA-reduktaasin estäjiin, vaikka ne olivat yleensä ohimeneviä eikä niihin liittynyt munuaisten toiminnan heikkenemistä. Vaikka tämän löydön kliinistä merkitystä ei tunneta, annoksen pienentämistä tulee harkita CRESTOR-hoitoa saavilla potilailla, joilla on selittämätöntä jatkuvaa proteinuriaa ja/tai hematuriaa rutiininomaisen virtsaanalyysin aikana.
Endokriiniset vaikutukset
HbA1c-arvon nousua ja seerumin paastoglukoosipitoisuutta on raportoitu käytettäessä HMG-CoA-reduktaasin estäjiä, mukaan lukien CRESTOR. CRESTORin kliinisten tutkimusten tulosten perusteella nämä nousut voivat joissakin tapauksissa ylittää diabetes mellituksen diagnoosin kynnyksen [ks. HAITTAVAIKUTUKSET ].
Vaikka kliiniset tutkimukset ovat osoittaneet, että CRESTOR 10 mg yksinään ei alenna plasman peruskortisolin pitoisuutta tai heikennä lisämunuaisen varausta, varovaisuutta on noudatettava, jos CRESTORia annetaan samanaikaisesti sellaisten lääkkeiden kanssa, jotka voivat vähentää endogeenisten steroidihormonien, kuten ketokonatsolin, spironolaktonin ja simetidiini.
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( POTILASTIEDOT ).
Potilaita tulee neuvoa olemaan ottamatta kahta CRESTOR-annosta 12 tunnin sisällä toisistaan.
Luustolihasvaikutukset
Potilaita tulee neuvoa ilmoittamaan viipymättä selittämättömästä lihaskivusta, -arkuudesta tai -heikkoudesta, erityisesti jos niihin liittyy huonovointisuutta tai kuumetta tai jos nämä lihasoireet jatkuvat CRESTOR-hoidon lopettamisen jälkeen.
Antasidien samanaikainen käyttö
Käytettäessä CRESTOR 5 mg:aa alumiini- ja magnesiumhydroksidiyhdistelmän antasidin kanssa, antasidi tulee ottaa vähintään 2 tuntia CRESTOR 10 mg:n annon jälkeen.
Alkion ja sikiön myrkyllisyys
Kertokaa lisääntymispotentiaalissa olevia naisia sikiölle aiheutuvasta riskistä, käyttämään tehokasta ehkäisyä hoidon aikana ja ilmoittamaan terveydenhuollon tarjoajalle tunnetusta tai epäillystä raskaudesta. [katso VASTA-AIHEET ja Käyttö tietyissä populaatioissa ].
Imetys
Neuvo naisia olemaan imettämättä CRESTOR-hoidon aikana [katso VASTA-AIHEET ja Käyttö tietyissä populaatioissa ].
Maksan entsyymit
Maksaentsyymitestejä suositellaan ennen CRESTOR-hoidon aloittamista ja jos maksavaurion merkkejä tai oireita ilmenee. Kaikkia CRESTOR-hoitoa saaneita potilaita tulee neuvoa ilmoittamaan viipymättä kaikista oireista, jotka voivat viitata maksavaurioon, mukaan lukien väsymys, ruokahaluttomuus, epämukavuus oikealla ylävatsassa, tumma virtsa tai keltaisuus.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Rotilla tehdyssä 104 viikkoa kestäneessä karsinogeenisuustutkimuksessa 2, 20, 60 tai 80 mg/kg/vrk annoksilla suun kautta letkuletkulla kohdun stroomapolyyppien ilmaantuvuus lisääntyi merkitsevästi naarailla 80 mg/kg/vrk systeemisillä annoksilla. altistuminen 20 kertaa ihmisen altistukseen verrattuna annoksella 40 mg/vrk AUC:n perusteella. Polyyppien ilmaantuvuuden lisääntymistä ei havaittu pienemmillä annoksilla.
107 viikkoa kestäneessä karsinogeenisuustutkimuksessa hiirillä, joille annettiin 10, 60 tai 200 mg/kg/vrk suun kautta letkuruokinnalla, havaittiin maksasoluadenooman/karsinooman ilmaantuvuuden lisääntyminen annoksella 200 mg/kg/vrk, kun systeeminen altistus oli 20 kertaa suurempi kuin ihmisen altistus. 40 mg/vrk AUC:n perusteella. Maksasolukasvainten ilmaantuvuuden lisääntymistä ei havaittu pienemmillä annoksilla.
Rosuvastatiini ei ollut mutageeninen tai klastogeeninen metabolisen aktivaation kanssa tai ilman sitä Ames-testissä Salmonella typhimuriumin ja Escherichia colin kanssa, hiiren lymfoomatestissä ja kromosomipoikkeavuusmäärityksessä kiinanhamsterin keuhkosoluissa. Rosuvastatiini oli negatiivinen hiiren in vivo mikrotumatestissä.
Rotan hedelmällisyyttä koskevissa tutkimuksissa 5, 15, 50 mg/kg/vrk annostelulla uroksia hoidettiin 9 viikkoa ennen parittelua ja sen ajan ja naaraita 2 viikkoa ennen parittelua ja koko parittelun ajan tiineyspäivään 7 asti. Ei haitallisia vaikutuksia. vaikutus hedelmällisyyteen havaittiin annoksella 50 mg/kg/vrk (systeeminen altistus jopa 10 kertaa suurempi kuin ihmisen altistus annoksella 40 mg/vrk AUC:n perusteella). Rosuvastatiinilla 30 mg/kg/vrk yhden kuukauden ajan käsiteltyjen koirien kiveksissä havaittiin spermatidisia jättiläissoluja. Spermatidisia jättiläissoluja havaittiin apinoissa 6 kuukauden hoidon jälkeen annoksella 30 mg/kg/vrk siemenputkimaisen epiteelin vakuolaation lisäksi. Koiran altistus oli 20-kertainen ja apinan 10-kertainen altistuminen ihmiselle annoksella 40 mg/vrk perustuen kehon pinta-alaan. Samanlaisia löydöksiä on havaittu muiden tämän luokan lääkkeiden yhteydessä.
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
CRESTOR 5 mg on vasta-aiheinen raskaana oleville naisille, koska turvallisuutta raskaana oleville naisille ei ole varmistettu, eikä CRESTOR 20 mg -hoidosta ole ilmeistä hyötyä raskauden aikana. Koska HMG-CoA-reduktaasin estäjät vähentävät kolesterolin synteesiä ja mahdollisesti muiden kolesterolista peräisin olevien biologisesti aktiivisten aineiden synteesiä, CRESTOR voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana oleville naisille. CRESTOR 5 mg -hoito tulee lopettaa heti, kun raskaus todetaan [ks VASTA-AIHEET ]. Rosuvastatiinin käytöstä julkaistut rajoitetut tiedot eivät riitä määrittämään lääkkeeseen liittyvää vakavien synnynnäisten epämuodostumien tai keskenmenon riskiä. Eläinten lisääntymistutkimuksissa ei havaittu haitallisia kehitysvaikutuksia, kun rosuvastatiinia annettiin suun kautta organogeneesin aikana systeemisillä altistuksilla, jotka vastaavat suurinta suositeltua ihmisannosta (MRHD) 40 mg/vrk rotilla tai kaniineilla (perustuen AUC-arvoon ja kehon pinta-alaan, vastaavasti). ). Rotilla ja kaniineilla poikasten/sikiön eloonjääminen väheni 12 kertaa ja vastaavasti MRHD:tä 40 mg/vrk [ks. Data ].
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski ilmoitetulle väestölle ei ole tiedossa. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2-4 % ja 15-20 %.
Data
Ihmistiedot
Rosuvastatiinista julkaistut rajoitetut tiedot eivät ole osoittaneet suurentunutta vakavien synnynnäisten epämuodostumien tai keskenmenon riskiä. Harvinaisia raportteja synnynnäisistä epämuodostumista on saatu kohdunsisäisen altistuksen jälkeen muille statiineille. Noin 100 simvastatiinille tai lovastatiinille altistuneiden naisten prospektiivisesti seurattua raskautta koskevassa katsauksessa synnynnäisten epämuodostumien, spontaanien keskenmenojen ja sikiökuolemien/kuolemansyntyneiden ilmaantuvuus ei ylittänyt sitä, mitä yleisväestössä odotettaisiin. Tapausten määrä on riittävä sulkemaan pois synnynnäisten epämuodostumien ≥ 3-4-kertainen lisääntyminen taustalla esiintyvään ilmaantuvuuteen verrattuna. 89 %:ssa prospektiivisesti seuranneista raskauksista lääkehoito aloitettiin ennen raskautta ja lopetettiin jossain vaiheessa ensimmäisen raskauskolmanneksen aikana, kun raskaus todettiin.
Eläinten tiedot
Rosuvastatiini läpäisee istukan rotilla ja kaniineilla, ja sitä löytyy sikiökudoksesta ja lapsivedestä 3 %:ssa ja 20 %:ssa emon plasman pitoisuudesta, kun rotilla annettiin kerta-annoksena 25 mg/kg oraalista letkulla 16. raskauspäivänä. Kaneilla havaittiin korkeampi sikiökudokseen jakautuminen (25 %:n emon plasmapitoisuus) 1 mg/kg kerta-annoksen jälkeen suun kautta annettaessa 18. raskauspäivänä.
Rosuvastatiinin antaminen ei osoittanut teratogeenista vaikutusta rotilla annoksella ≤25 mg/kg/vrk tai kaneilla ≤3 mg/kg/vrk (annokset, jotka vastaavat MRHD:tä 40 mg/vrk perustuen AUC:hen ja kehon pinta-alaan, vastaavasti).
Naarasrotilla, joille annettiin 5, 15 ja 50 mg/kg/vrk ennen parittelua ja jatkettiin tiineyspäivään 7 asti, johti sikiön painon laskuun (naaraspennut) ja luutumisen viivästymiseen annoksella 50 mg/kg/vrk (10 kertaa ihmisen altistus MRHD-annos 40 mg/vrk AUC:n perusteella).
Tiineillä rotilla, joille annettiin rosuvastatiinia 2, 10 ja 50 mg/kg/vrk tiineyspäivästä 7 aina imetyspäivään 21 (vieroitus), poikasten eloonjääminen väheni annoksella 50 mg/kg/vrk (annos, joka vastaa 12 kertaa MRHD:tä 40 mg /vrk perusteella kehon pinta-ala).
Tiineillä kaniineilla, joille annettiin rosuvastatiinia 0,3, 1 ja 3 mg/kg/vrk tiineyspäivän 6 ja 18 välisenä aikana, havaittiin sikiön elinkelpoisuuden heikkenemistä ja emojen kuolleisuutta annoksella 3 mg/kg/vrk (annos, joka vastaa MRHD:tä 40 mg/vrk). päivä kehon pinta-alan perusteella).
Imetys
Riskien yhteenveto
Rosuvastatiinin käyttö on vasta-aiheista imetyksen aikana [katso VASTA-AIHEET ]. Rajalliset tiedot osoittavat, että CRESTOR erittyy äidinmaitoon. Lääkkeen vaikutuksista imetettävään lapseen tai lääkkeen vaikutuksista maidontuotantoon ei ole saatavilla tietoa. Imetettävän lapsen vakavien haittavaikutusten mahdollisuuden vuoksi kerro potilaille, että imetystä ei suositella CRESTOR-hoidon aikana.
Naaraat ja urokset, joilla on lisääntymispotentiaali
Ehkäisy
CRESTOR voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle [ks Käyttö tietyissä populaatioissa ]. Kehota lisääntymiskykyisiä naisia käyttämään tehokasta ehkäisyä CRESTOR-hoidon aikana.
Käyttö lapsille
8–17-vuotiailla lapsilla ja nuorilla, joilla on heterotsygoottinen familiaalinen hyperkolesterolemia, CRESTOR 10 mg:n turvallisuus ja tehokkuus ruokavalion lisänä kokonaiskolesterolin, LDL-kolesterolin ja ApoB-tasojen alentamiseksi, kun riittävän ruokavaliohoitokokeen jälkeen LDL -C yli 190 mg/dl tai kun LDL-kolesteroli ylittää 160 mg/dl ja suvussa on positiivinen ennenaikainen sydän- ja verisuonitauti tai kaksi tai useampia muita sydän- ja verisuonisairauksien riskitekijöitä, todettiin yhdessä kontrolloidussa tutkimuksessa ja yhdessä avoimessa, kontrolloimattomassa tutkimuksessa. oikeudenkäynti [katso Kliiniset tutkimukset ]. Lapsuudessa aloitetun CRESTOR-hoidon pitkäaikaista tehoa aikuisiän sairastuvuuden ja kuolleisuuden vähentämiseen ei ole osoitettu.

CRESTOR 5 mg:n turvallisuutta ja tehokkuutta 10–17-vuotiailla lapsilla ja nuorilla, joilla oli heterotsygoottinen familiaalinen hyperkolesterolemia, arvioitiin kontrolloidussa kliinisessä tutkimuksessa, joka kesti 12 viikkoa ja jota seurasi 40 viikon avoin altistus. Potilailla, joita hoidettiin 5 mg:lla, 10 mg:lla ja 20 mg:lla päivittäin CRESTOR 10 mg:lla, haittavaikutusprofiili oli yleensä samanlainen kuin lumelääkettä saaneilla potilailla. CRESTORilla ei ollut havaittavissa olevaa vaikutusta kasvuun, painoon, painoindeksiin (painoindeksi) tai seksuaaliseen kypsymiseen [ks. Kliiniset tutkimukset ] lapsilla ja nuorilla (10–17-vuotiaat).
CRESTORia ei ole tutkittu kontrolloiduissa kliinisissä tutkimuksissa ennen murrosikää tai alle 10-vuotiaita potilaita, joilla on heterotsygoottinen familiaalinen hyperkolesterolemia. CRESTORin turvallisuutta ja tehokkuutta arvioitiin kuitenkin kaksivuotisessa avoimessa kontrolloimattomassa tutkimuksessa, johon osallistui 8–17-vuotiaita lapsia ja nuoria, joilla oli heterotsygoottinen familiaalinen hyperkolesterolemia [ks. Kliiniset tutkimukset ]. CRESTOR 5 mg:n turvallisuus ja teho LDL-kolesterolin alentamisessa näyttivät yleisesti ottaen olevan yhtäpitäviä aikuispotilailla havaitun turvallisuuden ja tehon kanssa huolimatta kontrolloimattoman tutkimussuunnitelman rajoituksista.
7–15-vuotiaita lapsia ja nuoria, joilla oli homotsygoottinen familiaalinen hyperkolesterolemia, tutkittiin 6 viikkoa kestäneessä satunnaistetussa, lumekontrolloidussa ristikkäistutkimuksessa CRESTOR-annoksella 20 mg kerran vuorokaudessa, mitä seurasi 12 viikon avoin hoito [ks. Kliiniset tutkimukset ]. Yleisesti ottaen tämän tutkimuksen turvallisuusprofiili oli yhdenmukainen aikuisilla aiemmin määritetyn turvallisuusprofiilin kanssa.
Vaikka kaikkia aikuisväestöllä tunnistettuja haittavaikutuksia ei ole havaittu lapsilla ja nuorilla potilailla tehdyissä kliinisissä tutkimuksissa, samoja varoituksia ja varotoimia aikuisille tulee harkita myös lapsille ja nuorille. Nuoria naisia tulee neuvoa sopivista ehkäisymenetelmistä CRESTOR 5 mg -hoidon aikana [ks. Käyttö tietyissä populaatioissa ].
Geriatrinen käyttö
CRESTORin kliinisissä tutkimuksissa osallistuneista 10 275 potilaasta 3159 (31 %) oli vähintään 65-vuotiaita ja 698 (6,8 %) 75-vuotiaita tai vanhempia. Yleisiä eroja turvallisuudessa tai tehokkuudessa ei havaittu näiden ja nuorempien koehenkilöiden välillä, ja muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa, mutta joidenkin vanhempien henkilöiden suurempaa herkkyyttä ei voida sulkea pois.
Iäkkäillä potilailla on suurempi myopatian riski, ja CRESTORia tulee määrätä varoen vanhuksille [ks. VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ].
Munuaisten vajaatoiminta
Lievä tai kohtalainen munuaisten vajaatoiminta (CLcr ≥30 ml/min/1,73 m²) ei vaikuta rosuvastatiinialtistukseen. Altistuminen rosuvastatiinille lisääntyy kliinisesti merkitsevästi potilailla, joilla on vaikea munuaisten vajaatoiminta (CLcr ANNOSTELU JA HALLINNOINTI , VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ].
Maksan vajaatoiminta
CRESTOR on vasta-aiheinen potilailla, joilla on aktiivinen maksasairaus, johon voi sisältyä selittämätöntä ja jatkuvaa maksan transaminaasiarvojen nousua. Kroonisen alkoholin aiheuttaman maksasairauden tiedetään lisäävän rosuvastatiinialtistusta; CRESTOR 20 mg:aa tulee käyttää varoen näillä potilailla [ks VASTA-AIHEET , VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ].
Aasialaiset potilaat
Farmakokineettiset tutkimukset ovat osoittaneet noin kaksinkertaisen keskimääräisen rosuvastatiinialtistuksen aasialaisilla koehenkilöillä verrattuna valkoihoisiin kontrolleihin. CRESTOR-annosta tulee säätää aasialaispotilailla [katso ANNOSTELU JA HALLINNOINTI ja KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
Yliannostuksen varalta ei ole erityistä hoitoa. Yliannostustapauksessa potilasta tulee hoitaa oireenmukaisesti ja tukitoimenpiteitä on aloitettava tarvittaessa. Hemodialyysi ei lisää merkittävästi rosuvastatiinin puhdistumaa.
VASTA-AIHEET
CRESTOR 20mg on vasta-aiheinen seuraavissa olosuhteissa:
- Potilaat, joiden tiedetään olevan yliherkkiä jollekin tämän tuotteen aineosalle. CRESTORin käytön yhteydessä on raportoitu yliherkkyysreaktioita, mukaan lukien ihottuma, kutina, nokkosihottuma ja angioedeema [ks. HAITTAVAIKUTUKSET ].
- Potilaat, joilla on aktiivinen maksasairaus, johon voi sisältyä selittämätöntä jatkuvaa maksan transaminaasiarvojen nousua [ks. VAROITUKSET JA VAROTOIMET ].
- Raskaus [katso Käyttö tietyissä populaatioissa ].
- Imetys. Rajalliset tiedot osoittavat, että CRESTOR 20 mg erittyy äidinmaitoon. Koska statiinit voivat aiheuttaa vakavia haittavaikutuksia imeväisille, naiset, jotka tarvitsevat CRESTOR-hoitoa, eivät saa imettää lapsiaan [ks. Käyttö tietyissä populaatioissa ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
CRESTOR 10mg on selektiivinen ja kilpaileva HMG-CoA-reduktaasin estäjä. Se on nopeutta rajoittava entsyymi, joka muuttaa 3-hydroksi-3-metyyliglutaryylikoentsyymi A:n mevalonaatiksi, kolesterolin esiasteeksi. Eläimillä tehdyt in vivo -tutkimukset ja viljellyillä eläin- ja ihmissoluilla tehdyt in vitro -tutkimukset ovat osoittaneet, että rosuvastatiinilla on korkea imeytyminen ja selektiivisyys maksaan, kolesterolin alentamisen kohde-elimeen. In vivo- ja in vitro -tutkimuksissa rosuvastatiini tuottaa lipidejä modifioivan vaikutuksensa kahdella tavalla. Ensinnäkin se lisää maksan LDL-reseptorien määrää solun pinnalla LDL:n oton ja katabolian tehostamiseksi. Toiseksi rosuvastatiini estää VLDL:n synteesiä maksassa, mikä vähentää VLDL- ja LDL-partikkelien kokonaismäärää.
Farmakodynamiikka
CRESTOR 5 mg annoksesta riippuen vähentää kohonnutta LDL-kolesterolia ja alentaa kokonaiskolesterolia ja triglyseridejä sekä lisää HDL-kolesterolia [ks. Kliiniset tutkimukset ]. Terapeuttinen vaste CRESTOR 5 mg:lle on ilmeinen viikon kuluessa hoidon aloittamisesta, ja 90 % maksimivasteesta saavutetaan yleensä kahdessa viikossa. Maksimaalinen vaste saavutetaan yleensä 4 viikon kuluttua ja säilyy sen jälkeen. Lääkeannostuksen yksilöinnin tulisi perustua terapeuttiseen vasteeseen [katso ANNOSTELU JA HALLINNOINTI ].
Farmakokinetiikka
Imeytyminen
Ihmisillä tehdyissä kliinisissä farmakologisissa tutkimuksissa rosuvastatiinin huippupitoisuudet plasmassa saavutettiin 3–5 tuntia suun kautta otetun annoksen jälkeen. Sekä Cmax että AUC suurenivat suunnilleen suhteessa CRESTOR 10 mg annokseen. Rosuvastatiinin absoluuttinen hyötyosuus on noin 20 %.
CRESTORin antaminen ruoan kanssa ei vaikuttanut rosuvastatiinin AUC-arvoon.
Rosuvastatiinin AUC-arvo ei poikkea illalla tai aamulla annetun lääkkeen antamisen jälkeen.
Jakelu
Rosuvastatiinin vakaan tilan keskimääräinen jakautumistilavuus on noin 134 litraa. Rosuvastatiinista 88 % sitoutuu plasman proteiineihin, enimmäkseen albumiiniin. Tämä sitoutuminen on palautuvaa ja riippumaton plasman pitoisuuksista.
Eliminointi
Rosuvastatiini eliminoituu pääasiassa ulosteen mukana. Rosuvastatiinin eliminaation puoliintumisaika on noin 19 tuntia.
Aineenvaihdunta
Rosuvastatiini ei metaboloidu laajasti; noin 10 % radioaktiivisesti leimatusta annoksesta erittyy metaboliittina. Päämetaboliitti on N-desmetyylirosuvastatiini, jota muodostuu pääasiassa sytokromi P450 \ 2C9, ja in vitro -tutkimukset ovat osoittaneet, että N-desmetyylirosuvastatiinilla on noin kuudesosa - puolet alkuperäisen yhdisteen HMG-CoA-reduktaasia estävästä vaikutuksesta. . Kaiken kaikkiaan yli 90 % aktiivisesta plasman HMG-CoA-reduktaasia inhiboivasta aktiivisuudesta johtuu lähtöaineesta.
Erittyminen
Suun kautta annettuna rosuvastatiini ja sen metaboliitit erittyvät pääasiassa ulosteeseen (90 %). Laskimonsisäisen annoksen jälkeen noin 28 % kokonaispuhdistumasta tapahtui munuaisten kautta ja 72 % maksan kautta.
Tietyt populaatiot
Rotu- tai etniset ryhmät
Populaatiofarmakokineettinen analyysi ei paljastanut kliinisesti merkittäviä farmakokinetiioissa eroja valkoihoisten, latinalaisamerikkalaisten ja mustien tai afrokaribialaisten ryhmien välillä. Farmakokineettiset tutkimukset, mukaan lukien Yhdysvalloissa tehty tutkimus, ovat kuitenkin osoittaneet noin kaksinkertaisen mediaanialtistuksen (AUC ja Cmax) kohoamisen aasialaisilla koehenkilöillä valkoihoiseen kontrolliryhmään verrattuna.
Mies- ja naispotilaat
Rosuvastatiinin plasmapitoisuuksissa ei ollut eroja miesten ja naisten välillä.
Pediatriset potilaat
Populaatiofarmakokineettisessä analyysissä kahdesta lapsitutkimuksesta, joihin osallistui 10–17-vuotiaita ja 8–17-vuotiaita potilaita, joilla oli heterotsygoottinen familiaalinen hyperkolesterolemia, rosuvastatiinialtistus näytti olevan verrattavissa tai pienempi kuin rosuvastatiinialtistus aikuisilla potilailla.
Geriatriset potilaat
Rosuvastatiinin plasmapitoisuuksissa ei ollut eroja ei-iäkkäiden ja iäkkäiden (ikä ≥65 vuotta) välillä.
Potilaat, joilla on munuaisten vajaatoiminta
Lievä tai kohtalainen munuaisten vajaatoiminta (CLcr ≥30 ml/min/1,73 m²) ei vaikuttanut plasman rosuvastatiinin pitoisuuksiin. Plasman rosuvastatiinin pitoisuudet nousivat kuitenkin kliinisesti merkitsevästi (noin 3-kertaiseksi) potilailla, joilla oli vaikea munuaisten vajaatoiminta (CLcr 80 ml/min/ 1,73 m²).
Hemodialyysi
Rosuvastatiinin vakaan tilan pitoisuudet plasmassa kroonista hemodialyysipotilailla olivat noin 50 % suuremmat verrattuna terveisiin vapaaehtoisiin, joiden munuaistoiminta oli normaali.
Potilaat, joilla on maksan vajaatoiminta
Potilailla, joilla oli krooninen alkoholi-maksasairaus, plasman rosuvastatiinin pitoisuudet olivat hieman suurentuneet.
Child-Pugh A -tautia sairastavilla potilailla Cmax suureni 60 % ja AUC 5 % verrattuna potilaisiin, joiden maksatoiminta oli normaali. Child-Pugh B -tautia sairastavilla potilailla Cmax suureni 100 % ja AUC 21 % verrattuna potilaisiin, joiden maksatoiminta oli normaali.
Huumeiden vuorovaikutustutkimukset
Rosuvastatiinin puhdistuma ei ole kliinisesti merkittävässä määrin riippuvainen sytokromi P450 3A4:n metaboliosta.
Rosuvastatiini on substraatti tietyille kuljettajaproteiineille, mukaan lukien maksan sisäänoton kuljettaja, orgaanista anionia kuljettava polyproteiini 1B1 (OATP1B1) ja rintasyöpäresistenssiproteiini (BCRP). CRESTOR 10 mg:n samanaikainen anto lääkkeiden kanssa, jotka ovat näiden kuljettajaproteiinien estäjiä (esim. syklosporiini, tietyt HIV-proteaasin estäjät) voi johtaa plasman rosuvastatiinin pitoisuuksien nousuun (ks. ANNOSTELU JA HALLINNOINTI ja HUUMEIDEN VUOROVAIKUTUKSET ].
Farmakogenomiikka
HMG-CoA-reduktaasin estäjien, mukaan lukien rosuvastatiinin, jakautuminen sisältää OATP1B1:n ja muiden kuljettajaproteiinien. Rosuvastatiinin korkeampia pitoisuuksia plasmassa on raportoitu hyvin pienissä potilasryhmissä (n=3–5), joilla on kaksi heikentynyttä OATP1B1:tä koodaavan geenin alleelia (SLCO1B1 521T > C). Tämän genotyypin (eli SLCO1B1 521 C/C) esiintymistiheys on yleensä alle 5 % useimmissa rodullisissa/etnisissä ryhmissä. Tämän polymorfismin vaikutusta rosuvastatiinin tehoon ja/tai turvallisuuteen ei ole selkeästi osoitettu.
Eläinten toksikologia ja/tai farmakologia
Keskushermoston myrkyllisyys
Keskushermoston verisuonivaurioita, joille on tunnusomaista perivaskulaariset verenvuodot, turvotus ja perivaskulaaristen tilojen mononukleaaristen solujen tunkeutuminen, on havaittu koirilla, joita on hoidettu useilla muilla tämän lääkeluokan jäsenillä. Kemiallisesti samanlainen tähän luokkaan kuuluva lääke aiheutti annosriippuvaista näköhermon rappeutumista (retinogeniculate fibers -rappeumaa) koirilla annoksella, joka tuotti plasman lääkepitoisuudet noin 30 kertaa korkeampi kuin keskimääräinen lääketaso ihmisillä, jotka ottivat suurinta suositeltua annosta. Turvotusta, verenvuotoa ja osittaista nekroosia suonipunoksen interstitiumissa havaittiin naaraskoiralla, joka tapettiin kuolevana päivänä 24 annoksella 90 mg/kg/vrk suun kautta letkuletkulla (systeeminen altistus 100 kertaa ihmisen altistus annoksella 40 mg/vrk perustuen AUC). Sarveiskalvon sameutta havaittiin koirilla, joita hoidettiin 52 viikon ajan annoksella 6 mg/kg/vrk oraalisella letkulla (systeeminen altistus 20 kertaa ihmisen altistus annoksella 40 mg/vrk perustuen AUC:hen). Kaihia havaittiin koirilla, joita hoidettiin 12 viikon ajan letkuruokinnalla annoksella 30 mg/kg/vrk (systeeminen altistus 60 kertaa ihmisen altistus annoksella 40 mg/vrk perustuen AUC:hen). Verkkokalvon dysplasiaa ja verkkokalvon menetystä havaittiin koirilla, joita hoidettiin 4 viikon ajan letkuruokinnalla annoksella 90 mg/kg/vrk (systeeminen altistus 100 kertaa ihmisen altistus annoksella 40 mg/vrk perustuen AUC-arvoon). Annokset ≤30 mg/kg/vrk (systeeminen altistus ≤60 kertaa ihmisen altistukseen verrattuna annoksella 40 mg/vrk AUC:n perusteella) eivät paljastaneet verkkokalvon löydöksiä hoidon aikana enintään vuoden ajan.
Nuorten toksikologinen tutkimus
Nuorisotutkimuksessa rotille annettiin 10 tai 50 mg/kg/vrk vieroituksesta 9 viikon ajan ennen pariutumista ja ruumiinavausta edeltävään päivään asti uroksilla tai 7. raskauspäivään asti naaraille. Vaikutuksia seksuaaliseen kehitykseen, kivesten ja lisäkivesen ulkonäköön tai hedelmällisyyteen ei havaittu kummallakaan annostasolla (2-kertainen tai enintään 24-kertainen ihmisen altistus (AUC) suurimmalla lasten annoksella 20 mg/vrk).
Kliiniset tutkimukset
Hyperlipidemia ja sekamuotoinen dyslipidemia
CRESTOR 5 mg alentaa kokonaiskolesterolia, LDL-kolesterolia, ApoB-kolesterolia, ei-HDL-kolesterolia ja TG:tä sekä lisää HDL-kolesterolia aikuispotilailla, joilla on hyperlipidemia ja sekamuotoinen dyslipidemia.
Annosaluetutkimus
Monikeskustutkimuksessa, kaksoissokkoutetussa, lumekontrolloidussa, annosvaihteluissa potilailla, joilla oli hyperlipidemia, CRESTOR annettiin yhtenä vuorokautisena annoksena 6 viikon ajan merkitsevästi kokonaiskolesteroli-, LDL-kolesteroli-, ei-HDL-kolesteroli- ja ApoB-arvoja koko annoksen verran. alue (taulukko 6).
Aktiivisesti kontrolloitu tutkimus
CRESTOR 5 mg:aa verrattiin HMG-CoA-reduktaasin estäjiin atorvastatiiniin, simvastatiiniin ja pravastatiiniin avoimessa monikeskustutkimuksessa, jossa oli 2 240 potilasta, joilla oli hyperlipidemia tai sekamuotoinen dyslipidemia. Satunnaistamisen jälkeen potilaita hoidettiin 6 viikon ajan kerta-annoksella joko CRESTORia 20 mg, atorvastatiinia, simvastatiinia tai pravastatiinia (kuva 1 ja taulukko 7).
Kuva 1: LDL-kolesterolin prosentuaalinen muutos CRESTOR 20 mg:n, atorvastatiinin, simvastatiinin ja pravastatiinin annoksella viikolla 6 potilailla, joilla on hyperlipidemia tai sekamuotoinen dyslipidemia 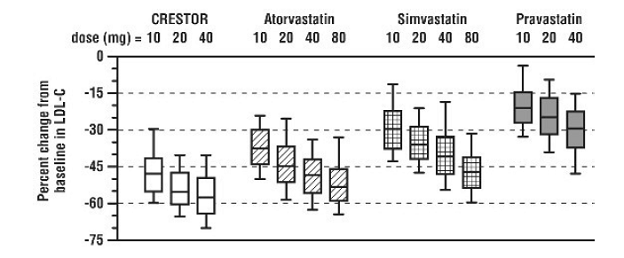
Laatikkokaaviot edustavat 25., 50. ja 75. prosenttipisteen arvoja, ja viikset edustavat 10. ja 90. prosenttipisteen arvoa. Keskimääräinen lähtötason LDL-C: 189 mg/Dl
Heterotsygoottinen familiaalinen hyperkolesterolemia
Aktiivisesti kontrolloitu tutkimus
Tutkimuksessa potilailla, joilla oli heterotsygoottinen FH (keskimääräinen LDL 291), potilaat satunnaistettiin saamaan 20 mg CRESTORia tai 20 mg atorvastatiinia. Annosta suurennettiin 6 viikon välein. Merkittäviä LDL-C:n laskuja lähtötasosta havaittiin kummassakin annoksessa molemmissa hoitoryhmissä (taulukko 8).
Hypertriglyseridemia
Annos-vastetutkimus
Kaksoissokkoutetussa, lumekontrolloidussa annos-vastetutkimuksessa potilailla, joiden lähtötason TG-tasot olivat 273-817 mg/dl, CRESTOR 10 mg kerta-annoksena (5-40 mg) 6 viikon ajan alensi merkittävästi seerumin TG-tasoja ( Taulukko 9).
Primaarinen dysbetalipoproteinemia (tyypin III hyperlipoproteinemia)
Satunnaistetussa monikeskustutkimuksessa kaksoissokkoutetussa risteytystutkimuksessa 32 potilasta (27 ε2/ε2 ja 4 apo E-mutaatiota [Arg145Cys], joilla oli primaarinen dysbetalipoproteinemia (tyypin III hyperlipoproteinemia) aloitti 6 viikon ruokavalion aloitusjakson NCEP:ssä. Terapeuttinen elämäntapamuutos (TLC) -ruokavalio. Ruokavalion johdannon jälkeen potilaat satunnaistettiin TLC-ruokavalion yhteydessä 6 viikon ajaksi: rosuvastatiinia 10 mg ja sen jälkeen rosuvastatiinia 20 mg tai rosuvastatiinia 20 mg ja sen jälkeen rosuvastatiinia 10 mg CRESTOR alensi ei-HDL-C:n (ensisijainen päätepiste) ja verenkierron jäännöslipoproteiinitasoja Tulokset on esitetty alla olevassa taulukossa.
Homotsygoottinen familiaalinen hyperkolesterolemia
Annostitraustutkimus
Avoimessa, pakkotitraustutkimuksessa homotsygoottisten FH-potilaiden (n=40, 8–63 vuotta) vastetta arvioitiin CRESTOR-annoksen 20–40 mg annoksen suhteen 6 viikon välein. Koko väestössä LDL-kolesterolin keskimääräinen lasku lähtötasosta oli 22 %. Noin kolmasosa potilaista hyötyi annoksen nostamisesta 20 mg:sta 40 mg:aan, jolloin LDL-arvo aleni edelleen yli 6 %. Niillä 27 potilaalla, joilla LDL-kolesteroli väheni vähintään 15 %, LDL-kolesterolin keskimääräinen lasku oli 30 % (mediaani 28 % lasku). Niistä 13 potilaasta, joiden LDL-kolesteroli laski alle 15 %, 3:lla ei ollut muutosta tai LDL-kolesterolin nousu. LDL-kolesterolin alenemista 15 % tai enemmän havaittiin kolmella viidestä potilaasta, joiden tiedetään olevan reseptorinegatiivinen.
Lapsipotilaat, joilla on homotsygoottinen familiaalinen hyperkolesterolemia
CRESTORia tutkittiin satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa, monikeskustutkimuksessa, jossa oli 14 lasta ja nuorta, joilla oli homotsygoottinen familiaalinen hyperkolesterolemia. Tutkimus sisälsi 4 viikon ruokavalion aloitusvaiheen, jonka aikana potilaat saivat CRESTORia 10 mg päivässä, jakovaihe, joka sisälsi kaksi 6 viikon hoitojaksoa joko CRESTOR 20 mg:lla tai lumelääkeellä satunnaisessa järjestyksessä, mitä seurasi 12- viikon avoin vaihe, jonka aikana kaikki potilaat saivat 20 mg CRESTORia. Potilaiden ikä vaihteli 7–15-vuotiaista (mediaani 11 vuotta), 50 % oli miehiä, 71 % valkoihoisia, 21 % aasialaisia, 7 % mustia, eikä yksikään potilas ollut latinalaisamerikkalaista etnistä. 50 prosenttia oli afereesihoidossa ja 57 prosenttia etsetimibiä. Potilaat, jotka osallistuivat tutkimukseen afereesihoidolla tai etsetimibillä, jatkoivat hoitoa koko tutkimuksen ajan. Keskimääräinen LDL-kolesteroli lähtötilanteessa oli 416 mg/dl (vaihteluväli 152-716 mg/dl). Yhteensä 13 potilasta suoritti satunnaistetun jakovaiheen molemmat hoitojaksot; yksi potilas peruutti suostumuksensa, koska se ei kyennyt ottamaan verta vaihtovaiheen aikana.
CRESTOR 20 mg alensi merkitsevästi LDL-kolesterolia, kokonaiskolesterolia, ApoB:tä ja ei-HDL-kolesterolia lumelääkkeeseen verrattuna (taulukko 11).
Pediatriset potilaat, joilla on heterotsygoottinen familiaalinen hyperkolesterolemia
Kaksoissokkoutetussa, satunnaistetussa, monikeskustutkimuksessa, lumekontrolloidussa, 12 viikkoa kestäneessä tutkimuksessa 176 (97 miestä ja 79 naista) lasta ja nuorta, joilla oli heterotsygoottinen familiaalinen hyperkolesterolemia, satunnaistettiin saamaan rosuvastatiinia 5, 10 tai 20 mg tai lumelääkettä päivittäin. Potilaiden ikä oli 10–17 vuotta (mediaani-ikä 14 vuotta), noin 30 % potilaista oli 10–13-vuotiaita ja noin 17 %, 18 %, 40 % ja 25 % Tannerin vaiheissa II, III, IV, ja V, vastaavasti. Naisilla oli vähintään 1 vuosi kuukautisten jälkeen. Keskimääräinen LDL-kolesteroli oli lähtötilanteessa 233 mg/dl (vaihteluväli 129-399). 12 viikon kaksoissokkovaihetta seurasi 40 viikon avoin annostitrausvaihe, jossa kaikki potilaat (n=173) saivat 5 mg, 10 mg tai 20 mg rosuvastatiinia vuorokaudessa.
Rosuvastatiini alensi merkitsevästi LDL-kolesterolia (ensisijainen päätepiste), kokonaiskolesteroli- ja ApoB-tasoja kullakin annoksella lumelääkkeeseen verrattuna. Tulokset on esitetty alla olevassa taulukossa 12.
12 viikon kaksoissokkohoitojakson lopussa alle 110 mg/dl (2,8 mmol/l) LDL-kolesterolitavoitteen saavuttaneiden potilaiden prosenttiosuus oli 0 % lumelääkettä saaneiden ja 12 % rosuvastatiinin 5 mg:n ryhmässä. 41 % rosuvastatiinilla 10 mg ja 41 % rosuvastatiinilla 20 mg. 40 viikon avoimen vaiheen aikana 71 % potilaista titrattiin enimmäisannokseen 20 mg ja 41 % potilaista saavutti LDL-kolesterolitavoitteen 110 mg/dl.
Rosuvastatiinia tutkittiin myös kaksivuotisessa avoimessa, kontrolloimattomassa tutkimuksessa, jossa titrattiin tavoitteeksi 175 lasta ja nuorta, joilla oli heterotsygoottinen familiaalinen hyperkolesterolemia ja jotka olivat 8–17-vuotiaita (79 poikaa ja 96 tyttöä). Kaikilla potilailla oli dokumentoitu geneettinen vika LDL-reseptorissa tai ApoB:ssä. Noin 89 % oli valkoihoisia, 7 % aasialaisia, 1 % mustia ja alle 1 % latinalaisamerikkalaisia. Keskimääräinen LDL-kolesteroli oli lähtötilanteessa 236 mg/dl. Viisikymmentäkahdeksan (33 %) potilasta oli lähtötilanteessa esipuberteetti. Rosuvastatiinin aloitusannos kaikille lapsille ja nuorille oli 5 mg kerran vuorokaudessa. 8–10-vuotiaat lapset (n = 41 lähtötilanteessa) voivat titrata enimmäisannoksen 10 mg kerran vuorokaudessa, ja 10–17-vuotiaat lapset ja nuoret voivat titrata enimmäisannoksen 20 mg kerran vuorokaudessa.
LDL-kolesterolin aleneminen lähtötasosta oli yleensä johdonmukaista kaikissa ikäryhmissä tutkimuksen aikana sekä aiemman kokemuksen kanssa sekä aikuisten että lasten kontrolloiduista tutkimuksista.
Lapsuudessa aloitetun rosuvastatiinihoidon pitkäaikaista tehoa aikuisiän sairastuvuuden ja kuolleisuuden vähentämiseen ei ole osoitettu.
Ateroskleroosin etenemisen hidastuminen
Measuring Effects on Intima Media Thickness: an Evaluation Of Rosuvastatin 40 mg (METEOR) -tutkimuksessa CRESTOR-hoidon vaikutus kaulavaltimon ateroskleroosiin arvioitiin B-moodin ultraäänitutkimuksella potilailla, joilla oli kohonnut LDL-kolesteroli ja joilla oli pieni riski (Framingham-riski).
Vuotuinen muutosnopeus lähtötasosta lumelääkeryhmässä oli +0,0131 mm/vuosi (p
Yksittäisen potilaan tasolla CRESTOR-hoitoa saaneessa ryhmässä 52,1 % potilaista osoitti taudin etenemisen puuttumista (määritelty negatiiviseksi vuositasolle) verrattuna 37,7 %:iin lumeryhmässä.
Sydän- ja verisuonisairauksien ensisijainen ehkäisy
Statiinien käytön perustelut primaariehkäisyssä: Rosuvastatiinia arvioiva interventiotutkimus (JUPITER) -tutkimuksessa CRESTORin (rosuvastatiinikalsium) vaikutusta vakavien sydän- ja verisuonitautitapahtumien esiintymiseen arvioitiin 17 802 miehellä (≥ 50 vuotta). ) ja naiset (≥ 60 vuotta), joilla ei ollut kliinisesti ilmeistä sydän- ja verisuonitautia, LDL-kolesteroliarvot
Ensisijainen päätepiste oli yhdistetty päätepiste, joka koostui ajasta ensimmäiseen esiintymiseen minkä tahansa seuraavista tärkeistä sydän- ja verisuonitapahtumista: CV-kuolema, ei-fataali sydäninfarkti, ei-kuolemaan johtava aivohalvaus, sairaalahoito epästabiilin angina pectoriksen vuoksi tai valtimoiden revaskularisaatiomenettely.
Rosuvastatiini vähensi merkitsevästi merkittävien sydän- ja verisuonitapahtumien riskiä (252 tapahtumaa lumeryhmässä vs. 142 tapahtumaa rosuvastatiiniryhmässä) tilastollisesti merkitsevällä (p
Kuva 2: Aika tärkeiden sydän- ja verisuonitapahtumien ensimmäiseen esiintymiseen JUPITERissa 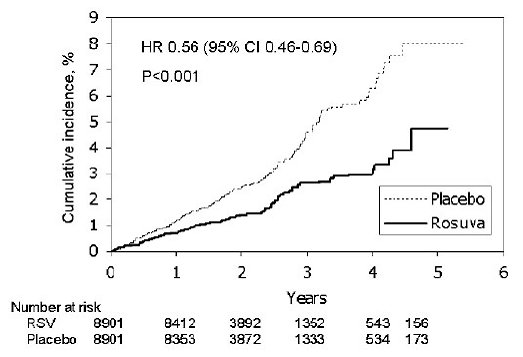
Primaarisen päätepisteen yksittäiset komponentit on esitetty kuvassa 3. Rosuvastatiini vähensi merkittävästi ei-fataalin sydäninfarktin, ei-fataalin aivohalvauksen ja valtimoiden revaskularisaatiotoimenpiteiden riskiä. Rosuvastatiini- ja lumelääkeryhmien välillä ei havaittu merkittäviä eroja sydän- ja verisuoniperäisistä syistä johtuvan kuoleman tai epästabiilin angina pectoriksen vuoksi joutuneiden sairaalahoitojen osalta.
Rosuvastatiini vähensi merkittävästi sydäninfarktin riskiä (6 kuolemaan johtanutta tapahtumaa ja 62 ei-fataalista tapahtumaa lumelääkettä saaneilla koehenkilöillä vs. 9 kuolemaan johtanutta tapahtumaa ja 22 ei-fataalista tapahtumaa rosuvastatiinilla hoidetuilla koehenkilöillä) ja aivohalvauksen riskiä (6 kuolemaan johtanutta tapahtumaa ja 58 ei-kuolentaa lumelääkettä saaneilla potilailla vs. 3 kuolemaan johtanutta tapahtumaa ja 30 ei-kuolemaa rosuvastatiinilla hoidetuilla koehenkilöillä).
Post hoc -alaryhmäanalyysissä JUPITER-potilaista (n = 1405; rosuvastatiini = 725, lumelääke = 680), joiden hsCRP oli ≥ 2 mg/l eikä muita perinteisiä riskitekijöitä (tupakointi, verenpaine ≥ 140/90 tai verenpainelääkkeiden käyttö, alhainen HDL-kolesteroli) ikää lukuun ottamatta korkean HDL-kolesterolin säätämisen jälkeen rosuvastatiinihoidolla ei ollut merkittävää hoitohyötyä.
Kuva 3: Tärkeimmät CV-tapahtumat hoitoryhmittäin JUPITERissa 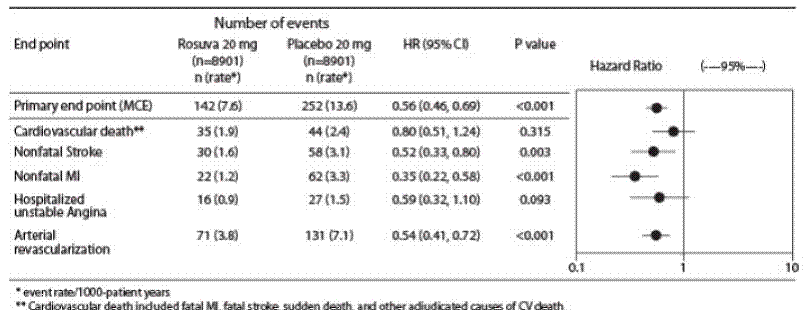
Yhden vuoden kuluttua rosuvastatiini lisäsi HDL-kolesterolia ja alensi LDL-kolesteroli-, hsCRP-, kokonaiskolesteroli- ja seerumin triglyseriditasoja (p
POTILASTIEDOT
CRESTOR® (Kres-tor) rosuvastatiinikalsiumtabletit
Lue nämä potilastiedot huolellisesti ennen kuin aloitat CRESTOR 20 mg:n käytön ja aina, kun saat täyttöä. Jos sinulla on kysyttävää CRESTORista, käänny lääkärin puoleen. Vain lääkärisi voi päättää, sopiiko CRESTOR sinulle.
Mikä on CRESTOR?
CRESTOR 20mg on reseptilääke, joka sisältää kolesterolia alentavaa lääkettä nimeltä rosuvastatiinikalsium. Suurin osa veresi kolesterolista valmistetaan maksassa. CRESTOR 20mg vähentää kolesterolia kahdella tavalla: CRESTOR 5mg estää maksaentsyymin toimintaa, jolloin maksa tuottaa vähemmän kolesterolia, ja CRESTOR 20mg lisää jo veressä olevan kolesterolin ottoa ja hajoamista maksassa.
- CRESTORia käytetään yhdessä ruokavalion kanssa:
- alentaa "pahan" kolesterolin (LDL) tasoa
- nostaa "hyvän" kolesterolin (HDL) tasoa
- alentaa veren rasvapitoisuutta (triglyseridit)
- hidastaa rasvakerrostumien (plakin) muodostumista verisuonten seinämiin
- CRESTORia käytetään hoitoon:
- aikuiset, jotka eivät pysty hallitsemaan kolesterolitasoaan pelkällä ruokavaliolla ja liikunnalla
- 8–17-vuotiaat lapset, joilla on heterotsygoottinen familiaalinen hyperkolesterolemia (perinnöllinen sairaus, joka aiheuttaa korkeita LDL-tasoja)
- 7–17-vuotiaat lapset, joilla on homotsygoottinen familiaalinen hyperkolesterolemia (perinnöllinen sairaus, joka aiheuttaa korkeita LDL-tasoja).
CRESTOR 20 mg ei ole hyväksytty käytettäväksi alle 8-vuotiaille lapsille, joilla on heterotsygoottinen familiaalinen hyperkolesterolemia, eikä alle 7-vuotiaille lapsille, joilla on homotsygoottinen familiaalinen hyperkolesterolemia.
CRESTOR 5 mg:aa käytetään vähentämään sydänkohtausten ja aivohalvausten riskiä 50-vuotiailla ja sitä vanhemmilla miehillä ja 60-vuotiailla ja sitä vanhemmilla naisilla, joilla ei ole tunnettua sydänsairautta, mutta joilla on muita riskitekijöitä.
Ei tiedetä, onko CRESTOR 10mg turvallinen ja tehokas ihmisille, joilla on Fredricksonin tyypin I ja V dyslipidemia.
Kuka ei saa ottaa CRESTORia?
Älä ota CRESTORia, jos:
- olet allerginen rosuvastatiinikalsiumille tai jollekin CRESTORin aineosalle. Katso tämän pakkausselosteen lopusta täydellinen luettelo CRESTORin ainesosista.
- sinulla on maksaongelmia.
- olet raskaana tai epäilet olevasi raskaana tai suunnittelet raskautta. CRESTOR 20 mg voi vahingoittaa sikiötäsi. Jos tulet raskaaksi, lopeta CRESTORin käyttö ja ota heti yhteys lääkäriin. Jos et suunnittele raskautta, sinun tulee käyttää tehokasta ehkäisyä CRESTOR-hoidon aikana.
- imettävät. Lääkkeet, kuten CRESTOR 5 mg, voivat erittyä äidinmaitoon ja vahingoittaa vauvaasi.
Mitä minun pitäisi kertoa lääkärilleni ennen CRESTORin käyttöä ja sen aikana?
Kerro lääkärillesi, jos:
- sinulla on selittämättömiä lihaskipuja tai -heikkoutta
- sinulla on tai on ollut munuaisongelmia
- sinulla on tai on ollut maksaongelmia
- juo yli 2 lasillista alkoholia päivässä
- sinulla on kilpirauhasen ongelmia
- ovat 65-vuotiaita tai vanhempia
- ovat aasialaista syntyperää
- olet raskaana tai epäilet olevasi raskaana tai suunnittelet raskautta
- imettävät
Kerro lääkärillesi kaikista käyttämistäsi lääkkeistä, mukaan lukien resepti- ja käsikauppalääkkeet, vitamiinit ja yrttilisät.
Keskustele lääkärisi kanssa ennen kuin aloitat uusien lääkkeiden käytön.
CRESTOR 20 mg:n ottaminen tiettyjen muiden lääkkeiden kanssa voi vaikuttaa toisiinsa aiheuttaen sivuvaikutuksia. CRESTOR voi vaikuttaa muiden lääkkeiden tehoon, ja muut lääkkeet voivat vaikuttaa CRESTORin toimintaan.
Kerro lääkärillesi erityisesti, jos otat:
- siklosporiini (immuunijärjestelmääsi tehostava lääke)
- gemfibrotsiili (fibriinihappolääke kolesterolin alentamiseen)
- viruslääkkeet, mukaan lukien HIV- tai hepatiitti C -proteaasin estäjät (kuten lopinaviiri, ritonaviiri, fosamprenaviiri, tipranaviiri, atatsanaviiri tai simepreviiri)
- tietyt sienilääkkeet (kuten itrakonatsoli, ketokonatsoli ja flukonatsoli)
- kumariiniantikoagulantit (verihyytymiä estävät lääkkeet, kuten varfariini)
- niasiini tai nikotiinihappo
- fibriinihappojohdannaiset (kuten fenofibraatti)
- kolkisiini (kihdin hoitoon käytettävä lääke)
Pyydä lääkäriltäsi tai apteekista luettelo näistä lääkkeistä, jos et ole varma.
Tiedä kaikki käyttämäsi lääkkeet. Pidä niistä luetteloa näyttääksesi lääkärillesi ja apteekkiin, kun saat uuden lääkkeen.
Miten minun pitäisi ottaa CRESTOR 10mg?
- Ota CRESTORia juuri sen verran kuin lääkärisi on määrännyt.
- Ota CRESTOR suun kautta kerran päivässä. Niele tabletti kokonaisena.
- CRESTOR voidaan ottaa mihin aikaan päivästä tahansa, ruoan kanssa tai ilman.
- Älä muuta annostasi tai lopeta CRESTOR 10 mg -hoito keskustelematta lääkärisi kanssa, vaikka tuntisit olosi hyväksi.
- Lääkärisi voi tehdä verikokeita kolesterolitasosi tarkistamiseksi ennen CRESTOR-hoitoa ja sen aikana. Lääkärisi voi muuttaa CRESTOR 10 mg -annostasi tarvittaessa.
- Lääkärisi saattaa aloittaa sinulle kolesterolia alentavan ruokavalion ennen CRESTORin antamista. Pysy tällä ruokavaliolla, kun otat CRESTORia.
- Odota vähintään 2 tuntia CRESTORin ottamisen jälkeen ottaaksesi antasidin, joka sisältää alumiinin ja magnesiumhydroksidin yhdistelmän.
- Jos unohdat ottaa CRESTOR 10 mg -annoksen, ota se heti kun muistat. Kuitenkin, Älä ota kahta CRESTOR 10 mg annosta 12 tunnin sisällä toisistaan.
- Jos otat liikaa CRESTOR 20 mg -valmistetta tai otat yliannostuksen, soita heti lääkärillesi tai mene lähimmän sairaalan ensiapuun.
Mitkä ovat CRESTOR 20mg:n mahdolliset sivuvaikutukset?
CRESTOR 10mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Lihaskipu, arkuus ja heikkous (myopatia). Lihasongelmat, mukaan lukien lihasten hajoaminen, voivat olla vakavia joillekin ihmisille ja aiheuttaa harvoin munuaisvaurioita, jotka voivat johtaa kuolemaan. Kerro heti lääkärillesi, jos:
- sinulla on selittämätöntä lihaskipua, arkuutta tai heikkoutta, varsinkin jos sinulla on kuumetta tai tunnet itsesi tavallista väsyneemmäksi CRESTOR-hoidon aikana.
- sinulla on lihasongelmia, jotka eivät häviä senkään jälkeen, kun lääkärisi on kehottanut sinua lopettamaan CRESTORin käytön. Lääkärisi voi tehdä lisätutkimuksia lihasongelmien syyn diagnosoimiseksi.
Mahdollisuutesi saada lihasongelmia on suurempi, jos:
- käytät tiettyjä muita lääkkeitä CRESTOR-hoidon aikana
- ovat 65-vuotiaita tai vanhempia
- sinulla on kilpirauhasen vajaatoiminta (hypotyreoosi), joita ei saada hallintaan
- on munuaisongelmia
- käytät suurempia CRESTOR-annoksia
- Maksaongelmat. Lääkärisi tulee ottaa verikokeita maksan tarkistamiseksi ennen kuin aloitat CRESTOR 5 mg -hoidon ja jos sinulla on maksaongelmia CRESTOR-hoidon aikana. Soita lääkärillesi välittömästi, jos sinulla on jokin seuraavista maksaongelmien oireista:
- tuntuu epätavallisen väsyneeltä tai heikolta
- ruokahalun menetys
- ylävatsan kipu
- tumma virtsa
- ihosi tai silmänvalkuaisten keltaisuus
Yleisimpiä sivuvaikutuksia voivat olla: päänsärky, lihassärky ja -kipu, vatsakipu, heikkous ja pahoinvointi.
Muita CRESTORin käytön yhteydessä raportoituja sivuvaikutuksia ovat muistin menetys ja sekavuus.
Kerro lääkärillesi, jos sinulla on jokin haittavaikutus, joka häiritsee sinua tai joka ei häviä.
Nämä eivät ole kaikki CRESTORin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka minun pitäisi säilyttää CRESTOR 20mg?
- Säilytä CRESTOR 10 mg huoneenlämmössä, 20 °C - 25 °C (68 °F - 77 °F) ja kuivassa paikassa.
- Hävitä vanhentuneet tai tarpeettomat lääkkeet turvallisesti.
Pidä CRESTOR 10 mg ja kaikki lääkkeet poissa lasten ulottuvilta.
Mitä CRESTORin ainesosia on?
Aktiivinen ainesosa: rosuvastatiini rosuvastatiinikalsiumina
Ei-aktiiviset ainesosat: mikrokiteinen selluloosa NF, laktoosimonohydraatti NF, kolmiemäksinen kalsiumfosfaatti NF, krospovidoni NF, magnesiumstearaatti NF, hypromelloosi NF, triasetiini NF, titaanidioksidi USP, keltainen rautaoksidi ja punainen rautaoksidi NF.
Yleistä tietoa CRESTORin turvallisesta ja tehokkaasta käytöstä
Lääkkeitä määrätään joskus muihin tarkoituksiin kuin potilasohjeessa lueteltuihin tarkoituksiin. Älä käytä CRESTOR 10 mg -valmistetta sairauteen, johon sitä ei ole määrätty. Älä anna CRESTOR 20 mg:aa muille ihmisille, vaikka heillä olisi sama sairaus kuin sinulla. Se voi vahingoittaa heitä.
Voit kysyä apteekista tai lääkäriltä tietoja CRESTOR 5mg -valmisteesta, joka on kirjoitettu terveydenhuollon ammattilaisille.
Yhdysvaltain elintarvike- ja lääkevirasto on hyväksynyt nämä potilastiedot, tarkistettu 9/2018
