Kolesterolin hoito: Lipitor 10mg, 20mg, 40mg Atorvastatin Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Lipitor 40mg on ja miten sitä käytetään?
Lipitor 10mg on reseptilääke, jota käytetään alentamaan veren "pahan" kolesterolin (pientiheyksisen lipoproteiinin eli LDL:n) tasoa, lisäämään "hyvän" kolesterolin (HDL) tasoa sekä alentamaan triglyseridejä ja hoitaa korkean kolesterolin (hyperlipidemia) oireita ja vähentää aivohalvauksen, sydänkohtauksen tai muiden sydänkomplikaatioiden riskiä. Lipitor 40 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Lipitor 10mg kuuluu lääkeluokkaan, jota kutsutaan lipidejä alentaviksi aineiksi, statiineiksi, HMG-CoA-reduktaasin estäjiksi.
Ei tiedetä, onko Lipitor 10mg turvallinen ja tehokas alle 10-vuotiaille lapsille.
Mitkä ovat Lipitorin mahdolliset sivuvaikutukset?
Lipitor 10mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- kipua tai polttamista virtsatessa,
- ylävatsakipu,
- heikkous,
- väsynyt olo,
- ruokahalun menetys,
- tumma virtsa,
- ihon tai silmien keltaisuus (keltatauti),
- vähän tai ei ollenkaan virtsaamista,
- turvotus jaloissasi tai nilkoissasi ja
- hengästynyt
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Lipitorin yleisimpiä sivuvaikutuksia ovat:
- nivelkipu,
- tukkoinen nenä,
- kipeä kurkku,
- ripuli ja
- kipu käsissäsi tai jaloissasi
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Lipitorin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
LIPITOR on synteettinen lipidejä alentava aine. Atorvastatiini on 3-hydroksi-3-metyyliglutaryylikoentsyymi A:n (HMG-CoA) reduktaasin estäjä. Tämä entsyymi katalysoi HMG-CoA:n muuttumista mevalonaatiksi, mikä on varhainen andraattia rajoittava vaihe kolesterolin biosynteesissä.
Atorvastatiinikalsium on [R-(R*, R*)]-2-(4-fluorifenyyli)-β, 8-dihydroksi-5-(1-metyylietyyli)-3-fenyyli-4-[(fenyyliamino)karbonyyli]- 1Hpyrroli-1-heptaanihappo, kalsiumsuola (2:1)trihydraatti. Atorvastatiinikalsiumin empiirinen kaava on (C33H34FN2O5)2Ca•3H2O ja sen molekyylipaino on 1209,42. Sen rakennekaava on:
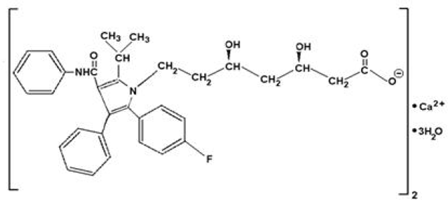
Atorvastatiinikalsium on valkoista tai luonnonvalkoista kiteistä jauhetta, joka ei liukene vesiliuoksiin, joiden pH on 4 tai alle. Atorvastatiinikalsium liukenee hyvin heikosti tislattuun veteen, pH 7,4 fosfaattipuskuriin ja asetonitriiliin; liukenee heikosti etanoliin; ja liukenee vapaasti metanoliin.
Suun kautta annettavat LIPITOR-tabletit sisältävät 10, 20, 40 tai 80 mg atorvastatiinia ja seuraavia inaktiivisia aineosia: kalsiumkarbonaatti, USP; candelilla vaha, FCC; kroskarmelloosinatrium, NF; hydroksipropyyliselluloosa, NF; laktoosimonohydraatti, NF; magnesiumstearaatti, NF; mikrokiteinen selluloosa, NF; Opadry White YS-1-7040 (hypromelloosi, polyetyleeniglykoli, talkki, titaanidioksidi); polysorbaatti 80, NF; simetikoni emulsio.
INDIKAATIOT
Hoidon lipidejä muuttavilla aineilla tulisi olla vain yksi osa useiden riskitekijöiden interventiota henkilöillä, joilla on merkittävästi lisääntynyt riski sairastua hyperkolesterolemian vuoksi ateroskleroottiseen verisuonisairauteen. Lääkehoitoa suositellaan ruokavalion lisänä, kun tyydyttyneitä rasvoja ja kolesterolia sisältävän ruokavalion ja muiden ei-farmakologisten toimenpiteiden vaste yksinään on ollut riittämätön. Potilaille, joilla on sepelvaltimotauti tai useita sepelvaltimotautiin liittyviä riskitekijöitä, LIPITOR 20 mg -hoito voidaan aloittaa samanaikaisesti ruokavalion kanssa.
Sydän- ja verisuonitautien ehkäisy aikuisilla
Aikuisille potilaille, joilla ei ole kliinisesti ilmeistä sepelvaltimotautia, mutta joilla on useita sepelvaltimotaudin riskitekijöitä, kuten ikä, tupakointi, verenpainetauti, alhainen HDL-kolesteroli tai suvussa varhainen sepelvaltimotauti, LIPITOR 10mg on tarkoitettu seuraaviin:
- Vähennä sydäninfarktin riskiä
- Vähennä aivohalvauksen riskiä
- Vähennä revaskularisaatiotoimenpiteiden ja angina pectoriksen riskiä
LIPITOR on tarkoitettu aikuispotilaille, joilla on tyypin 2 diabetes ja joilla ei ole kliinisesti ilmeistä sepelvaltimotautia, mutta joilla on useita sepelvaltimotaudin riskitekijöitä, kuten retinopatia, albuminuria, tupakointi tai verenpainetauti:
- Vähennä sydäninfarktin riskiä
- Vähennä aivohalvauksen riskiä
LIPITOR 20 mg on tarkoitettu aikuispotilaille, joilla on kliinisesti ilmeinen sepelvaltimotauti:
- Vähennä ei-kuolemaan johtavan sydäninfarktin riskiä
- Vähennä kuolemaan johtavan ja ei-kuolemaan johtavan aivohalvauksen riskiä
- Vähennä revaskularisaatiotoimenpiteiden riskiä
- Vähennä riskiä joutua sairaalahoitoon CHF:n vuoksi
- Vähennä angina pectoriksen riskiä
Hyperlipidemia
LIPITOR 20mg on tarkoitettu:
- Ruokavalion lisänä kohonneiden kokonaiskolesteroli-, LDL-kolesteroli-, apo B- ja TG-tasojen alentamiseksi ja HDL-kolesterolin lisäämiseksi aikuispotilailla, joilla on primaarinen hyperkolesterolemia (heterotsygoottinen familiaalinen ja ei-perheellinen) ja sekatyyppinen dyslipidemia (Fredricksonin tyypit IIa ja IIb) ;
- Ruokavalion lisänä aikuispotilaiden, joilla on kohonnut seerumin TG-taso, hoitoon (Fredrickson tyyppi IV);
- Primaarista dysbetalipoproteinemiaa (Fredrickson tyyppi III) sairastavien aikuispotilaiden hoitoon, jotka eivät reagoi riittävästi ruokavalioon;
- Kokonaiskolesterolin ja LDL-kolesterolin vähentämiseen potilailla, joilla on homotsygoottinen familiaalinen hyperkolesterolemia (HoFH) muiden lipidejä alentavien hoitojen (esim. LDL-afereesin) lisänä tai jos tällaisia hoitoja ei ole saatavilla;
- Ruokavalion lisänä kokonaiskolesteroli-, LDL-kolesteroli- ja apo B-tasojen alentamiseksi 10–17-vuotiailla lapsipotilailla, joilla on heterotsygoottinen familiaalinen hyperkolesterolemia (HeFH), jos riittävän ruokavaliohoitokokeen jälkeen seuraavat löydökset ovat esittää:
- suvussa on positiivinen ennenaikainen sydän- ja verisuonitauti tai
- lapsipotilaalla on kaksi tai useampia muuta sydän- ja verisuonisairauksien riskitekijää
Käyttörajoitukset
LIPITOR 40 mg:aa ei ole tutkittu olosuhteissa, joissa suurin lipoproteiinipoikkeavuus on kylomikronien nousu (Fredricksonin tyypit I ja V).
ANNOSTELU JA HALLINNOINTI
Hyperlipidemia ja sekamuotoinen dyslipidemia
LIPITOR 10 mg:n suositeltu aloitusannos on 10 tai 20 mg kerran vuorokaudessa. Potilaat, jotka tarvitsevat suurta LDL-kolesterolin alentamista (yli 45 %), voidaan aloittaa annoksella 40 mg kerran vuorokaudessa. LIPITORin annostusalue on 10-80 mg kerran vuorokaudessa. LIPITOR 10 mg voidaan antaa kerta-annoksena mihin aikaan päivästä tahansa, ruoan kanssa tai ilman. LIPITOR-valmisteen aloitusannos ja ylläpitoannokset tulee määrittää yksilöllisesti potilaan ominaisuuksien, kuten hoidon tavoitteen ja vasteen, mukaan. LIPITOR 10 mg -annoksen aloittamisen ja/tai titrauksen jälkeen lipiditasot tulee analysoida 2–4 viikon kuluessa ja annostusta muuttaa vastaavasti.
Heterotsygoottinen familiaalinen hyperkolesterolemia lapsipotilailla (10-17-vuotiaat)
LIPITOR 10 mg:n suositeltu aloitusannos on 10 mg/vrk; tavallinen annosalue on 10-20 mg suun kautta kerran päivässä [katso Kliiniset tutkimukset ]. Annokset tulee yksilöidä suositellun hoidon tavoitteen mukaan [katso KÄYTTÖAIHEET JA KÄYTTÖ ja KLIININEN FARMAKOLOGIA ]. Säätö tulee tehdä vähintään 4 viikon välein.
Homotsygoottinen familiaalinen hyperkolesterolemia
LIPITOR 20 mg:n annos HoFH-potilaille on 10-80 mg päivässä. LIPITOR 20 mg:aa tulee käyttää näillä potilailla muiden lipidejä alentavien hoitojen (esim. LDL-afereesin) lisänä tai jos tällaisia hoitoja ei ole saatavilla.
Samanaikainen lipidejä alentava hoito
LIPITOR 20mg voidaan käyttää sappihappohartsien kanssa. HMG-CoA-reduktaasin estäjien (statiinien) ja fibraattien yhdistelmää tulee yleensä käyttää varoen [ks. VAROITUKSET JA VAROTOIMET ja HUUMEIDEN VUOROVAIKUTUKSET ].
Annostus potilaille, joilla on munuaisten vajaatoiminta
Munuaissairaus ei vaikuta LIPITORin plasmapitoisuuksiin eikä LDL-kolesterolin alentumiseen. Siksi annoksen muuttaminen potilailla, joilla on munuaisten vajaatoiminta, ei ole tarpeen [katso VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ].
Annostus potilaille, jotka käyttävät syklosporiinia, klaritromysiiniä, itrakonatsolia, letermoviiria tai tiettyjä proteaasin estäjiä
LIPITOR 40 mg -hoitoa tulee välttää potilailla, jotka käyttävät siklosporiinia tai HIV-proteaasin estäjä tipranaviiria ja ritonaviiria tai hepatiitti C -viruksen (HCV) proteaasinestäjä glekapreviiria ja pibrentasviiria tai letermoviiria, kun niitä annetaan samanaikaisesti siklosporiinin kanssa. Jos HIV-potilaalla on käytössä lopinaviiri ja ritonaviiri, käytä pienintä tarvittavaa LIPITOR-annosta. Potilailla, jotka käyttävät klaritromysiiniä, itrakonatsolia, elbasviiria ja gratsopreviiria, tai HIV-potilailla, jotka käyttävät sakinaviirin ja ritonaviirin, darunaviirin ja ritonaviirin, fosamprenaviirin, fosamprenaviirin ja ritonaviirin yhdistelmää tai letermoviirihoitoa LIPITORin kanssa tulee rajoittaa 20 mg:aan, ja asianmukainen kliininen arviointi on tehtävä. On suositeltavaa varmistaa, että käytetään pienintä tarvittavaa LIPITOR 20 mg annosta. Potilailla, jotka käyttävät HIV-proteaasi-inhibiittoria, nelfinaviirihoito ja LIPITOR 10 mg tulee rajoittaa 40 mg:aan (ks. VAROITUKSET JA VAROTOIMET ja HUUMEIDEN VUOROVAIKUTUKSET ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
LIPITOR-tabletit ovat valkoisia elliptisiä, kalvopäällysteisiä, ja niitä on saatavana neljänä vahvuutena (ks. taulukko 1).
Varastointi ja käsittely
10 mg tabletit (10 mg atorvastatiinia): toisella puolella koodi "PD 155" ja toisella "10".
NDC 0071-0155-23 90 pulloa NDC 0071-0155-40 10 x 10 yksikköannoksen läpipainopakkaus
20 mg tabletit (20 mg atorvastatiinia): toisella puolella koodi "PD 156" ja toisella "20".
NDC 0071-0156-23 90 pulloa NDC 0071-0156-40 10 x 10 yksikköannoksen läpipainopakkaus
40 mg tabletit (40 mg atorvastatiinia): toisella puolella koodi "PD 157" ja toisella "40".
NDC 0071-0157-23 90 pulloa NDC 0071-0157-40 10 x 10 yksikköannoksen läpipainopakkaus
80 mg tabletit (80 mg atorvastatiinia): toisella puolella koodi "PD 158" ja toisella "80".
NDC 0071-0158-23 90 pulloa NDC 0071-0158-73 500 pulloa NDC 0071-0158-92 8 x 8 yksikköannoksen läpipainopakkausta
Varastointi
Säilytä kontrolloidussa huoneenlämmössä 20–25 °C (68–77 °F) [katso USP].
Jakelija: Parke-Davis, Division of Pfizer Inc., NY, NY 10017. Tarkistettu: elokuu 2021
SIVUVAIKUTUKSET
Seuraavia vakavia haittavaikutuksia käsitellään tarkemmin etiketin muissa osissa:
- Myopatia ja rabdomyolyysi [katso VAROITUKSET JA VAROTOIMET ]
- Maksaentsyymihäiriöt [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutusten määrää ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin määriin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
LIPITOR lumekontrolloidussa kliinisessä 16 066 potilaan tietokannassa (8755 LIPITOR vs. 7311 lumelääke; ikähaarukka 10-93 vuotta, 39 % naisia, 91 % valkoihoisia, 3 % mustia, 2 % aasialaisia, 4 % muita), joiden mediaani hoidon kesto oli 53 viikkoa, 9,7 % LIPITOR 10 mg:n potilaista ja 9,5 % lumelääkettä saaneista potilaista keskeytti haittavaikutusten vuoksi syy-yhteydestä riippumatta. Viisi yleisintä haittavaikutusta LIPITOR 20 mg:lla hoidetuilla potilailla, jotka johtivat hoidon lopettamiseen ja joita esiintyi useammin kuin lumelääkettä saaneilla, olivat: lihaskipu (0,7 %), ripuli (0,5 %), pahoinvointi (0,4 %), alaniiniaminotransferaasin nousu (0,4 %). %) ja maksaentsyymien nousu (0,4 %).
Yleisimmin raportoidut haittavaikutukset (esiintyvyys ≥ 2 % ja suurempi kuin lumelääke) syy-yhteydestä riippumatta potilailla, joita hoidettiin LIPITORilla lumekontrolloiduissa tutkimuksissa (n = 8755), olivat: nenänielutulehdus (8,3 %), nivelkipu (6,9 %), ripuli ( 6,8 %), raajojen kipu (6,0 %) ja virtsatietulehdus (5,7 %).
Taulukossa 2 on yhteenveto kliinisten haittavaikutusten esiintymistiheydestä kausaalisuudesta riippumatta, ja joita raportoitiin ≥ 2 % ja suurempi kuin lumelääke potilailla, joita hoidettiin LIPITOR-hoidolla (n=8755), seitsemästätoista lumekontrolloidusta tutkimuksesta.
Muita lumekontrolloiduissa tutkimuksissa raportoituja haittavaikutuksia ovat:
Runko kokonaisuudessaan: huonovointisuus, kuume; Ruoansulatuselimistö: vatsakipu, punoitus, ilmavaivat, hepatiitti, kolestaasi; Tuki- ja liikuntaelimistö: tuki- ja liikuntaelinten kipu, lihasväsymys, niskakipu, nivelten turvotus; Aineenvaihdunta ja ravitsemusjärjestelmä: transaminaasien nousu, poikkeava maksan toimintakoe, veren alkalisen fosfataasin nousu, kreatiinifosfokinaasitason nousu, hyperglykemia; Hermosto: painajainen; Hengityselimet: nenäverenvuoto; Iho ja lisäkkeet: urtikaria; Erityiset aistit: näön hämärtyminen, tinnitus; Urogenitaalinen järjestelmä: valkosolut virtsassa positiivisia.
Anglo-Scandinavian Cardiac Outcomes Trial (ASCOT)
ASCOTissa [katso Kliiniset tutkimukset ], johon osallistui 10 305 osallistujaa (ikähaarukka 40–80 vuotta, 19 % naisia; 94,6 % valkoihoisia, 2,6 % afrikkalaisia, 1,5 % eteläaasialaisia, 1,3 % sekalaisia/muita), joita hoidettiin 10 mg:lla LIPITORilla päivässä (n = 5 168) tai lumelääkettä (n) =5 137), LIPITOR 10 mg:lla hoidetun ryhmän turvallisuus- ja siedettävyysprofiili oli verrattavissa lumelääkettä saaneen ryhmän vastaavaan 3,3 vuoden seurannan mediaanien aikana.
Yhteistyö Atorvastatin Diabetes Study (CARDS)
CARDSissa [katso Kliiniset tutkimukset ], johon osallistui 2 838 tyypin 2 diabetesta sairastavaa henkilöä (ikähaarukka 39–77 vuotta, 32 % naisia; 94,3 % valkoihoisia, 2,4 % eteläaasialaisia, 2,3 % afrokaribialaisia, 1,0 % muita), joita hoidettiin 10 mg:lla vuorokaudessa LIPITORilla (n = 1 428) tai lumelääkettä (n=1 410), haittavaikutusten tai vakavien haittavaikutusten yleisessä esiintymistiheydessä ei ollut eroa hoitoryhmien välillä 3,9 vuoden mediaaniseurantajakson aikana. Rabdomyolyysitapauksia ei raportoitu.
Treating To New Targets Study (TNT)
TNT:ssä [katso Kliiniset tutkimukset ], johon osallistui 10 001 koehenkilöä (ikähaarukka 29-78 vuotta, 19 % naisia; 94,1 % valkoihoisia, 2,9 % mustia, 1,0 % aasialaisia, 2,0 % muita), joilla oli kliinisesti ilmeinen sepelvaltimotauti ja joita hoidettiin 10 mg:lla päivittäin LIPITORilla (n = 5006) tai LIPITORilla 80 mg päivässä (n=4995), vakavampia haittavaikutuksia ja haittavaikutuksista johtuvia keskeytyksiä esiintyi korkean atorvastatiiniannoksen ryhmässä (92, 1,8 %; 497, 9,9 %) verrattuna pieniannoksiseen ryhmään (69). 1,4 % ja 404 8,1 %) 4,9 vuoden seurannan mediaanien aikana. Pysyviä transaminaasiarvojen nousuja (≥ 3 x ULN kahdesti 4-10 vuorokauden sisällä) esiintyi 62 (1,3 %) henkilöllä, jotka saivat atorvastatiinia 80 mg ja yhdeksällä (0,2 %) henkilöllä, jotka saivat atorvastatiinia 10 mg. CK-arvon nousu (≥ 10 x ULN) oli yleisesti ottaen alhainen, mutta korkeampi suuren atorvastatiiniannoksen ryhmässä (13, 0,3 %) verrattuna pieniannoksiseen atorvastatiiniryhmään (6, 0,1 %).
Päätepisteiden asteittainen lasku aggressiivisen lipidejä alentavan tutkimuksen (IDEAL) avulla
IDEALissa [katso Kliiniset tutkimukset ], johon osallistui 8 888 henkilöä (ikähaarukka 26-80 vuotta, 19 % naisia; 99,3 % valkoihoisia, 0,4 % aasialaisia, 0,3 % mustia, 0,04 % muita), joita hoidettiin 80 mg/vrk (n = 4439) tai simvastatiinilla 20-40 mg päivittäin (n=4449), haittavaikutusten tai vakavien haittavaikutusten yleisyydessä ei ollut eroa hoitoryhmien välillä 4,8 vuoden mediaaniseurantajakson aikana.
Aivohalvauksen ehkäisy aggressiivisella kolesterolitason vähentämisellä (SPARCL)
SPARCL-tutkimuksessa, johon osallistui 4731 henkilöä (ikähaarukka 21–92 vuotta, 40 % naisia; 93,3 % valkoihoisia, 3,0 % mustia, 0,6 % aasialaisia, 3,1 % muita), joilla ei ollut kliinisesti ilmeistä sepelvaltimotautia, mutta joilla oli aivohalvaus tai ohimenevä iskeeminen kohtaus (TIA) edellisen 6 kuukauden aikana, joita on hoidettu LIPITOR 80 mg:lla (n=2365) tai lumelääke (n=2366) seurannan mediaaniin 4,9 vuoden ajan, pysyvien maksan transaminaasitason nousujen ilmaantuvuus oli suurempi (≥ 3 x ULN kahdesti 4–10 päivää) atorvastatiiniryhmässä (0,9 %) verrattuna lumelääkkeeseen (0,1 %). CK-arvon nousu (> 10 x ULN) oli harvinaista, mutta se oli suurempi atorvastatiiniryhmässä (0,1 %) verrattuna lumelääkkeeseen (0,0 %). Diabetes raportoitiin haittavaikutuksena 144 henkilöllä (6,1 %) atorvastatiiniryhmässä ja 89 koehenkilöllä (3,8 %) lumelääkeryhmässä [ks. VAROITUKSET JA VAROTOIMET ].
Post hoc -analyysissä LIPITOR 80 mg vähensi iskeemisen aivohalvauksen ilmaantuvuutta (218/2365, 9,2 % vs. 274/2366, 11,6 %) ja lisäsi hemorragisen aivohalvauksen ilmaantuvuutta (55/2365, 2,3 % vs. 33/). 2366, 1,4 %) lumelääkkeeseen verrattuna. Kuolemaan johtavan verenvuotohalvauksen ilmaantuvuus oli samanlainen ryhmien välillä (17 LIPITOR 40 mg vs. 18 lumelääkettä). Ei-kuolemaan johtaneiden aivohalvausten ilmaantuvuus oli merkitsevästi suurempi atorvastatiiniryhmässä (38 ei-kuolemaan johtanutta verenvuotokohtausta) verrattuna plaseboryhmään (16 ei-kuolemaan johtanutta aivohalvausta). Koehenkilöillä, jotka osallistuivat tutkimukseen hemorragisen aivohalvauksen kanssa, näytti olevan lisääntynyt verenvuotohalvauksen riski [7 (16 %) LIPITOR vs. 2 (4 %) lumelääke].
Hoitoryhmien välillä ei ollut merkittäviä eroja kokonaiskuolleisuuden osalta: 216 (9,1 %) LIPITOR 80 mg/vrk -ryhmässä vs. 211 (8,9 %) lumeryhmässä. Sydän- ja verisuoniperäisen kuoleman kokeneiden potilaiden osuudet olivat lukumääräisesti pienempiä LIPITOR 80 mg -ryhmässä (3,3 %) kuin lumeryhmässä (4,1 %). Muiden kuin sydän- ja verisuoniperäisten kuolemantapausten kokeneiden osuus oli lukuisesti suurempi LIPITOR 80 mg -ryhmässä (5,0 %) kuin lumeryhmässä (4,0 %).
Lipitor 20mg:n kliinisistä tutkimuksista saadut haittavaikutukset lapsipotilailla
26 viikkoa kestäneessä kontrolloidussa tutkimuksessa pojilla ja postmenarkaalisilla tytöillä, joilla oli HeFH (ikä 10-17 vuotta) (n = 140, 31 % naisia; 92 % valkoihoisia, 1,6 % mustia, 1,6 % aasialaisia, 4,8 % muita) ja LIPITORin 10–20 mg päivittäinen siedettävyysprofiili kokonaiskolesteroli-, LDL-kolesteroli- ja apo B -tasojen alentamiseen lisätyn ruokavalion kanssa oli yleensä samanlainen kuin lumelääkkeellä [ks. Käyttö erityispopulaatioissa ja Kliiniset tutkimukset ].
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu LIPITORin hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Markkinoille tulon jälkeen raportoituja LIPITOR-hoitoon liittyviä haittavaikutuksia, joita ei ole lueteltu yllä, ovat syy-arvioinnista riippumatta seuraavat: anafylaksia, angioneuroottinen turvotus, rakkuloita (mukaan lukien erythema multiforme, Stevens-Johnsonin oireyhtymä ja toksinen epidermaalinen nekrolyysi), rabdomyolyysi , myosiitti, väsymys, jänteen repeämä, kuolemaan johtava ja ei-kuolemaan johtava maksan vajaatoiminta, huimaus, masennus, perifeerinen neuropatia, haimatulehdus ja interstitiaalinen keuhkosairaus.
Immuunivälitteisestä nekrotisoivasta myopatiasta, joka liittyy statiinien käyttöön, on raportoitu harvoin [katso VAROITUKSET JA VAROTOIMET ].
Markkinoille tulon jälkeen on raportoitu harvoin statiinien käyttöön liittyviä kognitiivisia toimintahäiriöitä (esim. muistin menetys, unohtaminen, muistinmenetys, muistin heikkeneminen, sekavuus). Näitä kognitiivisia ongelmia on raportoitu kaikkien statiinien kohdalla. Raportit ovat yleensä ei-vakavia ja palautuvat statiinihoidon lopettamisen jälkeen, ja oireiden alkamisajat vaihtelevat (yhdestä päivästä vuosiin) ja oireiden häviämiseen (mediaani 3 viikkoa).
HUUMEIDEN VUOROVAIKUTUKSET
Lääkeinteraktiot, jotka voivat lisätä myopatian ja rabdomyolyysin riskiä LIPITORin kanssa
LIPITOR on CYP3A4:n ja kuljettajien (esim. OATP1B1/1B3, P-gp tai BCRP) substraatti. LIPITORin plasmapitoisuudet voivat nousta merkittävästi, jos CYP3A4:n estäjiä ja kuljettajia annetaan samanaikaisesti. Taulukossa 3 on luettelo lääkkeistä, jotka voivat lisätä Lipitor-altistusta ja lisätä myopatian ja rabdomyolyysin riskiä, kun niitä käytetään samanaikaisesti, sekä ohjeet niiden ehkäisyyn tai hallintaan [ks. VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ].
Lääkkeiden yhteisvaikutukset, jotka voivat vähentää altistumista LIPITORille
Taulukossa 4 esitetään lääkkeiden yhteisvaikutukset, jotka voivat vähentää altistumista LIPITOR 20 mg:lle, ja ohjeet niiden ehkäisyyn tai hallintaan.
LIPITOR 20mg Vaikutukset muihin lääkkeisiin
Taulukossa 5 on esitetty LIPITORin vaikutus muihin lääkkeisiin ja ohjeet niiden ehkäisyyn tai hallintaan.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Myopatia ja rabdomyolyysi
LIPITOR 10 mg voi aiheuttaa myopatiaa (lihaskipua, arkuutta tai heikkoutta, kun kreatiinikinaasi (CK) ylittää kymmenen kertaa normaalin ylärajan) ja rabdomyolyysiä (myoglobinuriaan liittyvän akuutin munuaisten vajaatoiminnan kanssa tai ilman). Harvinaisia kuolemantapauksia on esiintynyt statiinien, mukaan lukien LIPITORin, käytön yhteydessä tapahtuneen rabdomyolyysin seurauksena.
Myopatian riskitekijät
Myopatian riskitekijöitä ovat 65-vuotiaat tai vanhemmat, hallitsematon kilpirauhasen vajaatoiminta, munuaisten vajaatoiminta, samanaikainen käyttö tiettyjen muiden lääkkeiden kanssa ja korkeampi LIPITOR-annos [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Toimenpiteet myopatian ja rabdomyolyysin riskin ehkäisemiseksi tai vähentämiseksi
LIPITOR-altistus voi lisääntyä lääkkeiden yhteisvaikutuksista johtuen sytokromi P450 -entsyymin 3A4 (CYP3A4) ja/tai kuljettajien (esim. rintasyöpäresistentti proteiini [BCRP], orgaanista anionia kuljettava polypeptidi [OATP1B1/OATP1B3] ja P-glykoproteiini [P] esto. -gp]), mikä lisää myopatian ja rabdomyolyysin riskiä. Siklosporiinin, gemfibrotsiilin, tipranaviirin ja ritonaviirin tai glekapreviirin ja pibrentasviirin samanaikaista käyttöä LIPITORin kanssa ei suositella. LIPITOR 40 mg:n annosmuutoksia suositellaan potilaille, jotka käyttävät tiettyjä viruslääkkeitä, atsoli-sienilääkkeitä tai makrolidiantibioottilääkkeitä [ks. ANNOSTELU JA HALLINNOINTI ]. Myopatia-/rabdomyolyysitapauksia on raportoitu, kun atorvastatiinia on annettu samanaikaisesti lipidejä modifioivilla annoksilla (> 1 gramma/vrk) niasiinia, fibraatteja, kolkisiinia ja ledipasviiria sekä sofosbuviiria. Harkitse, onko näiden tuotteiden käytön hyöty suurempi kuin lisääntynyt myopatian ja rabdomyolyysin riski [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Suuria, yli 1,2 litraa päivässä, greippimehua ei suositella potilaille, jotka käyttävät LIPITORia [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Lopeta LIPITOR-hoito, jos CK-tasot ovat huomattavasti kohonneet tai jos todetaan tai epäillään myopatiaa. Lihasoireet ja CK:n nousu voivat hävitä, jos LIPITOR-hoito lopetetaan. Lopeta väliaikaisesti LIPITOR 40 mg -hoito potilailla, joilla on akuutti tai vakava sairaus, jolla on suuri riski saada munuaisten vajaatoiminta rabdomyolyysin seurauksena (esim. sepsis; sokki; vaikea hypovolemia; suuri leikkaus; trauma; vakavat aineenvaihdunta-, endokriiniset tai elektrolyyttihäiriöt tai hallitsematon epilepsia) .
Kerro potilaille myopatian ja rabdomyolyysin vaarasta, kun aloitat tai suurennat LIPITOR-annosta. Neuvo potilaita ilmoittamaan viipymättä kaikista selittämättömistä lihaskivuista, arkuudesta tai heikkoudesta, erityisesti jos niihin liittyy huonovointisuutta tai kuumetta.
Immuunivälitteinen nekrotisoiva myopatia
Immuunivälitteisestä nekrotisoivasta myopatiasta (IMNM), autoimmuunimyopatiasta, on raportoitu harvoin statiinien käyttöön liittyen. IMNM:lle on tunnusomaista: proksimaalinen lihasheikkous ja kohonnut seerumin kreatiinikinaasi, jotka jatkuvat statiinihoidon lopettamisesta huolimatta; positiivinen anti-HMG-CoA-reduktaasivasta-aine; lihasbiopsia, joka osoittaa nekrotisoivaa myopatiaa; ja parantaminen immunosuppressiivisilla aineilla. Neuromuskulaariset ja serologiset lisätutkimukset voivat olla tarpeen. Hoito immunosuppressiivisilla aineilla saattaa olla tarpeen. Harkitse IMNM:n riskiä huolellisesti ennen toisen statiinin aloittamista. Jos hoito aloitetaan toisella statiinilla, tarkkaile IMNM:n merkkejä ja oireita.
Maksan toimintahäiriö
Statiinit, kuten jotkut muutkin lipidejä alentavat hoidot, on yhdistetty maksan toiminnan biokemiallisiin poikkeaviin. Seerumin transaminaasiarvojen jatkuvaa nousua (> 3 kertaa normaalin yläraja [ULN], esiintyy 2 tai useammin) esiintyi 0,7 %:lla potilaista, jotka saivat LIPITORia kliinisissä tutkimuksissa. Näiden poikkeavuuksien ilmaantuvuus oli 0,2 %, 0,2 %, 0,6 % ja 2,3 % annoksella 10, 20, 40 ja 80 mg.
Yksi potilas kliinisissä tutkimuksissa kehitti keltaisuutta. Maksan toimintakokeiden (LFT) kohoamiseen muilla potilailla ei liittynyt keltaisuutta tai muita kliinisiä merkkejä tai oireita. Kun annosta pienennettiin, lääkitys keskeytettiin tai lopetettiin, transaminaasiarvot palasivat hoitoa edeltäneelle tasolle tai lähelle niitä ilman jälkitauteja. Kahdeksantoista 30 potilaasta, joilla oli jatkuva LFT-tason nousu, jatkoi hoitoa pienemmällä LIPITOR-annoksella.
On suositeltavaa, että maksaentsyymitestit tehdään ennen LIPITOR 40 mg -hoidon aloittamista ja toistetaan kliinisen tarpeen mukaan. Markkinoille tulon jälkeen on raportoitu harvoin kuolemaan johtaneesta ja ei-fataalista maksan vajaatoimintaa potilailla, jotka käyttävät statiineja, mukaan lukien atorvastatiinia. Jos LIPITOR 10 mg -hoidon aikana ilmenee vakava maksavaurio, johon liittyy kliinisiä oireita ja/tai hyperbilirubinemiaa tai keltaisuutta, keskeytä hoito välittömästi. Jos vaihtoehtoista etiologiaa ei löydy, älä käynnistä LIPITORia uudelleen.
LIPITOR 10 mg:aa tulee käyttää varoen potilailla, jotka käyttävät runsaasti alkoholia ja/tai joilla on aiemmin ollut maksasairaus. Aktiivinen maksasairaus tai selittämättömät jatkuvat transaminaasitason nousut ovat vasta-aiheita LIPITORin käytölle [ks. VASTA-AIHEET ].
Endokriininen toiminta
HbA1c-arvon nousua ja seerumin paastoglukoosipitoisuutta on raportoitu käytettäessä HMG-CoA-reduktaasin estäjiä, mukaan lukien LIPITOR.
Statiinit häiritsevät kolesterolin synteesiä ja voivat teoriassa vaimentaa lisämunuaisen ja/tai sukurauhasten steroidien tuotantoa. Kliiniset tutkimukset ovat osoittaneet, että LIPITOR 20 mg ei alenna plasman kortisolin peruspitoisuutta eikä heikennä lisämunuaisen varausta. Statiinien vaikutuksia miesten hedelmällisyyteen ei ole tutkittu riittävällä määrällä potilaita. Mahdollisia vaikutuksia aivolisäkkeen ja sukurauhasen akseliin premenopausaalisilla naisilla ei tunneta. Varovaisuutta on noudatettava, jos statiineja annetaan samanaikaisesti sellaisten lääkkeiden kanssa, jotka voivat alentaa endogeenisten steroidihormonien tasoa tai aktiivisuutta, kuten ketokonatsoli, spironolaktoni ja simetidiini.
Keskushermostotoksisuus
Aivoverenvuotoa havaittiin naaraskoiralla, jota hoidettiin 3 kuukauden ajan annoksella 120 mg/kg/vrk. Aivoverenvuotoa ja näköhermon vakuolisaatiota havaittiin toisella naaraskoiralla, joka lopetettiin kuolevan tilassa sen jälkeen, kun 11 viikon ajan nostettiin annoksia 280 mg/kg/vrk asti. Annos 120 mg/kg johti systeemiseen altistukseen, joka oli noin 16 kertaa suurempi kuin ihmisen plasman käyrän alla oleva pinta-ala (AUC, 0–24 tuntia) ihmisen enimmäisannoksen 80 mg/vrk perusteella. Kaksivuotisessa tutkimuksessa havaittiin yksi tonic kouristuksia kullakin kahdella uroskoiralla (yksi sai 10 mg/kg/vrk ja toinen 120 mg/kg/vrk). Mitään keskushermostovaurioita ei ole havaittu hiirillä enintään 2 vuotta kestäneen pitkäaikaisen hoidon jälkeen annoksilla 400 mg/kg/vrk tai rotilla annoksilla 100 mg/kg/vrk. Nämä annokset olivat 6-11-kertaiset (hiiri) ja 8-16-kertaiset (rotta) ihmisen AUC-arvoon (0–24) perustuen ihmisille suositeltuun enimmäisannokseen 80 mg/vrk.
Muilla tämän luokan jäsenillä hoidetuilla koirilla on havaittu keskushermoston verisuonivaurioita, joille on ominaista perivaskulaariset verenvuodot, turvotus ja perivaskulaaristen tilojen mononukleaaristen solujen infiltraatio. Kemiallisesti samankaltainen tähän luokkaan kuuluva lääke aiheutti näköhermon rappeutumista (retinogeniculaattisäikeiden Wallerin degeneraatiota) kliinisesti normaaleissa koirissa annoksesta riippuvaisella tavalla annoksella, joka tuotti plasman lääkepitoisuudet noin 30 kertaa korkeammat kuin keskimääräinen lääketaso ihmisillä, jotka saivat korkeimman annoksen. suositeltu annos.
Käytä potilailla, joilla on äskettäin aivohalvaus tai TIA
Post hoc -analyysissä aivohalvauksen ehkäisystä aggressiivisella kolesterolitasojen vähentämisellä (SPARCL) -tutkimuksessa, jossa LIPITOR 80 mg vs. lumelääke annettiin 4 731 koehenkilölle, joilla ei ollut sepelvaltimotautia ja joilla oli aivohalvaus tai TIA edellisten 6 kuukauden aikana, suurempi ilmaantuvuus hemorraginen aivohalvaus havaittiin LIPITOR 80 mg -ryhmässä lumelääkkeeseen verrattuna (55, 2,3 % atorvastatiinia vs. 33, 1,4 % lumelääkettä; HR: 1,68, 95 % CI: 1,09, 2,59; p = 0,0168). Kuolemaan johtavan verenvuotohalvauksen ilmaantuvuus oli samanlainen kaikissa hoitoryhmissä (17 vs. 18 atorvastatiini- ja vastaavasti lumeryhmässä). Ei-kuolemaan johtavan verenvuotohalvauksen ilmaantuvuus oli merkitsevästi korkeampi atorvastatiiniryhmässä (38, 1,6 %) verrattuna lumelääkeryhmään (16, 0,7 %).
Jotkut lähtötilanteen ominaisuudet, mukaan lukien verenvuoto ja lakunaarinen aivohalvaus tutkimukseen tullessa, liittyivät hemorragisen aivohalvauksen korkeampaan ilmaantuvuuteen atorvastatiiniryhmässä [ks. HAITTAVAIKUTUKSET ].
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( POTILASTIEDOT ).
LIPITOR 10 mg -valmistetta käyttäville potilaille tulee kertoa, että kolesteroli on krooninen sairaus, ja heidän tulee noudattaa lääkitystään sekä kansallisen kolesterolikasvatusohjelman (NCEP) suosittelemaa ruokavaliota, säännöllistä liikuntaohjelmaa tarvittaessa ja säännöllistä paasto-lipidipaneelin testausta. määrittää tavoitteen saavuttamisen.
Potilaita tulee neuvoa aineista, joita heidän ei pitäisi ottaa samanaikaisesti atorvastatiinin kanssa (ks. VAROITUKSET JA VAROTOIMET). Potilaita tulee myös neuvoa ilmoittamaan muille uutta lääkettä määrääville terveydenhuollon ammattilaisille, että he käyttävät LIPITORia.
Lihaskipu
Kaikille LIPITOR-hoitoa aloittaville potilaille tulee kertoa myopatian riskistä ja heitä tulee kertoa välittömästi kaikista selittämättömistä lihaskivuista, -arkuudesta tai -heikkoudesta, erityisesti jos niihin liittyy huonovointisuutta tai kuumetta tai jos nämä lihasoireet jatkuvat LIPITOR-hoidon lopettamisen jälkeen. Tämän esiintymisen riski kasvaa, kun otat tietyntyyppisiä lääkkeitä tai nautit suurempia määriä (> 1 litra) greippimehua. Heidän tulee keskustella kaikista lääkkeistä, sekä reseptilääkkeistä että reseptivapaista, terveydenhuollon ammattilaisen kanssa.
Maksan entsyymit
Maksaentsyymitestejä suositellaan ennen LIPITOR 40 mg -hoidon aloittamista ja jos maksavaurion merkkejä tai oireita ilmenee. Kaikkia LIPITOR-hoitoa saaneita potilaita tulee neuvoa ilmoittamaan viipymättä kaikista oireista, jotka voivat viitata maksavaurioon, mukaan lukien väsymys, ruokahaluttomuus, epämukavuus oikealla ylävatsassa, tumma virtsa tai keltaisuus.
Alkion ja sikiön myrkyllisyys
Kertokaa lisääntymispotentiaalissa olevia naisia sikiölle aiheutuvasta riskistä, käyttämään tehokasta ehkäisyä hoidon aikana ja ilmoittamaan terveydenhuollon tarjoajalle tunnetusta tai epäillystä raskaudesta [ks. VASTA-AIHEET ja Käyttö tietyissä populaatioissa ].
Imetys
Neuvo naisia olemaan imettämättä LIPITOR-hoidon aikana [katso VASTA-AIHEET ja Käyttö tietyissä populaatioissa ].
Tämän tuotteen merkinnät on saatettu päivittää. Uusimmat reseptitiedot ovat osoitteessa www.pfizer.com.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Kahden vuoden karsinogeenisuustutkimuksessa rotilla 10, 30 ja 100 mg/kg/vrk annoksilla havaittiin kaksi harvinaista kasvainta lihaksissa suuria annoksia saaneilla naarailla: toisessa oli rabdomyosarkooma ja toisessa oli fibrosarkooma. Tämä annos edustaa plasman AUC-arvoa (0–24), joka on noin 16 kertaa suurempi kuin ihmisen plasman keskimääräinen lääkealtistus 80 mg:n oraalisen annoksen jälkeen.
Kaksivuotinen karsinogeenisuustutkimus hiirillä, joille annettiin 100, 200 tai 400 mg/kg/vrk, johti maksan adenoomien merkittävään lisääntymiseen suuria annoksia saaneilla miehillä ja maksakarsinoomien lisääntymiseen suuria annoksia saaneilla naarailla. Nämä löydökset havaittiin plasman AUC-arvoilla (0–24), jotka olivat noin 6 kertaa suuremmat kuin ihmisen plasman keskimääräinen lääkealtistus 80 mg:n oraalisen annoksen jälkeen.
In vitro atorvastatiini ei ollut mutageeninen tai klastogeeninen seuraavissa testeissä metabolisen aktivaation kanssa ja ilman: Ames-testi Salmonella typhimuriumilla ja Escherichia colilla, HGPRT eteenpäin suuntautuva mutaatiomääritys kiinanhamsterin keuhkosoluilla ja kromosomipoikkeavuusmääritys kiinanhamsterin keuhkosoluilla . Atorvastatiini oli negatiivinen hiiren mikrotumatestissä in vivo.
Naarasrotilla atorvastatiini annoksina 225 mg/kg asti (56 kertaa ihmisen altistus) ei aiheuttanut haitallisia vaikutuksia hedelmällisyyteen. Urosrotilla tehdyt tutkimukset annoksilla 175 mg/kg asti (15 kertaa ihmisen altistus) eivät aiheuttaneet muutoksia hedelmällisyydessä. Aplasiaa ja aspermiaa esiintyi lisäkiveksessä kahdella 10:stä rotista, joita hoidettiin atorvastatiinilla 100 mg/kg/vrk 3 kuukauden ajan (16 kertaa ihmisen AUC 80 mg:n annoksella); kivesten painot olivat merkittävästi pienemmät annoksilla 30 ja 100 mg/kg ja lisäkivespaino oli pienempi annoksilla 100 mg/kg. Urosrotilla, joille annettiin 100 mg/kg/vrk 11 viikon ajan ennen parittelua, oli vähentynyt siittiöiden liikkuvuus, siittiöiden pään pitoisuus ja lisääntynyt epänormaali siittiöiden määrä. Atorvastatiini ei aiheuttanut haitallisia vaikutuksia siemennesteen parametreihin tai lisääntymiselinten histopatologiaan koirilla, joille annettiin annoksia 10, 40 tai 120 mg/kg kahden vuoden ajan.
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
LIPITOR 10mg on vasta-aiheinen raskaana oleville naisille, koska turvallisuutta raskaana oleville naisille ei ole varmistettu, eikä lipidejä alentavista lääkkeistä ole ilmeistä hyötyä raskauden aikana. Koska HMG-CoA-reduktaasin estäjät vähentävät kolesterolin synteesiä ja mahdollisesti muiden kolesterolista peräisin olevien biologisesti aktiivisten aineiden synteesiä, LIPITOR voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle. LIPITOR 40 mg -hoito tulee lopettaa heti, kun raskaus todetaan [katso VASTA-AIHEET ]. Rajalliset julkaistut tiedot atorvastatiinin käytöstä eivät riitä määrittämään lääkkeeseen liittyvää vakavien synnynnäisten epämuodostumien tai keskenmenon riskiä. Rotilla ja kaneilla tehdyissä lisääntymistutkimuksissa eläimillä ei havaittu alkio-sikiötoksisuutta tai synnynnäisiä epämuodostumia annoksilla, jotka olivat 30-kertaisia ja 20-kertaisia ihmisen altistukseen verrattuna ihmisen enimmäisannoksella (MRHD) elimistöön perustuen. pinta-ala (mg/m ). Rotilla, joille annettiin atorvastatiinia tiineyden ja imetyksen aikana, havaittiin syntymän jälkeisen kasvun ja kehityksen hidastumista annoksilla, jotka olivat ≥ 6 kertaa MRHD (ks. Data ).
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski ilmoitetulle väestölle ei ole tiedossa. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon taustariski kliinisesti tunnistetuissa raskauksissa on 2–4 % ja 15–20 %.
Data
Ihmistiedot
Havaintotutkimuksista, meta-analyyseistä ja tapausraporteista saadut rajoitetut julkaistut tiedot atorvastatiinikalsiumista eivät ole osoittaneet suurentunutta vakavien synnynnäisten epämuodostumien tai keskenmenon riskiä. Synnynnäisistä epämuodostumista on raportoitu harvoin kohdunsisäisen altistuksen jälkeen muille HMGCoA-reduktaasin estäjille. Noin 100 simvastatiinille tai lovastatiinille altistuneiden naisten prospektiivisesti seurattua raskautta koskevassa katsauksessa synnynnäisten epämuodostumien, spontaanien keskenmenojen ja sikiökuolemien/kuolemansyntyneiden ilmaantuvuus ei ylittänyt sitä, mitä yleisväestössä odotettaisiin. Tapausten määrä on riittävä sulkemaan pois synnynnäisten epämuodostumien ≥ 3-4-kertainen lisääntyminen taustalla esiintyvään ilmaantuvuuteen verrattuna. 89 %:ssa prospektiivisesti seuranneista raskauksista lääkehoito aloitettiin ennen raskautta ja lopetettiin jossain vaiheessa ensimmäisen raskauskolmanneksen aikana, kun raskaus todettiin.
Eläinten tiedot
Atorvastatiini läpäisee rotan istukan ja saavuttaa sikiön maksassa tason, joka vastaa äidin plasman tasoa. Atorvastatiinia annettiin tiineille rotille ja kaneille organogeneesin aikana suun kautta annetuilla annoksilla 300 mg/kg/vrk asti ja kaneille 100 mg/kg/vrk. Atorvastatiini ei ollut teratogeeninen rotilla enintään 300 mg/kg/vrk annoksilla eikä kaniineilla 100 mg/kg/vrk asti. Nämä annokset johtivat noin 30-kertaiseen (rotta) tai 20-kertaiseen (kaniini) ihmisen altistukseen MRHD:llä pinta-alan (mg/m) perusteella. Rotilla emolle toksinen annos 300 mg/kg johti lisääntyneeseen implantaation jälkeiseen menetykseen ja sikiön painon laskuun. Kaniinien emolle toksisilla annoksilla 50 ja 100 mg/kg/vrk lisääntyi implantaation jälkeinen menetys, ja 100 mg/kg/vrk sikiön painot laskivat.
Tiineillä rotilla tehdyssä tutkimuksessa, jolle annettiin 20, 100 tai 225 mg/kg/vrk tiineyspäivästä 7. imetyspäivään 20 (vieroitus), eloonjääminen pieneni syntymän, 4. postnataalisen päivän, vieroituksen ja vieroituksen jälkeen. äideillä, joille annettiin 225 mg/kg/vrk, annos, jolla havaittiin emolle toksisuutta. Pentujen ruumiinpaino laski syntymän jälkeisenä päivänä 21 annoksella 100 mg/kg/vrk ja postnataalisena päivänä 91 annoksella 225 mg/kg/vrk. Pentujen kehitys viivästyi (rotarodin suorituskyky annoksella 100 mg/kg/vrk ja akustinen hätkähdytys annoksella 225 mg/kg/vrk; kynsien irtoaminen ja silmien avaaminen annoksella 225 mg/kg/vrk). Nämä annokset vastaavat 6-kertaista (100 mg/kg) ja 22-kertaista (225 mg/kg) ihmisen altistumista MRHD:llä AUC:n perusteella.
Imetys
Riskien yhteenveto
LIPITOR 40 mg:n käyttö on vasta-aiheista imetyksen aikana [katso VASTA-AIHEET ]. Lääkkeen vaikutuksista imetettävään lapseen tai lääkkeen vaikutuksista maidontuotantoon ei ole saatavilla tietoa. Ei tiedetä, erittyykö atorvastatiinia äidinmaitoon, mutta on osoitettu, että toinen tähän luokkaan kuuluva lääke erittyy äidinmaitoon ja atorvastatiinia on rotan maidossa. Imetettävän lapsen vakavien haittavaikutusten mahdollisuuden vuoksi kerro naisille, että imettämistä ei suositella LIPITOR-hoidon aikana.
Naaraat ja urokset, joilla on lisääntymispotentiaali
Ehkäisy
LIPITOR voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle. Neuvo lisääntymiskykyisiä naisia käyttämään tehokasta ehkäisyä LIPITOR-hoidon aikana [katso Käyttö tietyissä populaatioissa ].

Käyttö lapsille
Heterotsygoottinen familiaalinen hyperkolesterolemia (HeFH)
LIPITOR 20 mg:n turvallisuus ja tehokkuus on osoitettu 10–17-vuotiailla lapsipotilailla, kun HeFH on ruokavalion lisäaine kokonaiskolesterolin, LDL-kolesterolin ja apo B -tasojen alentamiseen riittävän ruokavaliokokeen jälkeen. terapiassa seuraavat:
- LDL-C ≥ 190 mg/dl tai
- LDL-C ≥ 160 mg/dl ja
- positiivinen suvussa esiintynyt FH tai ennenaikainen sydän- ja verisuonitauti ensimmäisen tai toisen asteen sukulaisella, tai
- kaksi tai useampia muuta sydän- ja verisuonisairauksien riskitekijää.
LIPITOR 20 mg:n käyttöä tähän käyttöaiheeseen tukee todisteet [katso ANNOSTELU JA HALLINNOINTI , HAITTAVAIKUTUKSET , KLIININEN FARMAKOLOGIA , ja Kliiniset tutkimukset ]:
- Lumekontrolloitu kliininen tutkimus, joka kesti 6 kuukautta 187 pojalla ja postmenarkaalisella tytöllä, iältään 10-17 vuotta. Potilailla, joita hoidettiin 10 mg:lla tai 20 mg:lla päivittäin LIPITORia, haittavaikutusprofiili oli yleensä samanlainen kuin lumelääkettä saaneilla potilailla. Tässä rajoitetussa kontrolloidussa tutkimuksessa ei ollut merkittävää vaikutusta kasvuun tai seksuaaliseen kypsymiseen pojilla tai kuukautiskierron pituuteen tyttöillä.
- Kolmen vuoden avoin kontrolloimaton tutkimus, johon osallistui 163 10–15-vuotiasta HeFH-potilasta, jotka titrattiin saavuttamaan LDL-kolesterolin tavoitearvo
Neuvo postmenarkaalisille tytöille ehkäisyä koskevista suosituksista, jos se sopii potilaalle [ks Käyttö tietyissä populaatioissa ].
Lapsuudessa aloitetun LIPITOR-hoidon pitkäaikaista tehoa aikuisiän sairastuvuuden ja kuolleisuuden vähentämiseen ei ole osoitettu.
LIPITOR 10 mg:n turvallisuutta ja tehoa ei ole osoitettu alle 10-vuotiailla lapsipotilailla, joilla on HeFH.
Homotsygoottinen familiaalinen hyperkolesterolemia (HoFH)
LIPITOR 20 mg:n kliinistä tehoa annoksilla 80 mg/vrk 1 vuoden ajan arvioitiin kontrolloimattomassa tutkimuksessa HoFH-potilailla, joihin osallistui 8 lapsipotilasta [ks. Kliiniset tutkimukset ].
Geriatrinen käyttö
Niistä 39 828 potilaasta, jotka saivat LIPITOR 40 mg kliinisissä tutkimuksissa, 15 813 (40 %) oli ≥ 65-vuotiaita ja 2 800 (7 %) ≥ 75-vuotiaita. Yleisiä eroja turvallisuudessa tai tehokkuudessa ei havaittu näiden ja nuorempien koehenkilöiden välillä, ja muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa, mutta joidenkin vanhempien aikuisten suurempaa herkkyyttä ei voida sulkea pois. Koska korkea ikä (≥65 vuotta) on myopatialle altistava tekijä, LIPITORia tulee määrätä varoen iäkkäille potilaille.
Maksan vajaatoiminta
Lipitor on vasta-aiheinen potilailla, joilla on aktiivinen maksasairaus, johon voi sisältyä selittämätöntä jatkuvaa maksan transaminaasiarvojen nousua [ks. VASTA-AIHEET ja KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
LIPITORin yliannostukseen ei ole erityistä hoitoa. Yliannostustapauksessa potilasta tulee hoitaa oireenmukaisesti ja tukitoimenpiteitä on aloitettava tarvittaessa. Koska lääkeaine sitoutuu laajalti plasman proteiineihin, hemodialyysin ei odoteta lisäävän merkittävästi LIPITOR 20 mg:n puhdistumaa.
VASTA-AIHEET
- Aktiivinen maksasairaus, johon voi sisältyä selittämätöntä jatkuvaa maksan transaminaasiarvojen nousua
- Yliherkkyys jollekin tämän lääkkeen aineosalle
- Raskaus [katso Käyttö tietyissä populaatioissa].
- Imetys [katso Käyttö tietyissä populaatioissa].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
LIPITOR 20mg on selektiivinen, kilpaileva HMG-CoA-reduktaasin estäjä, nopeutta rajoittava entsyymi, joka muuttaa 3-hydroksi-3-metyyliglutaryylikoentsyymi A:n mevalonaatiksi, sterolien, mukaan lukien kolesterolin, esiasteeksi. Eläinmalleissa LIPITOR 40 mg alentaa plasman kolesteroli- ja lipoproteiinitasoja estämällä HMG-CoA-reduktaasia ja kolesterolisynteesiä maksassa ja lisäämällä maksan LDL-reseptorien määrää solun pinnalla LDL:n oton ja katabolian tehostamiseksi; LIPITOR vähentää myös LDL:n tuotantoa ja LDL-hiukkasten määrää.
Farmakodynamiikka
LIPITOR, kuten myös jotkin sen metaboliiteista, ovat farmakologisesti aktiivisia ihmisillä. Maksa on ensisijainen vaikutuspaikka ja pääasiallinen kolesterolin synteesin ja LDL-puhdistuman paikka. Lääkkeen annostus, pikemminkin kuin systeeminen lääkepitoisuus, korreloi paremmin LDL-kolesterolin alenemisen kanssa. Lääkeannostuksen yksilöinnin tulisi perustua terapeuttiseen vasteeseen [katso ANNOSTELU JA HALLINNOINTI ].
Farmakokinetiikka
Imeytyminen
LIPITOR imeytyy nopeasti oraalisen annon jälkeen; huippupitoisuus plasmassa saavutetaan 1-2 tunnin kuluessa. Imeytymisen laajuus kasvaa suhteessa LIPITOR-annokseen. Atorvastatiinin (emolääke) absoluuttinen hyötyosuus on noin 14 % ja HMG-CoA-reduktaasia estävän vaikutuksen systeeminen hyötyosuus on noin 30 %. Alhainen systeeminen saatavuus johtuu presysteemisestä puhdistumasta maha-suolikanavan limakalvosta ja/tai maksan ensikierron metaboliasta. Vaikka ruoka hidastaa lääkkeen imeytymisnopeutta noin 25 % ja AUC:lla 9 %, LDL-kolesterolin aleneminen on samanlaista riippumatta siitä, annetaanko LIPITOR 40 mg ruoan kanssa vai ilman. Plasman LIPITOR 20 mg:n pitoisuudet ovat pienemmät (noin 30 % Cmax- ja AUC-arvoille) illalla annetun lääkkeen annon jälkeen kuin aamulla. LDL-kolesterolin lasku on kuitenkin sama riippumatta lääkkeen antoajankohdasta [katso ANNOSTELU JA HALLINNOINTI ].
Jakelu
LIPITOR 20 mg:n keskimääräinen jakautumistilavuus on noin 381 litraa. LIPITOR 20 mg sitoutuu ≥ 98 % plasman proteiineihin. Veri/plasma-suhde noin 0,25 osoittaa lääkkeen huonon tunkeutumisen punasoluihin. Rotilla tehtyjen havaintojen perusteella LIPITOR 10mg todennäköisesti erittyy äidinmaitoon [ks. VASTA-AIHEET ja Käyttö tietyissä populaatioissa ].
Aineenvaihdunta
LIPITOR 20mg metaboloituu laajalti orto- ja parahydroksyloiduiksi johdannaisiksi ja erilaisiksi beetahapetustuotteiksi. Orto- ja parahydroksyloituneiden metaboliittien aiheuttama HMG-CoA-reduktaasin esto in vitro vastaa LIPITORin estoa. Noin 70 % verenkierrossa HMG-CoA-reduktaasia estävästä vaikutuksesta johtuu aktiivisista metaboliiteista. In vitro -tutkimukset viittaavat sytokromi P450 3A4:n aiheuttaman LIPITOR 40 mg:n aineenvaihdunnan merkitykseen, mikä on yhdenmukainen LIPITOR 20 mg:n plasmapitoisuuksien lisääntymisen kanssa ihmisillä sen jälkeen, kun sitä on annettu yhdessä erytromysiinin, tämän isotsyymin tunnetun estäjän kanssa [ks. HUUMEIDEN VUOROVAIKUTUKSET ]. Eläimillä ortohydroksimetaboliitin glukuronidoituminen jatkuu edelleen.
Erittyminen
LIPITOR 20 mg ja sen metaboliitit eliminoituvat pääasiassa sappeen maksan ja/tai maksan ulkopuolisen metabolian jälkeen; Lääke ei kuitenkaan näytä läpikäyvän enterohepaattista kierrätystä. LIPITORin keskimääräinen plasman eliminaation puoliintumisaika ihmisillä on noin 14 tuntia, mutta HMG-CoA-reduktaasin estävän vaikutuksen puoliintumisaika on 20-30 tuntia aktiivisten metaboliittien vaikutuksesta. Alle 2 % LIPITOR-annoksesta erittyy virtsaan oraalisen annon jälkeen.
Tietyt populaatiot
Geriatric
LIPITORin plasmapitoisuudet ovat korkeammat (noin 40 % Cmax:sta ja 30 % AUC:sta) terveillä iäkkäillä henkilöillä (ikä ≥ 65 vuotta) kuin nuorilla aikuisilla. Kliiniset tiedot viittaavat siihen, että iäkkäillä potilailla on suurempi LDL-tason lasku millä tahansa lääkeannoksella kuin nuoremmilla aikuisilla [ks. Käyttö tietyissä populaatioissa ].
Pediatriset
Atorvastatiinin näennäinen oraalinen puhdistuma lapsipotilailla näytti samanlaiselta kuin aikuisilla, kun se skaalattiin allometrisesti ruumiinpainon mukaan, koska ruumiinpaino oli ainoa merkittävä kovariaatti atorvastatiinin populaation PK-mallissa, jossa oli tietoja lapsipotilaista (10-17-vuotiaat, n=29) avoimessa 8 viikkoa kestäneessä tutkimuksessa.
Sukupuoli
LIPITOR 40 mg:n plasmapitoisuudet eroavat naisilla ja miehillä (noin 20 % korkeampi Cmax ja 10 % pienempi AUC); LIPITOR 10 mg:n LDL-kolesterolin alenemisessa ei kuitenkaan ole kliinisesti merkitsevää eroa miesten ja naisten välillä.
Munuaisten vajaatoiminta
Munuaissairaus ei vaikuta LIPITORin plasmapitoisuuksiin tai LDL-kolesterolitason laskuun. Siksi annoksen muuttaminen potilailla, joilla on munuaisten vajaatoiminta, ei ole tarpeen [katso ANNOSTELU JA HALLINNOINTI ja VAROITUKSET JA VAROTOIMET ].
Hemodialyysi
Vaikka tutkimuksia ei ole tehty potilailla, joilla on loppuvaiheen munuaissairaus, hemodialyysin ei odoteta lisäävän merkittävästi LIPITOR 10 mg:n puhdistumaa, koska lääke sitoutuu laajasti plasman proteiineihin.
Maksan vajaatoiminta
Potilailla, joilla on krooninen alkoholiperäinen maksasairaus, plasman LIPITOR-pitoisuudet ovat huomattavasti suurentuneet. Cmax ja AUC ovat kumpikin 4 kertaa suuremmat potilailla, joilla on Childs-Pugh A -tauti. Cmax ja AUC ovat noin 16-kertaiset ja vastaavasti 11-kertaiset potilailla, joilla on Childs-Pugh B -tauti [ks. VASTA-AIHEET ].
Huumeiden vuorovaikutustutkimukset
Atorvastatiini on maksan kuljettajien OATP1B1 ja OATP1B3 substraatti. Atorvastatiinin aineenvaihduntatuotteet ovat OATP1B1:n substraatteja. Atorvastatiinin on myös tunnistettu efflux-kuljettajan BCRP:n substraatiksi, mikä saattaa rajoittaa atorvastatiinin imeytymistä suolistosta ja sappipuhdistumaa.
TAULUKKO 6: Samanaikaisesti annettujen lääkkeiden vaikutus atorvastatiinin farmakokinetiikkaan
TAULUKKO 7: Atorvastatiinin vaikutus samanaikaisesti käytettävien lääkkeiden farmakokinetiikkaan
LIPITORilla ei ollut kliinisesti merkitsevää vaikutusta protrombiiniaikaan, kun sitä annettiin potilaille, jotka saivat kroonista varfariinihoitoa.
Kliiniset tutkimukset
Sydän- ja verisuonisairauksien ehkäisy
Anglo-Scandinavian Cardiac Outcomes Trial (ASCOT) -tutkimuksessa LIPITOR 10 mg:n vaikutusta kuolemaan johtaneeseen ja ei-kuolemaan johtaneeseen sepelvaltimotautiin arvioitiin 10 305 verenpainepotilaalla, jotka olivat iältään 40–80-vuotiaita (keskiarvo 63 vuotta), ilman aikaisempaa sydänlihasta. infarkti ja TC-tasot ≤ 251 mg/dl (6,5 mmol/L). Lisäksi kaikilla potilailla oli vähintään 3 seuraavista kardiovaskulaarisista riskitekijöistä: miessukupuoli (81,1 %), ikä > 55 vuotta (84,5 %), tupakointi (33,2 %), diabetes (24,3 %), anamneesissa sepelvaltimotauti ensimmäisen kerran asteen suhteellinen (26 %), TC:HDL > 6 (14,3 %), perifeerinen verisuonisairaus (5,1 %), vasemman kammion hypertrofia (14,4 %), aikaisempi aivoverisuonitapahtuma (9,8 %), spesifinen EKG-poikkeama (14,3 %), proteinuria /albuminuria (62,4 %). Tässä kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa potilaita hoidettiin verenpainetta alentavalla hoidolla (tavoite-BP
LIPITORin 10 mg/vrk vaikutus lipiditasoihin oli samanlainen kuin aikaisemmissa kliinisissä tutkimuksissa.
LIPITOR vähensi merkittävästi sepelvaltimotapahtumien määrää [joko kuolemaan johtava sepelvaltimotauti (46 tapahtumaa lumeryhmässä vs. 40 tapahtumaa LIPITOR 40 mg -ryhmässä) tai ei-kuolemaan johtava MI (108 tapahtumaa lumeryhmässä vs. 60 tapahtumaa LIPITOR-ryhmässä) 20 mg ryhmä)] suhteellisella riskin pienenemisellä 36 % [(perustuu 1,9 %:n esiintyvyyteen LIPITOR 40 mg:lla vs. 3,0 % lumelääkkeellä), p = 0,0005 (katso kuva 1)]. Riskin pieneneminen oli johdonmukaista iästä, tupakoinnin tilasta, liikalihavuudesta tai munuaisten vajaatoiminnasta riippumatta. LIPITORin vaikutus havaittiin LDL-lähtötasosta riippumatta. Tapahtumien vähäisyydestä johtuen naisten tulokset eivät olleet vakuuttavia.
Kuva 1: LIPITOR 10 mg/vrk vaikutus ei-kuolemaan johtavan sydäninfarktin tai sepelvaltimotautikuoleman kumulatiiviseen ilmaantuvuuteen (ASCOT-LLA:ssa)
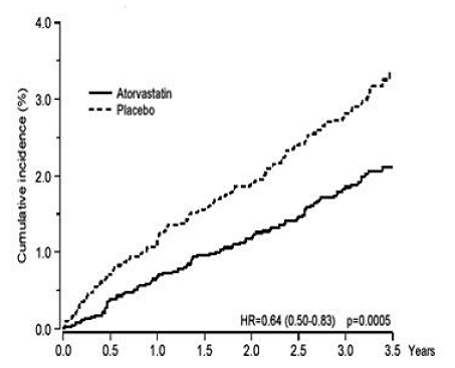
LIPITOR 40 mg vähensi myös merkittävästi revaskularisaatiotoimenpiteiden suhteellista riskiä 42 % (esiintyvyys 1,4 % LIPITOR 20 mg:lla ja 2,5 % lumelääkkeellä). Vaikka kuolemaan johtaneiden ja ei-kuolemaan johtaneiden aivohalvausten väheneminen ei saavuttanut ennalta määriteltyä merkitsevyystasoa (p=0,01), havaittiin suotuisa suuntaus, jossa suhteellinen riski pieneni 26 % (esiintymistiheys 1,7 % LIPITORilla ja 2,3 % lumelääkkeellä). . Kardiovaskulaarisista syistä (p = 0,51) tai muista syistä (p = 0,17) johtuvassa kuolemassa ei ollut merkitsevää eroa hoitoryhmien välillä.
Collaborative Atorvastatin Diabetes Study (CARDS) -tutkimuksessa LIPITORin vaikutusta sydän- ja verisuonitautien (CVD) päätepisteisiin arvioitiin 2838 koehenkilöllä (94 % valkoisia, 68 % miehiä), iältään 40–75-vuotiaita, joilla oli tyypin 2 diabetes WHO:n kriteerien perusteella. joilla ei ole aiempaa sydän- ja verisuonitautia ja LDL ≤ 160 mg/dl ja TG ≤ 600 mg/dl. Diabeteksen lisäksi koehenkilöillä oli yksi tai useampi seuraavista riskitekijöistä: tupakointi (23 %), verenpainetauti (80 %), retinopatia (30 %) tai mikroalbuminuria (9 %) tai makroalbuminuria (3 %). Tutkimukseen ei otettu hemodialyysipotilaita. Tässä monikeskustutkimuksessa, lumekontrolloidussa kaksoissokkoutetussa kliinisessä tutkimuksessa koehenkilöt jaettiin satunnaisesti joko 10 mg:n LIPITOR-annokselle (1429) tai lumelääkettä (1411) suhteessa 1:1, ja heitä seurattiin 3,9 vuoden mediaanikeston ajan. Ensisijainen päätetapahtuma oli minkä tahansa tärkeimmän kardiovaskulaarisen tapahtuman esiintyminen: sydäninfarkti, akuutti CHD-kuolema, epästabiili angina pectoris, sepelvaltimorevaskularisaatio tai aivohalvaus. Ensisijainen analyysi oli aika ensisijaisen päätetapahtuman ensimmäiseen esiintymiseen.
Koehenkilöiden lähtötilanteen ominaisuudet olivat: keski-ikä 62 vuotta, keskimääräinen HbA 7,7 %; mediaani LDL-C 120 mg/dl; mediaani TC 207 mg/dl; mediaani TG 151 mg/dl; mediaani HDL-C 52 mg/dl.
LIPITOR 10 mg/vrk:n vaikutus lipiditasoihin oli samanlainen kuin aikaisemmissa kliinisissä tutkimuksissa.
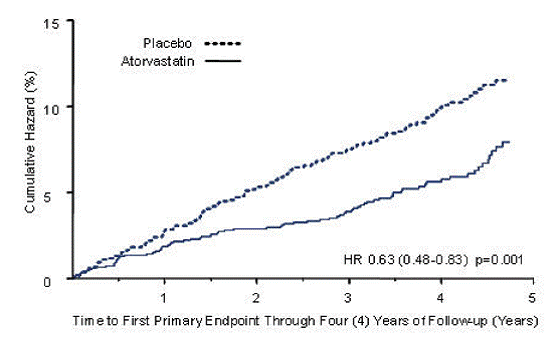
LIPITOR vähensi merkittävästi suurten kardiovaskulaaristen tapahtumien määrää (ensisijaiset päätetapahtumat) (83 tapahtumaa LIPITOR-ryhmässä vs. 127 tapahtumaa lumeryhmässä) suhteellisella riskin pienenemisellä 37 %, HR 0,63, 95 % luottamusväli (0,48, 0,83) (p = 0,001) (katso kuvio 2). LIPITORin vaikutus havaittiin iästä, sukupuolesta tai lähtötason lipiditasoista riippumatta.
LIPITOR 20 mg vähensi merkittävästi aivohalvauksen riskiä 48 % (21 tapahtumaa LIPITOR 10 mg -ryhmässä vs. 39 tapahtumaa lumeryhmässä), HR 0,52, 95 % luottamusväli (0,31, 0,89) (p = 0,016) ja pienensi aivohalvauksen riskiä. MI 42 % (38 tapahtumaa LIPITOR-ryhmässä vs. 64 tapahtumaa lumeryhmässä), HR 0,58, 95,1 % luottamusväli (0,39, 0,86) (p = 0,007). Hoitoryhmien välillä ei ollut merkitsevää eroa angina pectoriksen, revaskularisaatiotoimenpiteiden ja akuutin CHD-kuoleman osalta.
LIPITOR-ryhmässä kuoli 61 ja lumeryhmässä 82 (HR 0,73, p=0,059).
Kuva 2: LIPITORin 10 mg/vrk vaikutus suuren sydän- ja verisuonitapahtuman (sydäninfarkti, akuutti CHD-kuolema, epästabiili angina pectoris, sepelvaltimoiden revaskularisaatio tai aivohalvaus) esiintymisaikaan CARDSissa
Treating to New Targets Study (TNT) -tutkimuksessa LIPITOR 80 mg/vrk vs. LIPITOR 10 mg/vrk vaikutus kardiovaskulaaristen tapahtumien vähenemiseen arvioitiin 10 001 koehenkilöllä (94 % valkoisia, 81 % miehiä, 38 % ≥65). vuotta), joilla on kliinisesti ilmeinen sepelvaltimotauti ja jotka olivat saavuttaneet LDL-kolesterolin tavoitetason
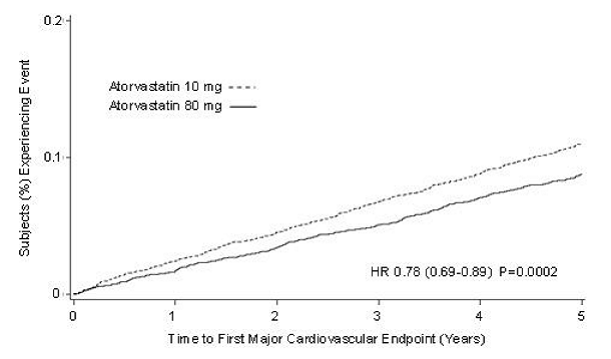
Hoito LIPITOR 80 mg/vrk alensi merkitsevästi MCVE:n määrää (434 tapahtumaa 80 mg/vrk ryhmässä vs. 548 tapahtumaa 10 mg/vrk ryhmässä) suhteellisella riskin pienenemisellä 22 %, HR 0,78, 95 % CI (0,69, 0,89), p = 0,0002 (katso kuvio 3 ja taulukko 9). Kokonaisriskin pieneneminen oli johdonmukaista iästä (
Kuva 3: LIPITOR 80 mg/vrk vs. 10 mg/vrk vaikutus tärkeiden sydän- ja verisuonitapahtumien esiintymisaikaan (TNT)
TAULUKKO 8: Yleiskatsaus TNT:n tehokkuustuloksiin
Tapauksista, jotka käsittivät ensisijaisen tehon päätetapahtuman, hoito LIPITOR-annoksella 80 mg/vrk vähensi merkitsevästi ei-kuolemaan johtaneiden, toimenpiteeseen liittymättömien sydäninfarktin ja kuolemaan johtaneiden ja ei-kuolemaan johtavien aivohalvausten määrää, mutta ei sepelvaltimotautikuolemaa tai elvytettyä sydämenpysähdystä (taulukko 8). Ennalta määritellyistä toissijaisista päätepisteistä hoito LIPITOR 80 mg/vrk -annoksella vähensi merkittävästi sepelvaltimon revaskularisaatiota, angina pectoria ja sairaalahoitoa sydämen vajaatoiminnan vuoksi, mutta ei perifeeristä verisuonisairautta. Sairaalahoidon yhteydessä CHF:n esiintyvyyden vähentyminen havaittiin vain niillä 8 %:lla potilaista, joilla oli aiemmin ollut CHF.
Hoitoryhmien välillä ei ollut merkitsevää eroa kaikesta kuolleisuudesta (taulukko 8). Niiden potilaiden osuudet, jotka kokivat sydän- ja verisuoniperäisen kuoleman, mukaan lukien sepelvaltimotautikuoleman ja kuolemaan johtavan aivohalvauksen komponentit, olivat lukumääräisesti pienempiä LIPITOR 80 mg -ryhmässä kuin LIPITOR 10 mg -hoitoryhmässä. Muiden kuin sydän- ja verisuoniperäisten kuolemantapausten kokeneiden osuudet olivat numerollisesti suuremmat LIPITOR 80 mg -ryhmässä kuin LIPITOR 10 mg -hoitoryhmässä.
Incremental Decrease of Endpoints Through Aggressive Lipid Lowering Study (IDEAL) -hoitoa LIPITOR-annoksella 80 mg/vrk verrattiin hoitoon simvastatiinilla 20-40 mg/vrk 8 888:lla enintään 80-vuotiaalla koehenkilöllä, joilla oli sepelvaltimotauti. arvioida, voidaanko CV-riskiä vähentää. Potilaat olivat pääosin miehiä (81 %), valkoisia (99 %), heidän keski-ikä oli 61,7 vuotta ja keskimääräinen LDL-kolesteroliarvo 121,5 mg/dl satunnaistuksen yhteydessä; 76 % sai statiinihoitoa. Tässä prospektiivisessa, satunnaistetussa, avoimessa, sokkoutetussa päätepistetutkimuksessa (PROBE), jossa ei ollut sisääntulojaksoa, koehenkilöitä seurattiin keskimäärin 4,8 vuoden ajan. Keskimääräiset LDL-kolesteroli-, TC-, TG-, HDL- ja ei-HDL-kolesterolitasot viikolla 12 olivat 78, 145, 115, 45 ja 100 mg/dl hoidon aikana 80 mg:lla LIPITORia 40 mg ja 105, 179, 142, 47 ja 132 mg/dl hoidon aikana 20–40 mg simvastatiinia.
Hoitoryhmien välillä ei ollut merkitsevää eroa ensisijaisen päätetapahtuman, ensimmäisen suuren sepelvaltimotapahtuman (kuolemaan johtava sepelvaltimotauti, ei-fatal MI ja elvytystapahtumien sydänpysähdys) suhteen: 411 (9,3 %) LIPITOR 80 mg/vrk -ryhmässä vs. 463 (10,4 %) simvastatiinin 20–40 mg/vrk ryhmässä, HR 0,89, 95 % luottamusväli (0,78, 1,01), p = 0,07.
Hoitoryhmien välillä ei ollut merkittäviä eroja kokonaiskuolleisuuden osalta: 366 (8,2 %) LIPITOR 80 mg/vrk -ryhmässä vs. 374 (8,4 %) simvastatiini 20 - 40 mg/vrk -ryhmässä. Koehenkilöiden osuudet, jotka kokivat CV-kuoleman tai muun kuin CV-kuoleman, olivat samanlaiset LIPITOR 80 mg -ryhmässä ja simvastatiini 20 - 40 mg -ryhmässä.
Hyperlipidemia ja sekamuotoinen dyslipidemia
LIPITOR alentaa kokonaiskolesterolia, LDL-kolesterolia, VLDL-kolesterolia, apo B:tä ja TG:tä ja lisää HDL-kolesterolia potilailla, joilla on hyperlipidemia (heterotsygoottinen familiaalinen ja ei-perheellinen) ja sekamuotoinen dyslipidemia (Fredricksonin tyypit IIa ja IIb). Terapeuttinen vaste havaitaan 2 viikossa, ja maksimaalinen vaste saavutetaan yleensä 4 viikossa, ja se säilyy kroonisen hoidon aikana.
LIPITOR on tehokas useissa potilaspopulaatioissa, joilla on hyperlipidemia, hypertriglyseridemian kanssa tai ilman, miehillä ja naisilla sekä vanhuksilla.
Kahdessa plasebokontrolloidussa monikeskustutkimuksessa potilailla, joilla oli hyperlipidemia, kerta-annoksena 6 viikon ajan annettu LIPITOR alensi merkitsevästi kokonaiskolesterolia, LDL-kolesterolia, apo B:tä ja TG:tä. (Yhdistetyt tulokset ovat taulukossa 9.)
TAULUKKO 9: Annosvaste potilailla, joilla on primaarinen hyperlipidemia (mukautettu keskimääräinen prosenttimuutos lähtötasosta)*
Potilailla, joilla oli Fredricksonin tyypin IIa ja IIb hyperlipoproteinemia, jotka yhdistettiin 24 kontrolloidusta tutkimuksesta, HDL-kolesterolin (25. Â ja 75. prosenttipiste) prosentuaaliset muutokset lähtötasosta LIPITOR 10, 20, 40 ja 80 mg:lla olivat 6,4 (-1,4, 14), 8,7 (0, 17), 7,8 (0, 16) ja 5,1 (-2,7, 15). Lisäksi yhdistettyjen tietojen analyysi osoitti johdonmukaista ja merkittävää kokonaiskolesteroli-, LDL-kolesteroli-, TG-, kokonaiskolesteroli/HDL-kolesteroli- ja LDLC/HDL-kolesteroliarvojen laskua.
Kolmessa monikeskustutkimuksessa, kaksoissokkotutkimuksessa hyperlipidemiapotilailla, LIPITORia verrattiin muihin statiineihin. Satunnaistamisen jälkeen potilaita hoidettiin 16 viikon ajan joko LIPITORilla 10 mg päivässä tai kiinteällä annoksella vertailuainetta (taulukko 10).
TAULUKKO 10: Keskimääräinen prosenttimuutos lähtötasosta päätepisteessä (kaksoissokko, satunnaistetut, aktiivisesti kontrolloidut kokeet)
Taulukossa 10 esitettyjen hoitojen välisten lipidejä muuttavien vaikutusten erojen vaikutusta kliinisiin tuloksiin ei tunneta. Taulukko 10 ei sisällä tietoja, joissa verrattaisiin LIPITOR 10 mg:n ja suurempien lovastatiinin, pravastatiinin ja simvastatiinin annoksia. Taulukossa olevissa tutkimuksissa verratut lääkkeet eivät välttämättä ole keskenään vaihdettavissa.
Hypertriglyseridemia
LIPITOR-vaste 64 potilaalla, joilla oli eristetty hypertriglyseridemia (Fredrickson-tyyppi IV), joita hoidettiin useissa kliinisissä tutkimuksissa, on esitetty alla olevassa taulukossa (taulukko 11). LIPITOR-hoitoa saaneiden potilaiden TG-lähtötason mediaani (min, max) oli 565 (267–1502).
TAULUKKO 11: Yhdistetyt potilaat, joilla on eristetty kohonnut TG: Mediaani (min, max) prosentuaalinen muutos lähtötasosta
Dysbetalipoproteinemia
Tulokset avoimesta ristikkäistutkimuksesta 16 potilaalla (genotyypit: 14 apo E2/E2 ja 2 apo E3/E2), joilla oli dysbetalipoproteinemia (Fredricksonin tyyppi III), on esitetty alla olevassa taulukossa (taulukko 12).
TAULUKKO 12: Avoin ristikkäinen tutkimus 16 potilaalla, joilla oli dysbetalipoproteinemia (Fredrickson tyyppi III)
Homotsygoottinen familiaalinen hyperkolesterolemia
Tutkimuksessa, jossa ei ollut samanaikaista kontrolliryhmää, 29 HoFH-potilasta iältään 6-37-vuotiaille sai suurimmat vuorokausiannokset 20-80 mg LIPITORia. Keskimääräinen LDL-kolesterolin lasku tässä tutkimuksessa oli 18 %. 25 potilaalla, joilla LDL-kolesteroli oli alentunut, keskimääräinen vaste oli 20 % (vaihteluväli 7 % - 53 %, mediaani 24 %); lopuilla neljällä potilaalla LDL-kolesteroli nousi 7–24 %. Viidellä 29 potilaasta puuttui LDL-reseptoritoiminta. Näistä kahdella potilaalla oli myös portacaval-shuntti, eikä LDL-kolesteroli alentunut merkittävästi. Muilla kolmella reseptorinegatiivisella potilaalla LDL-kolesteroli väheni keskimäärin 22 %.
Heterotsygoottinen familiaalinen hyperkolesterolemia lapsipotilailla
Kaksoissokkoutetussa lumekontrolloidussa tutkimuksessa, jota seurasi avoin vaihe, 187 poikaa ja postmenarkaalista tyttöä 10-17 vuoden iässä (keski-ikä 14,1 vuotta), joilla oli heterotsygoottinen familiaalinen hyperkolesterolemia (HeFH) tai vaikea hyperkolesterolemia. satunnaistettiin saamaan LIPITORia (n=140) tai lumelääkettä (n=47) 26 viikon ajan ja sitten kaikki saivat LIPITORia 40 mg 26 viikon ajan. Tutkimukseen osallistuminen edellytti 1) LDL-kolesterolin lähtötasoa ≥ 190 mg/dl tai 2) LDL-kolesterolin lähtötasoa ≥ 160 mg/dl ja positiivista suvussa esiintynyt FH tai dokumentoitu ennenaikainen sydän- ja verisuonisairaus ensimmäisen tai toisen asteen yhteydessä. suhteellinen. Keskimääräinen lähtötason LDL-kolesteroliarvo oli 218,6 mg/dl (vaihteluväli: 138,5–385,0 mg/dl) LIPITOR-ryhmässä verrattuna 230,0 mg/dl (vaihteluväli: 160,0–324,5 mg/dl) lumeryhmässä. . LIPITOR-annos (kerran vuorokaudessa) oli 10 mg ensimmäisten 4 viikon ajan ja titrattiin 20 mg:aan, jos LDL-kolesterolitaso oli > 130 mg/dl. LIPITOR-hoitoa saaneiden potilaiden määrä, jotka tarvitsivat nostamista 20 mg:aan viikon 4 jälkeen kaksoissokkoutetussa vaiheessa, oli 78 (55,7 %).
LIPITOR 10 mg alensi merkittävästi plasman kokonaiskolesterolin, LDL-kolesterolin, triglyseridien ja apolipoproteiini B:n tasoja 26 viikon kaksoissokkovaiheen aikana (katso taulukko 13).
TAULUKKO 13: LIPITORin lipidejä muuttavat vaikutukset nuorilla pojilla ja tytöillä, joilla on heterotsygoottinen familiaalinen hyperkolesterolemia tai vaikea hyperkolesterolemia (keskimääräinen prosenttimuutos lähtötilanteesta hoitoaikeiden mukaisessa päätepisteessä)
Keskimääräinen saavutettu LDL-kolesteroliarvo oli 130,7 mg/dl (vaihteluväli: 70,0–242,0 mg/dl) LIPITOR 10 mg:n ryhmässä verrattuna 228,5 mg/dl (vaihteluväli: 152,0–385,0 mg/dl) lumelääkkeeseen. ryhmässä 26 viikon kaksoissokkojakson aikana.
Atorvastatiinia tutkittiin myös kolmivuotisessa avoimessa, kontrolloimattomassa tutkimuksessa, johon osallistui 163 potilasta, joilla oli HeFH ja jotka olivat 10–15-vuotiaita (82 poikaa ja 81 tyttöä). Kaikilla potilailla oli kliininen HeFH-diagnoosi, joka vahvistettiin geneettisellä analyysillä (ellei sitä ole jo vahvistanut sukuhistoria). Noin 98 % oli valkoihoisia ja alle 1 % mustia tai aasialaisia. Keskimääräinen LDL-kolesteroli oli lähtötilanteessa 232 mg/dl. Atorvastatiinin aloitusannos oli 10 mg kerran vuorokaudessa ja annokset säädettiin saavuttamaan
Lapsuuden LIPITOR 20 mg -hoidon pitkäaikaista tehoa aikuisiän sairastuvuuden ja kuolleisuuden vähentämiseen ei ole osoitettu.
POTILASTIEDOT
LIPITOR® atorvastatiinikalsiumtabletit (LIP-ih-tore))
Lue LIPITOR 20 mg:n mukana tulevat potilastiedot ennen kuin aloitat sen käytön ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Tämä pakkausseloste ei korvaa sitä, että keskustelet lääkärisi kanssa tilastasi tai hoidostasi.
Jos sinulla on kysyttävää LIPITOR-valmisteesta, käänny lääkärin tai apteekkihenkilökunnan puoleen.
Mikä on LIPITOR?
LIPITOR on reseptilääke, joka alentaa veren kolesterolia. Se alentaa veresi LDL-kolesterolia ("huono" kolesteroli) ja triglyseridejä. Se voi myös nostaa HDL-kolesterolia ("hyvä" kolesteroli). LIPITOR on tarkoitettu aikuisille ja yli 10-vuotiaille lapsille, joiden kolesteroli ei laske riittävästi pelkällä liikunnalla ja vähärasvaisella ruokavaliolla.
LIPITOR voi vähentää sydänkohtauksen, aivohalvauksen, tietyntyyppisten sydänleikkausten ja rintakipujen riskiä potilailla, joilla on sydänsairaus tai sydänsairauksien riskitekijöitä, kuten:
- ikä, tupakointi, korkea verenpaine, alhainen HDL-kolesteroli, sydänsairaus perheessä.
LIPITOR 20mg voi vähentää sydänkohtauksen tai aivohalvauksen riskiä potilailla, joilla on diabetes ja riskitekijöitä, kuten:
- silmäongelmat, munuaisongelmat, tupakointi tai korkea verenpaine.
LIPITOR 40mg alkaa vaikuttaa noin 2 viikon kuluttua.
Mikä on kolesteroli?
Kolesteroli ja triglyseridit ovat rasvoja, joita kehosi tuottaa. Niitä löytyy myös elintarvikkeista. Tarvitset jonkin verran kolesterolia hyvään terveyteen, mutta liian paljon ei ole hyväksi sinulle. Kolesteroli ja triglyseridit voivat tukkia verisuonia. Kolesterolin alentaminen on erityisen tärkeää, jos sinulla on sydänsairaus, tupakoit, sinulla on diabetes tai korkea verenpaine, olet vanhempi tai jos sydänsairaus alkaa varhain perheessäsi.
Kuka ei saa ottaa LIPITOR 40 mg -valmistetta?
Älä ota LIPITOR 10 mg:aa, jos:
- olet raskaana tai epäilet olevasi raskaana tai suunnittelet raskautta. LIPITOR voi vahingoittaa sikiötäsi. Jos tulet raskaaksi, lopeta LIPITOR 40 mg:n käyttö ja ota heti yhteys lääkäriin.
- imettävät. LIPITOR 20 mg voi erittyä äidinmaitoon ja vahingoittaa vauvaasi.
- sinulla on maksaongelmia.
- olet allerginen LIPITORille tai jollekin sen ainesosalle. Vaikuttava aine on atorvastatiini. Katso tämän pakkausselosteen lopusta täydellinen luettelo LIPITORin ainesosista.
LIPITOR 20 mg:n annosta ei ole vahvistettu alle 10-vuotiaille lapsille.
Ennen kuin aloitat LIPITORin
Kerro lääkärillesi, jos:
- sinulla on lihassärkyä tai heikkoutta
- juo yli 2 lasillista alkoholia päivässä
- on diabetes
- sinulla on kilpirauhasen ongelma
- on munuaisongelmia
Joitakin lääkkeitä ei tule ottaa LIPITORin kanssa. Kerro lääkärillesi kaikista käyttämistäsi lääkkeistä, mukaan lukien reseptilääkkeet ja ilman reseptiä saatavat lääkkeet, vitamiinit ja yrttilisät. LIPITOR ja tietyt muut lääkkeet voivat vuorovaikutuksessa aiheuttaa vakavia sivuvaikutuksia. Kerro lääkärillesi erityisesti, jos käytät lääkkeitä:
- immuunijärjestelmääsi
- kolesteroli
- infektiot
- ehkäisy
- sydämen vajaatoiminta
- HIV tai AIDS
- hepatiitti C -virus
- viruslääkkeitä
Tiedä kaikki käyttämäsi lääkkeet. Pidä niistä luettelo mukanasi näytettäväksi lääkärillesi ja apteekkiin.
Miten minun pitäisi ottaa LIPITOR 40 mg?
- Ota LIPITOR 20 mg juuri sen verran kuin lääkärisi on määrännyt. Älä muuta annostasi tai lopeta LIPITOR-hoitoa keskustelematta lääkärisi kanssa. Lääkärisi voi tehdä verikokeita kolesterolitasosi tarkistamiseksi LIPITOR-hoidon aikana. LIPITOR-annostasi voidaan muuttaa näiden verikoetulosten perusteella.
- Ota LIPITOR joka päivä mihin aikaan päivästä tahansa, joka päivä suunnilleen samaan aikaan. LIPITOR 10 mg voidaan ottaa ruoan kanssa tai ilman. Älä murskaa LIPITOR-tabletteja ennen ottamista.
- Lääkärisi tulee aloittaa vähärasvainen ruokavalio ennen LIPITOR-valmisteen antamista. Pysy tällä vähärasvaisella ruokavaliolla, kun otat LIPITORia.
- Jos unohdat ottaa LIPITOR-annoksen, ota se heti kun muistat. Älä ota LIPITOR 10 mg -valmistetta, jos edellisestä annoksesta on kulunut yli 12 tuntia. Odota ja ota seuraava annos normaaliin aikaan. Älä ota kahta annosta LIPITOR 10 mg samanaikaisesti.
- Jos otat liikaa LIPITORia tai yliannostuksen, ota välittömästi yhteys lääkäriisi tai Myrkytystietokeskukseen. Tai mene lähimpään ensiapuun.
Mitä minun tulisi välttää otetessasi LIPITOR 10 mg -valmistetta?
- Keskustele lääkärisi kanssa ennen kuin aloitat uusien lääkkeiden käytön. Tämä sisältää reseptilääkkeet ja ilman reseptiä saatavat lääkkeet, vitamiinit ja yrttilisät. LIPITOR ja tietyt muut lääkkeet voivat vuorovaikutuksessa aiheuttaa vakavia sivuvaikutuksia.
- Älä tule raskaaksi. Jos tulet raskaaksi, lopeta LIPITORin käyttö heti ja ota yhteys lääkäriin.
Mitkä ovat LIPITOR 10mg:n mahdolliset sivuvaikutukset?
LIPITOR voi aiheuttaa vakavia sivuvaikutuksia. Näitä sivuvaikutuksia on esiintynyt vain pienelle määrälle ihmisiä. Lääkärisi voi seurata sinua niiden varalta. Nämä sivuvaikutukset yleensä häviävät, jos annostasi pienennetään tai LIPITOR-hoito lopetetaan. Näitä vakavia sivuvaikutuksia ovat:
- Lihasongelmat. LIPITOR 40 mg voi aiheuttaa vakavia lihasongelmia, jotka voivat johtaa munuaisongelmiin, mukaan lukien munuaisten vajaatoiminta. Sinulla on suurempi mahdollisuus saada lihasongelmia, jos käytät tiettyjä muita lääkkeitä LIPITORin kanssa.
- Maksaongelmat. Lääkärisi tulee ottaa verikokeita maksan tarkistamiseksi ennen kuin aloitat LIPITOR 20 mg -hoidon ja jos sinulla on maksaongelmia koskevia oireita LIPITOR-hoidon aikana. Soita lääkärillesi välittömästi, jos sinulla on seuraavat maksaongelmien oireet:
- tuntuu väsyneeltä tai heikolta
- ruokahalun menetys
- ylävatsan kipu
- tumma meripihkan värinen virtsa
- ihosi tai silmänvalkuaisten keltaisuus
Soita lääkärillesi heti, jos sinulla on:
- lihasongelmat, kuten heikkous, arkuus tai kipu, jotka ilmenevät ilman hyvää syytä, varsinkin jos sinulla on myös kuumetta tai tunnet itsesi tavallista väsyneemmäksi. Tämä voi olla varhainen merkki harvinaisesta lihasongelmasta.
- lihasongelmat, jotka eivät häviä senkään jälkeen, kun lääkäri on neuvonut sinua lopettamaan LIPITORin käytön. Lääkärisi voi tehdä lisätutkimuksia lihasongelmien syyn diagnosoimiseksi.
- allergiset reaktiot, mukaan lukien kasvojen, huulten, kielen ja/tai kurkun turvotus, jotka voivat aiheuttaa hengitys- tai nielemisvaikeuksia, jotka saattavat vaatia välitöntä hoitoa.
- pahoinvointia ja oksentelua.
- ruskea tai tumma virtsa.
- tunnet itsesi tavallista väsyneemmäksi
- ihosi ja silmänvalkuaiset muuttuvat keltaisiksi.
- vatsakipu.
- allergiset ihoreaktiot.
Kliinisissä tutkimuksissa potilaat ilmoittivat seuraavista yleisistä sivuvaikutuksista LIPITOR-hoidon aikana: ripuli, vatsavaivoja, lihas- ja nivelkipuja ja muutoksia joissakin laboratorioverikokeissa.
Seuraavia muita sivuvaikutuksia on raportoitu LIPITORin käytön yhteydessä:
väsymys, jänneongelmat, muistin menetys ja sekavuus.
Keskustele lääkärin tai apteekkihenkilökunnan kanssa, jos sinulla on haittavaikutuksia, jotka vaivaavat sinua tai jotka eivät häviä.
Nämä eivät ole kaikki LIPITORin sivuvaikutuksia. Pyydä täydellinen luettelo lääkäriltäsi tai apteekista.
Kuinka säilytän LIPITORia
- Säilytä LIPITOR huoneenlämmössä, 20 - 25 °C (68–77 °F).
- Älä säilytä lääkkeitä, jotka ovat vanhentuneita tai joita et enää tarvitse.
- Pidä LIPITOR ja kaikki lääkkeet poissa lasten ulottuvilta. Varmista, että jos heität lääkkeen pois, se on lasten ulottumattomissa.
Yleistä tietoa LIPITORista
Lääkkeitä määrätään joskus sairauksiin, joita ei ole mainittu potilasohjeissa. Älä käytä LIPITOR 10 mg:aa sairauteen, johon sitä ei ole määrätty. Älä anna LIPITORia muille ihmisille, vaikka heillä olisi sama ongelma kuin sinulla. Se voi vahingoittaa heitä.
Tämä pakkausseloste sisältää yhteenvedon tärkeimmistä LIPITOR-tiedoista. Jos haluat lisätietoja, keskustele lääkärisi kanssa. Voit kysyä lääkäriltäsi tai apteekista terveydenhuollon ammattilaisille tarkoitettua LIPITOR-tietoa. Tai voit siirtyä LIPITOR-verkkosivustolle osoitteessa www.lipitor.com.
Mitkä ovat LIPITORin ainesosat?
Aktiivinen ainesosa: atorvastatiinikalsiumia
Ei-aktiiviset ainesosat: kalsiumkarbonaatti, USP; candelilla vaha, FCC; kroskarmelloosinatrium, NF; hydroksipropyyliselluloosa, NF; laktoosimonohydraatti, NF; magnesiumstearaatti, NF; mikrokiteinen selluloosa, NF; Opadry White YS-1-7040 (hypromelloosi, polyetyleeniglykoli, talkki, titaanidioksidi); polysorbaatti 80, NF; simetikoni emulsio.
