Zanaflex 2mg, 4mg Tizanidine Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Zanaflex 2mg on ja miten sitä käytetään?
Zanaflex 2mg on reseptilääke, jota käytetään lihasjäykkyyden (spastisuuden) oireiden hoitoon, jotka liittyvät sairauksiin, kuten aivovammaan tai muihin neurologisiin sairauksiin. Zanaflex 2mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Zanaflex 2mg kuuluu lääkeryhmään nimeltä Central Alpha-2-Adrenerg agonist.
Ei tiedetä, onko Zanaflex turvallinen ja tehokas lapsille.
Mitkä ovat Zanaflexin mahdolliset sivuvaikutukset?
Zanaflex 2mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- alhainen verenpaine,
- epänormaalit maksan toimintakokeet,
- uneliaisuus,
- hallusinaatiot,
- liiallinen uneliaisuus,
- hidas syke,
- kuiva suu,
- väsymys ja
- heikkous
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Zanaflexin yleisimpiä sivuvaikutuksia ovat:
- kuiva suu,
- väsymys,
- heikkous,
- väsymys,
- väsymys,
- huimaus,
- virtsatieinfektio,
- ummetus,
- epänormaalit maksan toimintakokeet,
- oksentelua,
- puhehäiriö,
- laiska silmä (amblyopia),
- virtsaamistiheys,
- flunssan oireet,
- hallitsemattomat lihasliikkeet,
- hermostuneisuus,
- kurkkukipu ja
- vuotava nenä
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Zanaflexin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
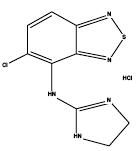
Zanaflex® (tizanidiinihydrokloridi) on keskeinen alfa2-adrenerginen agonisti. Tizanidiini HCl on valkoinen tai luonnonvalkoinen, hienojakoinen kiteinen jauhe, joka on hajuton tai jolla on heikko ominainen haju. Titsanidiini liukenee heikosti veteen ja metanoliin; Liukoisuus veteen heikkenee pH:n noustessa. Sen kemiallinen nimi on 5-kloori-4-(2-imidatsolin-2-yyliamino)-2,1,3-bentsotiadiatsolimonohydrokloridi. Titsanidiinin molekyylikaava on C9H8ClN5S-HCl, sen molekyylipaino on 290,2 ja sen rakennekaava on:
Zanaflex 4mg Capsules® toimitetaan 2, 4 ja 6 mg:n kapseleina oraaliseen käyttöön. Zanaflex Capsules® sisältää vaikuttavana aineena titsanidiinihydrokloridia (2,29 mg vastaa 2 mg titsanidiiniemästä, 4,58 mg vastaa 4 mg titsanidiiniemästä ja 6,87 mg vastaa 6 mg titsanidiiniemästä) ja inaktiivisia aineita, hypromelloosia, piidioksidia, sokeripalloja, titaanidioksidia, gelatiinia ja väriaineita.
Zanaflex®-tabletit toimitetaan 4 mg:n tabletteina suun kautta. Zanaflex®-tabletit sisältävät vaikuttavana aineena titsanidiinihydrokloridia (4,58 mg, mikä vastaa 4 mg titsanidiiniemästä) ja inaktiivisia aineosia, kolloidista piidioksidia, steariinihappoa, mikrokiteistä selluloosaa ja vedetöntä laktoosia.
INDIKAATIOT
Zanaflex on tarkoitettu spastisuuden hoitoon. Terapeuttisen vaikutuksen lyhyen keston vuoksi Zanaflex-hoito tulee varata niihin päivittäisiin toimintoihin ja aikoihin, jolloin spastisuuden lievitys on tärkeintä [ks. ANNOSTELU JA HALLINNOINTI ].
ANNOSTELU JA HALLINNOINTI
Annostelutiedot
Zanaflex 2mg Capsules® tai Zanaflex® tabletit voidaan määrätä ruoan kanssa tai ilman. Kun koostumus on valittu ja päätös ruoan kanssa tai ilman sitä on tehty, tätä hoito-ohjelmaa ei pidä muuttaa.
Ruoalla on monimutkaisia vaikutuksia titsanidiinin farmakokinetiikkaan, jotka vaihtelevat eri formulaatioiden mukaan. Zanaflex-kapselit ja Zanaflex-tabletit ovat biologisesti samanarvoisia toistensa kanssa paasto-olosuhteissa (yli 3 tuntia aterian jälkeen), mutta eivät ruokailutilassa (30 minuutin sisällä aterian jälkeen). Nämä farmakokineettiset erot voivat aiheuttaa kliinisesti merkittäviä eroja vaihdettaessa tabletin ja kapseleiden antoa ja vaihdettaessa antoa ruokailun tai paaston välillä. Nämä muutokset voivat johtaa lisääntyneisiin haittatapahtumiin tai viivästyneeseen tai nopeampaan toiminnan alkamiseen vaihdon luonteesta riippuen. Tästä syystä lääkettä määräävän lääkärin tulee olla perinpohjaisesti perehtynyt näihin erilaisiin tiloihin liittyviin kinetiikan muutoksiin [ks. KLIININEN FARMAKOLOGIA ].
Suositeltu aloitusannos on 2 mg. Koska Zanaflexin vaikutus saavuttaa huippunsa noin 1–2 tunnin kuluttua annoksesta ja häviää 3–6 tunnin kuluttua annoksesta, hoito voidaan toistaa 6–8 tunnin välein tarpeen mukaan enintään kolmeen annokseen 24 tunnin aikana.
Annosta voidaan nostaa asteittain 2–4 mg:lla jokaisella annoksella 1–4 vuorokauden välein annosten lisäysten välillä, kunnes saavutetaan tyydyttävä lihasjännityksen lasku. Päivittäinen kokonaisannos ei saa ylittää 36 mg. Yli 16 mg:n kerta-annoksia ei ole tutkittu.
Annostelu potilaille, joilla on munuaisten vajaatoiminta
Zanaflexia tulee käyttää varoen potilailla, joilla on munuaisten vajaatoiminta (kreatiniinipuhdistuma VAROITUKSET JA VAROTOIMET ].
Annostus potilaille, joilla on maksan vajaatoiminta
Zanaflex 4 mg:aa tulee käyttää varoen potilailla, joilla on maksan vajaatoiminta. Näillä potilailla yksittäisiä annoksia tulee pienentää titrauksen aikana. Jos tarvitaan suurempia annoksia, yksittäisiä annoksia tulee suurentaa annostiheyden sijaan. Aminotransferaasitasojen seurantaa suositellaan lähtötilanteessa ja 1 kuukauden kuluttua enimmäisannoksen saavuttamisesta tai jos epäillään maksavauriota [ks. Käyttö tietyissä populaatioissa ].
Lääkkeiden lopettaminen
Jos hoito on lopetettava, erityisesti potilailla, jotka ovat saaneet suuria annoksia (20 mg - 36 mg päivässä) pitkiä aikoja (vähintään 9 viikkoa) tai jotka saattavat saada samanaikaisesti huumehoitoa, annosta tulee pienentää hitaasti. 2 mg - 4 mg päivässä) minimoimaan vieroitus- ja rebound-hypertension, takykardian ja hypertoniariskin [ks. Huumeiden väärinkäyttö ja riippuvuus ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
Kapselit
mg: Vaaleansininen läpinäkymätön runko-osa, jossa vaaleansininen läpinäkymätön kansi, jossa on painettu ”2 MG” 4 mg: Valkoinen läpinäkymätön runko-osa, jossa on sininen läpinäkymätön kansi, jossa on painettu ”4 MG” 6 mg: Sininen läpinäkymätön runko-osa, jossa on valkoinen raita ja sininen läpinäkymätön kansi, jossa on painettu "6 MG".
Tabletit
4 mg:n valkoiset, päällystämättömät tabletit, joiden toisella puolella on nelikulmainen jakouurre ja toisella puolella merkintä ”A594”
Varastointi ja käsittely
Zanaflex kapselit®
Zanaflex Capsules® (tizanidiinihydrokloridi) kapselit on saatavilla kolmessa eri vahvuudessa kaksiosaisina kovina gelatiinikapseleina, jotka sisältävät 2,29 mg, 4,58 mg ja 6,87 mg titsanidiinihydrokloridia, mikä vastaa 2 mg, 4 mg ja 6 mg titsanidiiniemästä.
2 mg:n kapseleissa on vaaleansininen läpinäkymätön runko-osa ja vaaleansininen läpinäkymätön kansi, jonka kanteen on painettu ”2 MG”: 150 kapselin pullot ( NDC 70515-602-15)
4 mg:n kapseleissa on valkoinen läpinäkymätön runko-osa ja sininen läpinäkymätön kansi, jonka kanteen on painettu ”4 MG”: 150 kapselin pullot ( NDC 70515-604-15)
mg:n kapseleissa on sininen läpinäkymätön runko-osa, jossa on valkoinen raita ja sininen läpinäkymätön kansi, johon on painettu ”6 MG”: 150 kapselin pullot ( NDC 70515-606-15)
Säilytä 25°C (77°F); retket sallitaan 15°C - 30°C (59°F - 86°F) [katso USP-ohjattu huonelämpötila ]. Annostele säiliöihin, joissa on lapsiturvallinen suljin.
Zanaflex®-tabletit
Zanaflex® (titsanidiinihydrokloridi) -tabletit ovat saatavilla 4 mg:n valkoisina, päällystämättöminä tabletteina, jotka sisältävät 4,58 mg titsanidiinihydrokloridia, mikä vastaa 4 mg tisanidiiniemästä. Tablettien toisella puolella on nelikulmainen jakouurre ja toisella puolella on kaiverrus ”A594”. Tabletit toimitetaan seuraavasti: 150 tabletin pullot (NDC 70515-594-15).
Säilytä 25°C (77°F); retket sallitaan 15°C - 30°C (59°F - 86°F) [katso USP-ohjattu huonelämpötila ].
Annostele säiliöihin, joissa on lapsiturvallinen suljin.
Valmistettu: Covis Pharma Zug, 6300 Switzerland. Tarkistettu: joulukuuta 2020
SIVUVAIKUTUKSET
Seuraavat haittavaikutukset on kuvattu muualla lääkemääräystietojen muissa osissa:
- Hypotensio [katso VAROITUKSET JA VAROTOIMET ]
- Maksavaurio [katso VAROITUKSET JA VAROTOIMET ]
- Sedaatio [katso VAROITUKSET JA VAROTOIMET ]
- Hallusinoosi / psykoottiset oireet [katso VAROITUKSET JA VAROTOIMET ]
- Yliherkkyysreaktiot [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida verrata suoraan toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta kliinisessä käytännössä havaittuja nopeuksia.
Kolme kaksoissokkoutettua, satunnaistettua, lumekontrolloitua kliinistä tutkimusta suoritettiin arvioimaan titsanidiinin vaikutusta spastisuuskontrolliin. Kaksi tutkimusta tehtiin potilailla, joilla oli multippeliskleroosi, ja yksi potilailla, joilla oli selkäydinvamma. Kussakin tutkimuksessa oli 13 viikon aktiivinen hoitojakso, joka sisälsi 3 viikon titrausvaiheen suurimman siedetyn annoksen saavuttamiseksi 36 mg:aan/vrk kolmeen annokseen jaettuna, 9 viikon tasannevaihe, jossa titsanidiiniannos pidettiin vakiona ja 1 viikon annoksen pienentäminen. Kaikkiaan 264 potilasta sai titsanidiinia ja 261 potilasta lumelääkettä. Kolmessa tutkimuksessa potilaiden iät vaihtelivat välillä 15-69 vuotta ja 51,4 prosenttia oli naisia. Mediaaniannos tasannevaiheen aikana oli 20-28 mg/vrk.
Yleisimmät toistuvan annoksen lumekontrolloiduissa kliinisissä tutkimuksissa, joihin osallistui 264 spastisuutta sairastavaa potilasta, raportoidut haittavaikutukset olivat suun kuivuminen, uneliaisuus/sedaatio, voimattomuus (heikkous, väsymys ja/tai väsymys) ja huimaus. Kolme neljäsosaa potilaista arvioi tapahtumat lieviksi tai kohtalaisiksi ja neljäsosa potilaista arvioi tapahtumat vakaviksi. Nämä tapahtumat näyttivät olevan annosriippuvaisia.
Taulukossa 1 on lueteltu merkit ja oireet, joita raportoitiin yli 2 %:lla potilaista kolmessa toistuvan annoksen plasebokontrolloidussa tutkimuksessa, jotka saivat Zanaflexia ja joissa esiintymistiheys Zanaflex-ryhmässä oli suurempi kuin lumeryhmässä. Vertailua varten annetaan myös vastaava tapahtumatiheys (100 potilasta kohti) lumelääkettä saaneiden potilaiden keskuudessa.
Yhden annoksen lumekontrolloidussa tutkimuksessa, johon osallistui 142 potilasta, joilla oli multippeliskleroosista johtuva spastisuus (tutkimus 1) [ks. Kliiniset tutkimukset ], potilailta kysyttiin erityisesti, olivatko he kokeneet jotakin neljästä yleisimmästä haittavaikutuksesta: suun kuivuminen, uneliaisuus, voimattomuus (heikkous, väsymys ja/tai väsymys) ja huimaus. Lisäksi havaittiin hypotensiota ja bradykardiaa. Näiden reaktioiden esiintymisestä on yhteenveto taulukossa 2. Muita tapahtumia raportoitiin yleensä 2 % tai vähemmän.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu Zanaflexin hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Tiettyjä tapahtumia, kuten uneliaisuutta, suun kuivumista, hypotensiota, verenpaineen laskua, bradykardiaa, huimausta, heikkoutta tai voimattomuutta, lihaskouristuksia, hallusinaatioita, väsymystä, maksan toimintakokeiden poikkeavuuksia ja maksatoksisuutta, on havaittu markkinoille saattamisen jälkeisissä ja kliinisissä tutkimuksissa, ja niistä keskustellaan tämän asiakirjan aiemmissa osissa.
Seuraavien haittavaikutusten on havaittu esiintyvän Zanaflexin markkinoille saattamisen jälkeen. Näistä reaktioista annettujen tietojen perusteella syy-yhteyttä Zanaflexin kanssa ei voida täysin sulkea pois. Tapahtumat on lueteltu kliinisen merkityksen vähenevän järjestyksessä; vakavuutta markkinoille saattamisen jälkeen ei raportoida.
- Stevens Johnsonin syndrooma
- Anafylaktinen reaktio
- Eksfoliatiivinen dermatiitti
- Ventrikulaarinen takykardia
- Hepatiitti
- Kouristukset
- Masennus
- Nivelkipu
- Parestesia
- Ihottuma
- Vapina
HUUMEIDEN VUOROVAIKUTUKSET
Fluvoksamiini
Fluvoksamiinin ja Zanaflex 4 mg:n samanaikainen käyttö on vasta-aiheista. Muutokset titsanidiinin farmakokinetiikassa, kun sitä annettiin fluvoksamiinin kanssa, johtivat merkittävästi alentuneeseen verenpaineeseen, lisääntyneeseen uneliaisuuteen ja lisääntyneeseen psykomotoriseen vajaatoimintaan [ks. VASTA-AIHEET ja KLIININEN FARMAKOLOGIA ].
Siprofloksasiini
Siprofloksasiinin ja Zanaflexin samanaikainen käyttö on vasta-aiheista. Muutokset titsanidiinin farmakokinetiikassa, kun sitä annettiin siprofloksasiinin kanssa, johtivat merkittävästi alentuneeseen verenpaineeseen, lisääntyneeseen uneliaisuuteen ja lisääntyneeseen psykomotoriseen vajaatoimintaan [ks. VASTA-AIHEET ja KLIININEN FARMAKOLOGIA ].
CYP1A2:n estäjät, muut kuin fluvoksamiini ja siprofloksasiini
Mahdollisten lääkkeiden yhteisvaikutusten vuoksi Zanaflexin samanaikainen käyttö muiden CYP1A2-estäjien, kuten zileutonin, fluorokinolonien, muiden kuin vahvojen CYP1A2-estäjien (jotka ovat vasta-aiheisia), rytmihäiriölääkkeiden (amiodaroni, meksiletiini, propafenoni ja verapamiili), simetidiinin, tai famotraceptiivin kanssa. asykloviiria ja tiklopidiinia) tulee välttää. Jos niiden käyttö on kliinisesti välttämätöntä, hoito tulee aloittaa 2 mg:n annoksella ja sitä nostetaan 2–4 mg:n välein vuorokaudessa potilaan hoitovasteen perusteella. Jos haittavaikutuksia, kuten hypotensiota, bradykardiaa tai liiallista uneliaisuutta ilmenee, vähennä Zanaflex-hoitoa tai lopeta sen käyttö [ks. VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ].
Ehkäisypillerit
Zanaflex 2 mg:n samanaikaista käyttöä suun kautta otettavien ehkäisyvalmisteiden kanssa ei suositella. Jos samanaikainen käyttö on kuitenkin kliinisesti välttämätöntä, aloita Zanaflex 4 mg kerta-annoksella 2 mg ja lisää 2–4 mg:n vuorokaudessa potilaan hoitovasteen perusteella. Jos haittavaikutuksia, kuten hypotensiota, bradykardiaa tai liiallista uneliaisuutta ilmenee, vähennä Zanaflex-hoitoa tai lopeta sen käyttö [ks. KLIININEN FARMAKOLOGIA ].
Alkoholi
Alkoholi lisää lääkkeen kokonaismäärää verenkierrossa Zanaflex-annoksen jälkeen. Tämä liittyi Zanaflexin haittavaikutusten lisääntymiseen. Zanaflexin ja alkoholin keskushermostoa lamaavat vaikutukset ovat additiivisia [katso KLIININEN FARMAKOLOGIA ].
Muut keskushermostoa lamaavat aineet
Zanaflexin sedatiiviset vaikutukset keskushermostoa lamaavien aineiden (esim. bentsodiatsepiinit, opioidit, trisykliset masennuslääkkeet) kanssa voivat olla additiivisia. Tarkkaile potilaita, jotka ottavat Zanaflex 2 mg toisen keskushermostoa lamaavan aineen kanssa liiallisen sedaation oireiden varalta [katso KLIININEN FARMAKOLOGIA ].
α2-adrenergiset agonistit
Koska hypotensiiviset vaikutukset voivat olla kumulatiivisia, Zanaflex 4mg:n käyttöä muiden α2-adrenergisten agonistien kanssa ei suositella [ks. VAROITUKSET JA VAROTOIMET ].
Huumeiden väärinkäyttö ja riippuvuus
Väärinkäyttö
Väärinkäyttöpotentiaalia ei arvioitu ihmistutkimuksissa. Rotat pystyivät erottamaan titsanidiinin suolaliuoksesta tavanomaisessa erotteluparadigmassa harjoituksen jälkeen, mutta he eivät yleistäneet morfiinin, kokaiinin, diatsepaamin tai fenobarbitaalin vaikutuksia titsanidiiniksi.
Riippuvuus
Titsanidiini on läheistä sukua klonidiinille, jota käytetään usein väärin yhdessä huumeiden kanssa ja jonka tiedetään aiheuttavan rebound-oireita äkillisen vetäytymisen yhteydessä. Kolme titsanidiinin äkillisen lopettamisen aiheuttamaa rebound-oiretta on raportoitu. Tapausraportit viittaavat siihen, että nämä potilaat käyttivät myös huumeita väärin. Vieroitusoireita olivat verenpainetauti, takykardia, hypertonia, vapina ja ahdistuneisuus. Vieroitusoireita esiintyy todennäköisemmin tapauksissa, joissa käytetään suuria annoksia, erityisesti pitkiä aikoja, tai jos samanaikaisesti käytetään huumeita. Jos hoito on keskeytettävä, annosta tulee pienentää hitaasti vieroitusoireiden riskin minimoimiseksi [ks. ANNOSTELU JA HALLINNOINTI ].
Apinoiden osoitettiin antavan titsanidiinia itse annoksesta riippuvaisella tavalla, ja titsanidiinin äkillinen lopettaminen aiheutti ohimeneviä vieroitusoireita annoksilla, jotka ylittivät 35 kertaa ihmisille suositellun enimmäisannoksen mg/m²:n perusteella. Nämä ohimenevät vieroitusoireet (lisääntynyt liikkuvuus, kehon nykiminen ja vastenmielinen käyttäytyminen tarkkailijaa kohtaan) eivät kumotuneet naloksonin annolla.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Hypotensio
Titsanidiini on α2-adrenerginen agonisti, joka voi aiheuttaa hypotensiota. Pyörtyminen on raportoitu markkinoinnin jälkeisessä asetuksessa. Merkittävän hypotension mahdollisuus voidaan mahdollisesti minimoida titraamalla annosta ja kiinnittämällä huomio hypotension merkkeihin ja oireisiin ennen annoksen siirtämistä. Lisäksi potilailla, jotka siirtyvät makuuasennosta kiinteään pystyasentoon, saattaa olla lisääntynyt hypotension ja ortostaattisten vaikutusten riski.
Seuraa hypotensiota, kun Zanaflexia käytetään potilailla, jotka saavat samanaikaisesti verenpainetta alentavaa hoitoa. Zanaflex 2mg:n käyttöä muiden α2-adrenergisten agonistien kanssa ei suositella. Kliinisesti merkitsevää hypotensiota (sekä systolisen että diastolisen paineen laskua) on raportoitu annettaessa samanaikaisesti joko fluvoksamiinia tai siprofloksasiinia ja kerta-annoksia 4 mg Zanaflexia. Siksi Zanaflexin samanaikainen käyttö fluvoksamiinin tai siprofloksasiinin kanssa, jotka ovat voimakkaita CYP1A2:n estäjiä, on vasta-aiheista (ks. VASTA-AIHEET ja HUUMEIDEN VUOROVAIKUTUKSET ].
Maksavaurion riski
Zanaflex voi aiheuttaa hepatosellulaarisen maksavaurion. Zanaflex 4 mg:aa tulee käyttää varoen potilailla, joilla on maksan vajaatoiminta. Aminotransferaasitasojen seurantaa suositellaan lähtötilanteessa ja 1 kuukauden kuluttua enimmäisannoksen saavuttamisesta tai jos epäillään maksavauriota [ks. ANNOSTELU JA HALLINNOINTI ja Käyttö tietyissä populaatioissa ].
Sedatio
Zanaflex voi aiheuttaa sedaatiota, joka voi häiritä jokapäiväistä toimintaa. Useita annoksia koskevissa tutkimuksissa sedaatiota saaneiden potilaiden esiintyvyys oli huipussaan ensimmäisen titrausviikon jälkeen ja pysyi sitten vakaana tutkimuksen ylläpitovaiheen ajan. Zanaflexin keskushermostoa lamaavat vaikutukset alkoholin ja muiden keskushermostoa lamaavien aineiden (esim. bentsodiatsepiinit, opioidit, trisykliset masennuslääkkeet) kanssa voivat olla additiivisia. Tarkkaile potilaita, jotka ottavat Zanaflex 4 mg toisen keskushermostoa lamaavan aineen kanssa liiallisen sedaation oireiden varalta [katso HUUMEIDEN VUOROVAIKUTUKSET ].

Hallusinoosi/psykoottisen kaltaiset oireet
Zanaflex 4 mg:n käyttöön on yhdistetty hallusinaatioita. Muodostuneita visuaalisia hallusinaatioita tai harhaluuloja on raportoitu viidellä 170 potilaasta (3 %) kahdessa pohjoisamerikkalaisessa kontrolloidussa kliinisessä tutkimuksessa. Suurin osa potilaista tiesi, että tapahtumat olivat epätodellisia. Yksi potilas sai psykoosin hallusinaatioiden yhteydessä. Yhdellä näistä viidestä potilaasta jatkui ongelmia vähintään 2 viikkoa titsanidiinihoidon lopettamisen jälkeen. Harkitse Zanaflex-hoidon lopettamista potilailla, joille kehittyy hallusinaatioita.
Vuorovaikutus CYP1A2-estäjien kanssa
Mahdollisten lääkevuorovaikutusten vuoksi Zanaflex 4 mg on vasta-aiheinen potilaille, jotka käyttävät voimakkaita CYP1A2-estäjiä, kuten fluvoksamiinia tai siprofloksasiinia. Haittavaikutuksia, kuten hypotensiota, bradykardiaa tai liiallista uneliaisuutta, voi esiintyä, kun Zanaflexia käytetään muiden CYP1A2-estäjien, kuten zileutonin, muiden fluorokinolonien kuin siprofloksasiinin (joka on vasta-aiheinen), rytmihäiriölääkkeiden (amiodaroni, meksiletiini, propafeniini, famoalimetidiini tai cimoalimetidiini) kanssa. ehkäisyvalmisteet, asykloviiri ja tiklopidiini). Samanaikaista käyttöä tulee välttää, ellei Zanaflex 2 mg -hoidon tarve ole kliinisesti ilmeinen. Käytä siinä tapauksessa varoen [katso HUUMEIDEN VUOROVAIKUTUKSET ja KLIININEN FARMAKOLOGIA ].
Yliherkkyysreaktiot
Zanaflex voi aiheuttaa anafylaksiaa. Merkkejä ja oireita, mukaan lukien hengitysvajaus, nokkosihottuma sekä kurkun ja kielen angioedeema, on raportoitu. Potilaille tulee kertoa vakavien allergisten reaktioiden merkeistä ja oireista ja neuvoa lopettamaan Zanaflexin käyttö ja hakeutumaan välittömästi lääkärin hoitoon, jos näitä merkkejä ja oireita ilmenee [ks. VASTA-AIHEET ].
Lisääntynyt haittavaikutusten riski potilailla, joilla on munuaisten vajaatoiminta
Zanaflexia tulee käyttää varoen potilailla, joilla on munuaisten vajaatoiminta (kreatiniinipuhdistuma ANNOSTELU JA HALLINNOINTI ja Käyttö tietyissä populaatioissa ].
Peruuttamisen haittavaikutukset
Peruuttamisen haittavaikutuksia ovat rebound hypertensio, takykardia ja hypertonia. Näiden reaktioiden riskin minimoimiseksi, erityisesti potilailla, jotka ovat saaneet suuria annoksia (20-28 mg päivässä) pitkiä aikoja (vähintään 9 viikkoa) tai jotka saattavat saada samanaikaisesti huumehoitoa, annosta tulee pienentää. hitaasti (2-4 mg päivässä) [katso ANNOSTELU JA HALLINNOINTI ].
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeneesi
Titsanidiinia annettiin hiirille 78 viikon ajan oraalisilla annoksilla aina 16 mg/kg/vrk asti, mikä on 2 kertaa suurempi kuin ihmiselle suositeltu enimmäisannos (MRHD) 36 mg/vrk kehon pinta-alalla (mg/m²) laskettuna. Titsanidiinia annettiin rotille 104 viikon ajan oraalisilla annoksilla aina 9 mg/kg/vrk asti, mikä on 2,5 kertaa MRHD mg/m²:n perusteella. Kasvaimet eivät lisääntyneet kummassakaan lajissa.
Mutageneesi
Titsanidiini oli negatiivinen in vitro (bakteerin käänteismutaatio [Ames], nisäkkään geenimutaatio ja kromosomipoikkeavuustesti nisäkässoluissa) ja in vivo (luuytimen mikrotuma ja sytogenetiikka) kokeessa.
Hedelmällisyyden heikkeneminen
Titsanidiinin oraalinen antaminen rotille ennen parittelua ja sen aikana sekä jatkaminen raskauden alkuvaiheessa naaraille johti urosrottien ja naarasrottien hedelmällisyyden heikkenemiseen annoksilla 30 ja 10 mg/kg/vrk. Mitään vaikutusta hedelmällisyyteen ei havaittu annoksilla 10 (uros) ja 3 (naaras) mg/kg/vrk, jotka ovat noin 3 kertaa ja vastaavat MRHD:tä mg/m²:n perusteella.
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
Ei ole olemassa riittäviä tietoja Zanaflex 2 mg:n käyttöön liittyvistä kehitysriskeistä raskaana oleville naisille. Eläinkokeissa titsanidiinin antaminen raskauden aikana aiheutti kehitystoksisuutta (sikiön ja syntymän jälkeisten jälkeläisten kuolleisuus ja kasvuvaje) annoksilla, jotka olivat pienempiä kuin kliinisesti käytetyt annokset, joihin ei liittynyt emotoksisuutta (ks. Eläinten tiedot ).
Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2 % - 4 % ja 15 % - 20 %. Vakavien synnynnäisten epämuodostumien ja keskenmenon taustariskiä mainitulla väestöllä ei tunneta.
Data
Eläinten tiedot
Titsanidiinin (0,3-100 mg/kg/vrk) oraalinen antaminen tiineille rotille organogeneesin aikana johti sikiön ja sikiön jälkeiseen kuolleisuuteen ja ruumiinpainon laskuun annoksilla 30 mg/kg/vrk ja sitä suuremmilla annoksilla. Emokyrkyllisyys havaittiin suurimmalla testatulla annoksella. Alkion ja sikiön kehitystoksisuuteen vaikuttamaton annos (3 mg/kg/vrk) on samanlainen kuin suurin suositeltu ihmisannos (MRHD) 36 mg/vrk kehon pinta-alalla (mg/m²) laskettuna.
Titsanidiinin (1 - 100 mg/kg/vrk) oraalinen antaminen tiineille kaneille organogeneesin aikana johti alkiosikiön ja syntymän jälkeiseen jälkeläisten kuolleisuuteen kaikilla annoksilla. Emokyrkyllisyys havaittiin suurimmalla testatulla annoksella. Titsanidiinin (10 ja 30 mg/kg/vrk) oraalinen antaminen raskauden perinataalisen ajanjakson aikana (2-6 päivää ennen synnytystä) johti lisääntyneeseen syntymänjälkeiseen jälkeläisten kuolleisuuteen molemmilla annoksilla. Alkion ja sikiön kehitystoksisuuteen vaikuttamatonta annosta kaniinilla ei tunnistettu. Pienin testattu annos (1 mg/kg/vrk) on pienempi kuin MRHD mg/m²:n perusteella.
Rotilla tehdyssä pre- ja postnataalisessa kehitystutkimuksessa titsanidiinin (3-30 mg/kg/vrk) oraalinen anto johti lisääntyneeseen syntymänjälkeiseen jälkeläisten kuolleisuuteen. Vaikuttamatonta annosta pre- ja postnataaliseen kehitystoksisuuteen ei tunnistettu. Pienin testattu annos (3 mg/kg/vrk) on vastaavasti samanlainen kuin MRHD (mg/m²).
Imetys
Riskien yhteenveto
Ei ole tietoa titsanidiinin esiintymisestä äidinmaidossa, vaikutuksista imetettävään lapseen tai vaikutuksista äidinmaidon tuotantoon. Eläinkokeissa on raportoitu titsanidiinin esiintymisestä imettävien eläinten maidossa.
Imetyksen kehitys- ja terveyshyödyt tulee ottaa huomioon sekä äidin kliininen Zanaflex 4mg:n tarve ja Zanaflexin tai äidin taustalla olevista mahdollisista haitallisista vaikutuksista imetettävään lapseen.
Naaraat ja urokset, joilla on lisääntymispotentiaali
Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia ihmisillä Zanaflex 4 mg:n vaikutuksesta naisen tai miehen lisääntymiskykyyn. Titsanidiinin oraalinen anto uros- ja naarasrotille johti haitallisiin vaikutuksiin hedelmällisyyteen [ks. Ei-kliininen toksikologia ].
Käyttö lapsille
Turvallisuutta ja tehokkuutta lapsipotilailla ei ole osoitettu.
Geriatrinen käyttö
Zanaflex 2 mg:n tiedetään erittyvän olennaisesti munuaisten kautta, ja tämän lääkkeen haittavaikutusten riski voi olla suurempi potilailla, joilla on munuaisten vajaatoiminta. Koska iäkkäillä potilailla on todennäköisemmin heikentynyt munuaisten toiminta, annoksen valinnassa on oltava varovainen, ja munuaisten toiminnan seuranta voi olla hyödyllistä.
Zanaflex 2 mg:n kliinisissä tutkimuksissa ei ollut riittävästi 65-vuotiaita ja sitä vanhempia koehenkilöitä sen määrittämiseksi, reagoivatko he eri tavalla kuin nuoremmat. Tutkimusten välinen farmakokineettisten tietojen vertailu 6 mg:n Zanaflex 2 mg:n kerta-annoksen jälkeen osoitti, että nuoremmilla koehenkilöillä lääke poistui neljä kertaa nopeammin kuin iäkkäillä. Iäkkäillä potilailla, joilla on munuaisten vajaatoiminta (kreatiniinipuhdistuma
Munuaisten vajaatoiminta
Zanaflexin tiedetään erittyvän olennaisesti munuaisten kautta, ja tämän lääkkeen haittavaikutusten riski voi olla suurempi potilailla, joilla on munuaisten vajaatoiminta. Potilailla, joilla oli munuaisten vajaatoiminta (kreatiniinipuhdistuma ANNOSTELU JA HALLINNOINTI , VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ].
Maksan vajaatoiminta
Maksan vajaatoiminnan vaikutusta titsanidiinin farmakokinetiikkaan ei ole arvioitu. Koska titsanidiini metaboloituu laajalti maksassa, maksan vajaatoiminnalla odotetaan olevan merkittäviä vaikutuksia titsanidiinin farmakokinetiikkaan [ks. ANNOSTUS JA ANNOSTUS , VAROITUKSET JA VAROTOIMET , ja KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
Turvallisuusvalvontatietokannan tarkastelu paljasti tahallisen ja vahingossa tapahtuneen Zanaflexin yliannostuksen. Jotkut tapauksista johtivat kuolemaan, ja monet tahallisista yliannostuksista johtuivat useista lääkkeistä, mukaan lukien keskushermostoa lamaavista lääkkeistä. Titsanidiinin yliannostuksen kliiniset oireet olivat yhdenmukaisia sen tunnetun farmakologian kanssa. Suurimmassa osassa tapauksista havaittiin herkkyyden heikkenemistä, mukaan lukien letargia, uneliaisuus, sekavuus ja kooma. Myös sydämen toiminnan heikkenemistä havaitaan, mukaan lukien useimmiten bradykardia ja hypotensio. Hengityslama on toinen titsanidiinin yliannostuksen yleinen piirre.
Yliannostustapauksessa on suoritettava perustoimenpiteet hengitysteiden riittävyyden varmistamiseksi sekä sydän- ja verisuoni- ja hengityselimien seuranta. Titsanidiini on rasvaliukoinen lääke, joka liukenee vain vähän veteen ja metanoliin. Siksi dialyysi ei todennäköisesti ole tehokas menetelmä lääkkeen poistamiseksi elimistöstä. Yleensä oireet häviävät 1–3 päivän kuluessa titsanidiinihoidon lopettamisen ja asianmukaisen hoidon antamisen jälkeen. Samanlaisen vaikutusmekanismin vuoksi titsanidiinin yliannostuksen oireet ja hoito ovat samanlaisia kuin klonidiinin yliannostuksen jälkeen. Ota yhteyttä myrkytystietokeskukseen saadaksesi viimeisimmät tiedot yliannostuksen hallinnasta.
VASTA-AIHEET
Zanaflex on vasta-aiheinen potilailla, jotka käyttävät voimakkaita CYP1A2:n estäjiä, kuten fluvoksamiinia tai siprofloksasiinia (ks. HUUMEIDEN VUOROVAIKUTUKSET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Titsanidiini on keskeinen alfa-2-adrenergisen reseptorin agonisti ja oletettavasti vähentää spastisuutta lisäämällä motoristen neuronien presynaptista estoa. Titsanidiinin vaikutukset ovat suurimmat polysynaptisissa reiteissä. Näiden toimien kokonaisvaikutuksen uskotaan vähentävän selkärangan motoristen neuronien helpottamista.
Farmakokinetiikka
Imeytyminen ja jakautuminen
Suun kautta annon jälkeen titsanidiini imeytyy olennaisesti kokonaan. Titsanidiinin absoluuttinen oraalinen biologinen hyötyosuus on noin 40 % (CV = 24 %) laajan maksassa tapahtuvan ensikierron metabolian vuoksi. Titsanidiini jakautuu laajalti koko kehoon, ja sen vakaan tilan jakautumistilavuus on keskimäärin 2,4 l/kg (CV = 21 %) suonensisäisen annon jälkeen terveille aikuisille vapaaehtoisille. Titsanidiini sitoutuu noin 30 % plasman proteiineihin.
Erot Zanaflex 4mg -kapseleiden® ja Zanaflex®-tablettien välillä
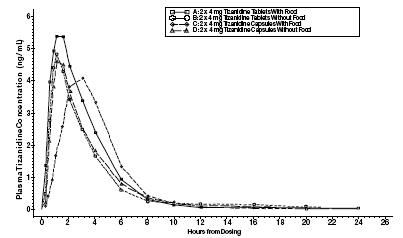
Zanaflex 2mg Capsules® ja Zanaflex® tabletit ovat biologisesti samanarvoisia toistensa kanssa paastoolosuhteissa, mutta eivät ruokittaessa. Yksittäinen annos, joka oli joko kaksi 4 mg:n tablettia tai kaksi 4 mg:n kapselia, annettiin ruokailu- ja paastoolosuhteissa avoimessa, neljän jakson satunnaistetussa risteytystutkimuksessa, johon osallistui 96 vapaaehtoista ihmistä, joista 81 oli kelvollinen tilastolliseen analyysiin. Joko tabletin tai kapselin oraalisen annon jälkeen (paastotilassa) titsanidiinin huippupitoisuudet plasmassa saavutettiin 1,0 tunnin kuluttua annostelusta ja puoliintumisaika oli noin 2 tuntia. Kun kaksi 4 mg:n tablettia annettiin ruuan kanssa, keskimääräinen maksimipitoisuus plasmassa nousi noin 30 %, ja mediaaniaika huippupitoisuuden saavuttamiseen nousi 25 minuutilla 1 tuntiin ja 25 minuuttiin. Sitä vastoin, kun kaksi 4 mg:n kapselia annettiin ruoan kanssa, plasman keskimääräinen maksimipitoisuus pieneni 20 %, ja mediaaniaika huippupitoisuuden saavuttamiseen plasmassa piteni 2–3 tuntia. Näin ollen kapselin keskimääräinen Cmax, kun se otetaan ruoan kanssa, on noin 66 % tabletin Cmax-arvosta, kun se otetaan ruoan kanssa. Ruoka lisäsi myös sekä tablettien että kapseleiden imeytymistä. Lisäys tabletilla (~ 30 %) oli merkittävästi suurempi kuin kapselilla (~ 10 %). Näin ollen, kun jokainen annettiin ruoan kanssa, kapselista imeytynyt määrä oli noin 80 % tabletista imeytyneestä määrästä. Kapselin sisällön antaminen omenasoseen päälle ei ollut bioekvivalenttia koskemattoman kapselin antamisen kanssa paasto-olosuhteissa. Kapselin sisällön antaminen omenasoseen päälle johti 15–20 %:n nousuun titsanidiinin Cmax- ja AUC-arvoissa sekä 15 minuutin keskimääräisen viiveen ja huippupitoisuuden saavuttamiseen kuluvan ajan pieneneminen verrattuna ehjän kapselin antamiseen paaston aikana.
Kuva 1: Keskimääräinen titsanidiinipitoisuus vs. aikaprofiilit Zanaflex-tableteille ja kapseleille (2 × 4 mg) paasto- ja ruokailuolosuhteissa
Aineenvaihdunta ja erittyminen
Titsanidiinin farmakokinetiikka on lineaarinen verrattuna kliinisessä kehityksessä tutkittuihin annoksiin (1-20 mg). Titsanidiinin puoliintumisaika on noin 2,5 tuntia (CV = 33 %). Noin 95 % annetusta annoksesta metaboloituu. Pääasiallinen sytokromi P450 isoentsyymi, joka osallistuu titsanidiinin metaboliaan, on CYP1A2. Titsanidiinimetaboliittien ei tiedetä olevan aktiivisia; niiden puoliintumisajat vaihtelevat 20-40 tunnin välillä.
14C-titsanidiinin kerta-annoksen ja toistuvan oraalisen annostelun jälkeen keskimäärin 60 % kokonaisradioaktiivisuudesta havaittiin virtsasta ja 20 % ulosteesta.
Tietyt populaatiot
Ikävaikutuksia
Mitään erityistä farmakokineettistä tutkimusta ei ole tehty iän vaikutusten tutkimiseksi. Farmakokineettisten tietojen ristiinvertailu 6 mg:n Zanaflex 2 mg:n kerta-annoksen jälkeen osoitti, että nuoremmilla koehenkilöillä lääke poistui neljä kertaa nopeammin kuin iäkkäillä. Zanaflex 4 mg:aa ei ole arvioitu lapsilla [ks Käyttö tietyissä populaatioissa ].
Maksan vajaatoiminta
Maksan vajaatoiminnan vaikutusta titsanidiinin farmakokinetiikkaan ei ole arvioitu. Koska titsanidiini metaboloituu laajalti maksassa, maksan vajaatoiminnalla odotetaan olevan merkittäviä vaikutuksia titsanidiinin farmakokinetiikkaan. Zanaflexia ei suositella tälle potilasryhmälle [katso Käyttö tietyissä populaatioissa ].
Munuaisten vajaatoiminta
Titsanidiinin puhdistuma pienenee yli 50 % iäkkäillä potilailla, joilla on munuaisten vajaatoiminta (kreatiniinipuhdistuma VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
Sukupuolivaikutukset
Mitään erityistä farmakokineettistä tutkimusta sukupuolivaikutusten tutkimiseksi ei tehty. Farmakokineettisten tietojen retrospektiivinen analyysi 4 mg:n Zanaflex 2 mg:n kerta- ja toistuvan annoksen jälkeen osoitti kuitenkin, että sukupuolella ei ollut vaikutusta titsanidiinin farmakokinetiikkaan.
Kilpailuefektit
Rotuun johtuvia farmakokineettisiä eroja ei ole tutkittu.
Huumeiden vuorovaikutukset
CYP1A2:n estäjät
Zanaflexin ja joko fluvoksamiinin tai siprofloksasiinin välinen yhteisvaikutus johtuu todennäköisimmin fluvoksamiinin tai siprofloksasiinin CYP1A2-estämisestä. Fluvoksamiinin vaikutusta Zanaflexin 4 mg:n kerta-annoksen farmakokinetiikkaan tutkittiin 10 terveellä koehenkilöllä. Titsanidiinin Cmax-arvo pidentyi 12-kertaiseksi, AUC-arvo 33-kertaiseksi ja puoliintumisaika 3-kertaiseksi. Siprofloksasiinin vaikutusta Zanaflex 4 mg:n kerta-annoksen 4 mg:n farmakokinetiikkaan tutkittiin 10 terveellä koehenkilöllä. Titsanidiinin Cmax nousi 7-kertaiseksi ja AUC 10-kertaiseksi [ks. VASTA-AIHEET ].
Vaikka kliinisiä tutkimuksia ei ole arvioitu muiden CYP1A2-estäjien vaikutuksia titsanidiiniin, muut CYP1A2-estäjät, kuten zileutoni, muut fluorokinolonit, rytmihäiriölääkkeet (amiodaroni, meksiletiini, propafenoni ja verapamiili), simetidiini, famotidiini ja suun kautta otettavat ehkäisyvalmisteet, asyklilopidiini voi myös johtaa huomattaviin titsanidiinipitoisuuksien nousuun veressä [katso VAROITUKSET JA VAROTOIMET ].
Ihmisen maksan mikrosomeilla tehdyt sytokromi P450-isoentsyymeillä tehdyt in vitro -tutkimukset osoittavat, että titsanidiini tai sen päämetaboliitit eivät todennäköisesti vaikuta muiden sytokromi P450-isoentsyymien kautta metaboloituvien lääkkeiden metaboliaan.
Ehkäisypillerit
Mitään erityistä farmakokineettistä tutkimusta suun kautta otettavien ehkäisyvalmisteiden ja Zanaflexin välisten yhteisvaikutusten tutkimiseksi ei ole tehty. Populaatiofarmakokineettisten tietojen retrospektiivinen analyysi 4 mg:n Zanaflexin kerta- ja toistuvan annoksen antamisen jälkeen osoitti kuitenkin, että suun kautta otettavia ehkäisyvalmisteita samanaikaisesti käyttävien naisten titsanidiinin puhdistuma oli 50 % pienempi verrattuna naisiin, jotka eivät käyttäneet oraalisia ehkäisyvalmisteita [ks. VAROITUKSET JA VAROTOIMET ].
Asetaminofeeni
Titsanidiini viivästytti asetaminofeenin Tmax-arvoa 16 minuuttia. Asetaminofeeni ei vaikuttanut titsanidiinin farmakokinetiikkaan.
Alkoholi
Alkoholi suurensi titsanidiinin AUC-arvoa noin 20 % ja nosti samalla sen Cmax-arvoa noin 15 %. Tämä liittyi titsanidiinin sivuvaikutusten lisääntymiseen. Titsanidiinin ja alkoholin keskushermostoa lamaavat vaikutukset ovat additiivisia.
Kliiniset tutkimukset
Titsanidiinin kyky alentaa spastisuuteen liittyvää lisääntynyttä lihasjännitystä osoitettiin kahdessa riittävässä ja hyvin kontrolloidussa tutkimuksessa potilailla, joilla oli multippeliskleroosi tai selkäydinvaurio (tutkimukset 1 ja 2).
Kerta-annostutkimus potilailla, joilla on MS-tauti ja spastisuus
Tutkimuksessa 1 multippeliskleroosia sairastavat potilaat satunnaistettiin saamaan kerta-annoksena suun kautta lääkettä tai lumelääkettä. Potilaat ja arvioijat olivat sokeita hoitomääräämiselle, ja pyrittiin vähentämään todennäköisyyttä, että arvioijat saisivat epäsuorasti tietoonsa hoidon määräyksestä (esim. he eivät antaneet potilaille suoraa hoitoa ja heitä kiellettiin esittämästä kysymyksiä sivuvaikutuksista). Kaikkiaan 140 potilasta sai lumelääkettä, 8 mg tai 16 mg Zanaflexia.
Vastaus arvioitiin fyysisellä tarkastuksella; lihasten sävyä arvioitiin 5 pisteen asteikolla (Ashworth-pisteet), ja pistemäärä 0 käytettiin kuvaamaan normaalia lihasjännettä. Pistemäärä 1 osoitti lievää spastista tartuntaa, kun taas pistemäärä 2 osoitti voimakkaampaa lihasvastusta. Arvosanaa 3 käytettiin kuvaamaan huomattavaa sävyn nousua, mikä vaikeutti passiivista liikettä. Spastisuuden immobilisoituneelle lihakselle annettiin arvosana 4. Myös kouristukset kerättiin.
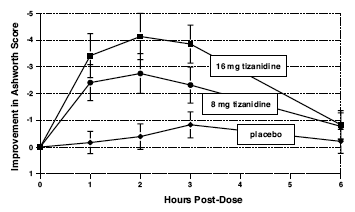
Arvioinnit tehtiin 1, 2, 3 ja 6 tuntia käsittelyn jälkeen. Tilastollisesti merkitsevä Ashworth-pistemäärän pieneneminen Zanaflex 2 mg:n annoksella lumelääkkeeseen verrattuna havaittiin 1, 2 ja 3 tunnin kuluttua hoidosta. Alla olevassa kuvassa 2 on vertailu keskimääräisestä lihasjännityksen muutoksesta lähtötasosta mitattuna Ashworthin asteikolla. Suurin lihasjännityksen lasku oli 1-2 tuntia hoidon jälkeen. Kuuden tunnin kuluttua hoidon jälkeen lihasten tonustusta 8 ja 16 mg:n Zanaflex 2 mg -ryhmissä ei voitu erottaa lumelääkettä saaneiden potilaiden lihasten tonuksesta. Tietyllä potilaalla lihasjännityksen paraneminen korreloi plasman pitoisuuden kanssa. Plasman pitoisuudet vaihtelivat potilaasta toiseen tietyllä annoksella. Vaikka 16 mg:lla oli suurempi vaikutus, haittatapahtumat, mukaan lukien hypotensio, olivat yleisempiä ja vakavampia kuin 8 mg:n ryhmässä. Kussakin ryhmässä esiintyneiden kouristusten määrässä ei ollut eroja.
Kuva 2: Yksittäisen annoksen tutkimus – keskimääräinen lihastonuksen muutos lähtötilanteesta mitattuna Ashworthin asteikolla ± 95 % luottamusvälillä (negatiivinen Ashworth-pistemäärä merkitsee lihastonuksen paranemista lähtötasosta)
Seitsemän viikon tutkimus potilailla, joilla on spastisuutta aiheuttava selkäydinvamma
Seitsemän viikkoa kestäneessä tutkimuksessa (tutkimus 2) 118 potilasta, joilla oli selkäydinvamman aiheuttamaa spastisuutta, satunnaistettiin joko lumelääkettä tai Zanaflexia saamaan. Samanlaisia vaiheita kuin ensimmäisessä tutkimuksessa käytettiin sokeutuksen eheyden varmistamiseksi.
Potilaita titrattiin 3 viikon aikana siedetyn enimmäisannoksen tai 36 mg:n vuorokaudessa kolmessa eri annoksessa (esim. 10 mg aamulla ja iltapäivällä ja 16 mg illalla). Potilaita pidettiin sitten suurimmalla siedetyllä annoksellaan 4 lisäviikkoa (eli ylläpitovaihe). Koko ylläpitovaiheen ajan lihasjännettä arvioitiin Ashworthin asteikolla 2,5 tunnin aikana joko aamu- tai iltapäiväannoksen jälkeen. Potilaat kirjasivat päivittäin kouristuksia päiväsaikaan.
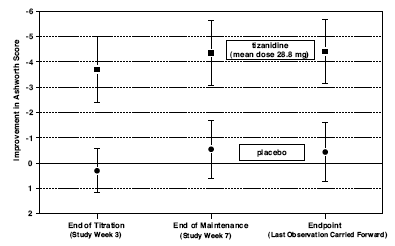
Päätepisteessä (protokollassa määritetty tulosarvioinnin aika) Zanaflexilla hoidetussa ryhmässä esiintyi tilastollisesti merkitsevää lihasjännityksen alenemista ja kouristusten esiintymistiheyttä lumelääkkeeseen verrattuna. Lihasjännityksen heikkeneminen ei liittynyt lihasvoiman heikkenemiseen (toivottu tulos), mutta se ei myöskään johtanut Zanaflex-hoitoa saaneiden potilaiden johdonmukaiseen hyötyyn päivittäisen elämän mittareissa. Alla olevassa kuvassa 3 on vertailu keskimääräisestä lihastonuksen muutoksesta lähtötasosta mitattuna Ashworthin asteikolla.
Kuva 3: Seitsemän viikon tutkimus – keskimääräinen lihasjännityksen muutos 0,5–2,5 tuntia annostelun jälkeen Ashworth-asteikolla mitattuna ± 95 % luottamusvälillä (negatiivinen Ashworth-pistemäärä merkitsee lihastonuksen paranemista lähtötasosta)
POTILASTIEDOT
Vakavat huumeiden yhteisvaikutukset
Neuvo potilaita, etteivät he saa käyttää Zanaflexia, jos he käyttävät fluvoksamiinia tai siprofloksasiinia vakavien haittavaikutusten lisääntyneen riskin vuoksi, mukaan lukien vakava verenpaineen lasku ja sedaatio. Neuvo potilaita ilmoittamaan lääkäreilleen tai apteekkiin, kun he aloittavat tai lopettavat lääkkeiden käytön Zanaflexin ja muiden lääkkeiden välisiin yhteisvaikutuksiin liittyvien riskien vuoksi.
Zanaflexin annostelu
Kerro potilaille, että he ottavat Zanaflex 2mg -tabletteja juuri niin kuin on määrätty (jatkuvasti joko ruoan kanssa tai ilman) eivätkä vaihtamasta tablettien ja kapseleiden välillä. Kerro potilaille, etteivät he saa ottaa enempää Zanaflex 2 mg:aa kuin on määrätty, koska haittatapahtumien riski on suurempi kuin 8 mg:n kerta-annoksilla tai yli 36 mg:n vuorokausiannoksilla. Kerro potilaille, että heidän ei pitäisi yhtäkkiä lopettaa Zanaflex 4 mg -valmisteen käyttöä, koska saattaa esiintyä rebound-hypertensiota ja takykardiaa.
Zanaflexin vaikutukset
Varoita potilaita siitä, että he voivat kokea hypotensiota, ja ole varovainen vaihtaessaan makuu- tai istuma-asennosta seisoma-asentoon. Kerro potilaille, että Zanaflex voi saada heidät rauhoittumaan tai uneliaaksi, ja heidän tulee olla varovaisia suorittaessaan valppautta vaativia toimintoja, kuten ajoneuvoa ajaessaan tai käyttäessään koneita. Kerro potilaille, että sedaatio voi olla additiivinen, kun Zanaflex 4 mg otetaan yhdessä keskushermostoa lamaavien lääkkeiden (baklofeeni, bentsodiatsepiinit) tai aineiden (esim. alkoholi) kanssa. Muistuta potilaita siitä, että Zanaflex vähentää spastisuutta, jos he ovat riippuvaisia spastisuudestaan säilyttääkseen asennon ja tasapainon liikkeessä tai kun spastisuutta käytetään toiminnan lisäämiseen, että Zanaflex vähentää spastisuutta ja on noudatettava varovaisuutta.
