Yasmin 3/0.03mg Drospirenone Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Yasmin on ja miten sitä käytetään?
Yasmin on reseptilääke, jota käytetään kohtalaisen aknen, kuukautisia edeltävän dysforisen häiriön (PMDD) oireiden hoitoon ja raskauden estämiseen. Yasminia voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Yasmin kuuluu lääkeluokkaan, jota kutsutaan aknelääkkeeksi, systeemiseksi, estrogeeniksi/progestiiniksi, ehkäisyvalmisteeksi ja suun kautta.
Ei tiedetä, onko Yasmin 3mg turvallinen ja tehokas alle 14-vuotiaille lapsille.
Mitkä ovat Yasminin mahdolliset sivuvaikutukset?
Yasmin 0,03 mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- äkillinen tunnottomuus tai heikkous,
- äkilliset voimakkaat päänsäryt,
- sammaltava puhe,
- ongelmia näkösi kanssa,
- vaikeuksia tasapainon kanssa,
- äkillinen näönmenetys,
- pistävä rintakipu,
- hengenahdistus,
- yskii verta,
- kipu tai lämpö toisessa tai molemmissa jaloissa,
- rintakipu tai paine,
- kipu leviää leukaan tai olkapäähän,
- pahoinvointi,
- hikoilu,
- ruokahalun menetys,
- ylävatsakipu,
- väsymys,
- tumma virtsa,
- savenväriset ulosteet,
- ihon tai silmiesi kellastuminen (keltatauti),
- näön hämärtyminen,
- hakkaa niskassasi tai korvissasi,
- turvotus käsissäsi, nilkoissasi tai jaloissasi,
- muutos migreenipäänsäryn rakenteessa tai vaikeusasteessa,
- unihäiriöt,
- heikkous,
- väsynyt tunne ja
- mielialan muutoksia
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Yasmin 3mg:n yleisimmät sivuvaikutukset ovat:
- pahoinvointi,
- oksentelua,
- rintojen arkuus,
- päänsärky,
- mielialan muutoksia,
- väsymys tai ärtyneisyys,
- painonnousu,
- muutokset kuukautiskierrossasi ja
- vähentynyt seksihalu
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Yasminin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
TUPAKOINTI JA VAKAVAT SYDÄN-VERENSUUNITOTAPAHTUMAT
Tupakointi lisää vakavien sydän- ja verisuonitapahtumien riskiä yhdistelmäehkäisytablettien (COC) käytöstä. Tämä riski kasvaa iän myötä, erityisesti yli 35-vuotiailla naisilla, ja poltettujen savukkeiden lisääntyessä. Tästä syystä yli 35-vuotiaat ja tupakoivat naiset eivät saa käyttää yhdistelmäehkäisytabletteja (ks. VASTA-AIHEET).
KUVAUS
Yasmin (drospirenoni/etinyyliestradioli) -tabletit tarjoavat suun kautta otettavan ehkäisyohjelman, joka koostuu 28 kalvopäällysteisestä tabletista, jotka sisältävät kullekin tabletille alla määritellyt aineosat:
- 21 keltaista tablettia, joista jokainen sisältää 3 mg DRSP:tä ja 0,03 mg EE:tä
- 7 inerttiä valkoista tablettia
Keltaisten tablettien inaktiiviset aineet ovat laktoosimonohydraatti NF, maissitärkkelys NF, esigelatinoitu tärkkelys NF, povidoni 25000 NF, magnesiumstearaatti NF, hypromelloosi USP, makrogoli 6000 NF, titaanidioksidi USP, talkki USP ja rautaoksidipigmentti. Valkoiset inertit kalvopäällysteiset tabletit sisältävät laktoosimonohydraattia NF, mikrokiteistä selluloosaa, magnesiumstearaattia NF, hypromelloosi USP, talkki USP ja titaanidioksidi USP.
Drospirenoni (6R,7R,8R,9S,10R,13S,14S,15S,16S,17S)-1,3',4',6,6a,7,8,9,10,11,12 ,13,14,15,15a,16-heksadekahydro-10,13-dimetyylispiro[17H-disyklopropa-[6,7:15,16]syklopenta[a]fenantreeni-17,2'(5H)-furaani]- 3,5'(2H)-dioni) on synteettinen progestaatioyhdiste, jonka molekyylipaino on 366,5 ja molekyylikaava C24H30O3.
Etinyyliestradioli (19-nor-17a-pregna 1,3,5(10)-trieeni-20-yyni-3,17-dioli) on synteettinen estrogeeninen yhdiste, jonka molekyylipaino on 296,4 ja molekyylikaava C20H24O2.
Rakennekaavat ovat seuraavat:
INDIKAATIOT
Yasmin® on tarkoitettu käytettäväksi naisille raskauden estämiseksi.
ANNOSTELU JA HALLINNOINTI
Kuinka ottaa Yasmin
Ota yksi tabletti suun kautta samaan aikaan joka päivä. Epäonnistumisprosentti voi kasvaa, jos pillerit jäävät ottamatta tai ottaa väärin.
Maksimaalisen ehkäisytehokkuuden saavuttamiseksi Yasmin on otettava ohjeiden mukaisesti läpipainopakkauksessa olevan ohjeen mukaisessa järjestyksessä. Yksittäiset unohtuneet pillerit tulee ottaa heti, kun se muistetaan.
Kuinka aloittaa Yasmin
Neuvo potilasta aloittamaan Yasminin ottaminen joko kuukautistensa ensimmäisenä päivänä (1. päivän aloitus) tai ensimmäisenä kuukautisten alkamisen jälkeisenä sunnuntaina (sunnuntai alkaa).
Päivä 1 aloitus
Pyydä potilasta ottamaan Yasminin ensimmäisen käyttöjakson aikana yksi keltainen Yasmin 3 mg päivittäin kuukautiskiertonsa ensimmäisestä päivästä alkaen. (Kuukautisten ensimmäinen päivä on päivä 1.) Hänen tulee ottaa yksi keltainen Yasmin 0,03 mg päivässä 21 peräkkäisenä päivänä ja sen jälkeen yksi valkoinen tabletti päivittäin päivinä 22-28. Yasmin 0,03 mg tulee ottaa pakkauksessa olevan järjestyksessä samaan aikaan joka päivä, mieluiten ilta-aterian jälkeen tai nukkumaan mennessä nesteen kera tarpeen mukaan. Yasmin 3 mg voidaan ottaa aterioista riippumatta. Jos Yasmin otetaan ensimmäisen kerran myöhemmin kuin kuukautiskierron ensimmäisenä päivänä, Yasminia ei tulisi pitää tehokkaana ehkäisyvälineenä ennen kuin 7 ensimmäisen peräkkäisen tuotteen antopäivän jälkeen. Neuvo potilasta käyttämään ei-hormonaalista ehkäisyä varmuuskopiona ensimmäisten 7 päivän aikana. Ovulaation ja hedelmöittymisen mahdollisuus tulee ottaa huomioon ennen lääkityksen aloittamista.
Sunnuntai Alku
Ensimmäisen Yasmin 3 mg:n käyttöjakson aikana neuvo potilasta ottamaan yksi keltainen Yasmin 0,03 mg päivittäin, ensimmäisestä kuukautisten alkamisen jälkeisestä sunnuntaista alkaen. Hänen tulee ottaa yksi keltainen Yasmin päivittäin 21 peräkkäisenä päivänä ja sen jälkeen yksi valkoinen tabletti päivittäin päivinä 22-28. Yasmin tulee ottaa pakkauksessa olevan järjestyksessä samaan aikaan joka päivä, mieluiten ilta-aterian jälkeen tai nukkumaan mennessä. tarvittaessa nesteellä. Yasmin voidaan ottaa aterioista riippumatta. Yasmin 3mg:n ei pitäisi katsoa tehokkaaksi ehkäisymenetelmäksi ennen kuin 7 ensimmäisen peräkkäisen tuotteen antopäivän jälkeen. Neuvo potilasta käyttämään ei-hormonaalista ehkäisyä varmuuskopiona ensimmäisten 7 päivän aikana. Ovulaation ja hedelmöittymisen mahdollisuus tulee ottaa huomioon ennen lääkityksen aloittamista.
Potilaan tulee aloittaa seuraava ja kaikki seuraavat 28 päivän Yasmin 0,03 mg -hoito-ohjelmat samana viikonpäivänä, jolloin hän aloitti ensimmäisen hoito-ohjelmansa saman aikataulun mukaisesti. Hänen tulee aloittaa keltaisten tablettien ottaminen seuraavana päivänä viimeisen valkoisen tabletin nauttimisen jälkeen riippumatta siitä, ovatko kuukautiset alkaneet vai ovatko ne edelleen käynnissä. Aina kun seuraava Yasmin-sykli aloitetaan myöhemmin kuin seuraavana päivänä viimeisen valkoisen tabletin antoa seuraavana päivänä, potilaan tulee käyttää toista ehkäisymenetelmää, kunnes hän on ottanut keltaisen Yasmin 3 mg vuorokaudessa seitsemän peräkkäisenä päivänä.
Kun vaihdetaan eri ehkäisypillereistä
Kun vaihdetaan toisesta ehkäisypillereistä, Yasmin 3mg tulee aloittaa samana päivänä, kun aiemman ehkäisyvalmisteen uusi pakkaus olisi aloitettu.
Kun vaihdetaan muusta menetelmästä kuin ehkäisypillereistä
Kun vaihdetaan depotlaastarista tai emätinrenkaasta, Yasmin-valmisteen käyttö tulee aloittaa seuraavan kerran, kun se olisi pitänyt kiinnittää. Kun vaihdetaan injektiosta, Yasmin-hoito tulee aloittaa heti, kun seuraava annos olisi pitänyt ottaa. Kun vaihdetaan kohdunsisäisestä ehkäisyvalmisteesta tai implantista, Yasmin-hoito tulee aloittaa poistopäivänä.
Vieroitusverenvuoto ilmenee yleensä 3 päivän kuluessa viimeisen keltaisen tabletin ottamisesta. Jos tiputtelu- tai läpäisyvuotoa esiintyy Yasmin-hoidon aikana, neuvo potilasta jatkamaan Yasminin ottamista yllä kuvatulla hoito-ohjelmalla. Kerro hänelle, että tämäntyyppinen verenvuoto on yleensä ohimenevää ja merkityksetöntä; kerro kuitenkin hänelle, että jos verenvuoto on jatkuvaa tai pitkittynyttä, hänen tulee ottaa yhteyttä terveydenhuollon tarjoajaan.
Vaikka raskauden ilmaantuminen on vähäistä, jos Yasmin 3 mg otetaan ohjeiden mukaan, harkitse raskauden mahdollisuutta, jos vieroitusvuotoa ei esiinny. Jos potilas ei ole noudattanut määrättyä annosteluaikataulua (jäänyt väliin yhden tai useamman vaikuttavan tabletin tai aloittanut niiden ottamisen päivää myöhemmin kuin olisi pitänyt), harkitse raskauden mahdollisuutta ensimmäisten kuukautisten väliin jäämisen yhteydessä ja ryhdy asianmukaisiin diagnostisiin toimenpiteisiin. . Jos potilas on noudattanut määrättyä hoito-ohjelmaa ja häneltä jää kaksi peräkkäistä kuukautisia, sulje pois raskaus. Lopeta Yasmin 3 mg:n käyttö, jos raskaus varmistuu.
Raskauden riski kasvaa jokaisen aktiivisen keltaisen tabletin unohtuessa. Jos haluat lisäohjeita potilaalle unohdetuista pillereistä, katso " MITÄ TEHDÄ, JOS VÄLITÄÄN PILLEERIT ”-osio FDA:n hyväksymässä Potilaan merkintä Jos tablettien unohtamisen jälkeen ilmaantuu läpäisyvuotoa, se on yleensä ohimenevää eikä sillä ole vaikutusta. Jos potilas unohtaa yhden tai useamman valkoisen tabletin, hänen tulee silti olla suojassa raskaudelta, mikäli hän aloittaa uuden keltaisten tablettien ottamisen oikeana päivänä.
Aloita Yasmin-hoito aikaisintaan 4 viikkoa synnytyksen jälkeen niille naisille, jotka eivät imetä tai toisen raskauskolmanneksen abortin jälkeen tromboembolian lisääntyneen riskin vuoksi. Jos potilas aloittaa Yasmin-hoidon synnytyksen jälkeen eikä kuukautiset ole vielä alkaneet, arvioi mahdollinen raskaus ja neuvo häntä käyttämään muuta ehkäisymenetelmää, kunnes hän on ottanut Yasminia 7 peräkkäisenä päivänä.
Neuvoja ruoansulatuskanavan häiriöiden varalta
Voimakkaan oksentelun tai ripulin ilmetessä imeytyminen ei välttämättä ole täydellistä ja lisäehkäisyä on käytettävä. Jos oksentelua esiintyy 3-4 tunnin kuluessa tabletin ottamisesta, sitä voidaan pitää tabletin unohtamisena.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
Yasmin (drospirenoni/etinyyliestradioli) -tabletit ovat saatavilla läpipainopakkauksissa.
Jokainen läpipainopakkaus sisältää 28 kalvopäällysteistä, pyöreää, kaksoiskuperia tablettia seuraavassa järjestyksessä:
- 21 keltaista tablettia, joista jokainen sisältää 3 mg drospirenonia (DRSP) ja 0,03 mg etinyyliestradiolia (EE), jonka toisella puolella on säännöllinen kuusikulmio "DO"
- 7 inerttiä valkoista tablettia, joiden toisella puolella on "DP" tavallisessa kuusikulmiossa
Varastointi ja käsittely
Yasmin (drospirenoni/etinyyliestradioli) tabletit ovat saatavilla kolmen läpipainopakkauksen pakkauksissa ( NDC 50419-402-03).
Kalvopäällysteiset tabletit ovat pyöristettyjä ja niissä on kaksoiskuperat pinnat, toisella puolella on säännöllinen kuusikulmio, jossa on DO tai DP.
Jokainen läpipainopakkaus sisältää 28 kalvopäällysteistä tablettia seuraavassa järjestyksessä:
- 21 pyöreää, kaksoiskuperia, keltaista, kalvopäällysteistä tablettia, joiden toisella puolella on säännöllinen kuusikulmio kohokuvioitu "DO" ja jokainen sisältää 3 mg drospirenonia ja 0,03 mg etinyyliestradiolia
- pyöreää, kaksoiskuperia, valkoista, kalvopäällysteistä tablettia, joiden toisella puolella on kohokuvioitu "DP" tavallisessa kuusikulmiossa
Varastointi
Säilytä 25°C (77°F); retket sallitaan 15-30°C:een (59-86°F) [katso USP-ohjattu huonelämpötila ].
Valmistettu: Bayer HealthCare Pharmaceuticals Inc. Whippany, NJ 07981. Valmistettu Saksassa. Tarkistettu: toukokuu 2015
SIVUVAIKUTUKSET
Seuraavia yhdistelmäehkäisytablettien käyttöön liittyviä vakavia haittavaikutuksia käsitellään muualla merkinnöissä:
- Vakavat sydän- ja verisuonitapahtumat ja aivohalvaus [katso LAATIKKO VAROITUS ja VAROITUKSET JA VAROTOIMET ]
- Verisuonitapahtumat [katso VAROITUKSET JA VAROTOIMET ]
- Maksasairaus [katso VAROITUKSET JA VAROTOIMET ]
COC-käyttäjien yleisesti ilmoittamat haittavaikutukset ovat:
- Epäsäännöllinen kohdun verenvuoto
- Pahoinvointi
- Rintojen arkuus
- Päänsärky
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, havaittuja haittavaikutusten määrää ei voida suoraan verrata muiden kliinisten tutkimusten osuuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Toimitetut tiedot heijastavat kokemusta Yasminin (3 mg DRSP/0,03 mg EE) käytöstä riittävissä ja hyvin kontrolloiduissa ehkäisytutkimuksissa (N=2 837). Yhdysvalloissa tehty keskeinen kliininen tutkimus (N = 326) oli monikeskustutkimus, jossa tehtiin avoin tutkimus terveillä 18–35-vuotiailla naisilla, joita hoidettiin enintään 13 syklin ajan. Toinen keskeinen tutkimus (N=442) oli monikeskustutkimus, satunnaistettu, avoin vertaileva eurooppalainen tutkimus Yasmin vs. 0,150 mg desogestreeli/0,03 mg EE, joka suoritettiin terveillä 17–40-vuotiailla naisilla, joita hoidettiin enintään 26 syklin ajan.
Yleisimmät haittavaikutukset (≥ 2 % käyttäjistä) olivat: premenstruaalinen oireyhtymä (13,2 %), päänsärky/migreeni (10,7 %), rintojen kipu/arkuus/epämukavuus (8,3 %), pahoinvointi/oksentelu (4,5 %) vatsakipu/ epämukavuus/arkuus (2,3 %) ja mielialan muutokset (masennus, masentunut mieliala, ärtyneisyys, mielialan vaihtelut, mielialan vaihtelut ja vaikuttavat labiliteettiin (2,3 %).
Haittavaikutukset (≥ 1 %), jotka johtavat tutkimuksen keskeyttämiseen
837 naisesta 6,7 % keskeytti kliiniset tutkimukset haittavaikutuksen vuoksi; yleisin hoidon lopettamiseen johtanut haittavaikutus oli päänsärky/migreeni (1,5 %).
Vakavat haittavaikutukset
Masennus, keuhkoembolia, myrkyllinen ihottuma ja kohdun leiomyooma.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu Yasminin hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Haittavaikutukset, mukaan lukien kuolemaan johtaneet, on ryhmitelty elinjärjestelmäluokkiin ja järjestetty yleisyyden mukaan.
Verisuonihäiriöt: Laskimo- ja valtimotromboemboliset tapahtumat (mukaan lukien keuhkoembolia, syvä laskimotukos, sydämensisäinen tromboosi, kallonsisäinen laskimotukos, sagitaalinen poskiontelotukos, verkkokalvon laskimotukos, sydäninfarkti ja aivohalvaus), verenpainetauti
Maksa-sappihäiriöt: Sappirakon sairaus
Immuunijärjestelmän häiriöt: Yliherkkyys
Aineenvaihdunta- ja ravitsemushäiriöt: Hyperkalemia
Ihon ja ihonalaisen kudoksen häiriöt: Chloasma
HUUMEIDEN VUOROVAIKUTUKSET
Katso kaikkien samanaikaisesti käytettyjen lääkkeiden merkinnöistä lisätietoja interaktioista hormonaalisten ehkäisyvalmisteiden kanssa tai mahdollisista entsyymimuutoksista.
Muiden lääkkeiden vaikutukset yhdistelmäehkäisyvalmisteisiin
COC-lääkkeiden tehoa heikentävät aineet
Lääkkeet tai kasviperäiset tuotteet, jotka indusoivat tiettyjä entsyymejä, mukaan lukien sytokromi P450 3A4 (CYP3A4), voivat heikentää yhdistelmäehkäisytablettien tehoa tai lisätä läpäisyvuotoa. Jotkut lääkkeet tai kasviperäiset tuotteet, jotka voivat heikentää hormonaalisten ehkäisyvalmisteiden tehoa, ovat fenytoiini, barbituraatit, karbamatsepiini, bosentaani, felbamaatti, griseofulviini, okskarbatsepiini, rifampiini, topiramaatti ja mäkikuismaa sisältävät tuotteet. Oraalisten ehkäisyvalmisteiden ja muiden lääkkeiden väliset vuorovaikutukset voivat johtaa läpilyöntiverenvuotoon ja/tai ehkäisyn epäonnistumiseen. Neuvo naisia käyttämään vaihtoehtoista ehkäisymenetelmää tai varamenetelmää, kun entsyymi-induktoreita käytetään yhdistelmäehkäisytablettien kanssa, ja jatkamaan varmistusehkäisyä 28 päivän ajan entsyymi-induktorien käytön lopettamisen jälkeen ehkäisyn luotettavuuden varmistamiseksi.
Aineet, jotka lisäävät yhdistelmäehkäisytablettien plasmapitoisuutta
Atorvastatiinin ja tiettyjen EE:tä sisältävien yhdistelmäehkäisytablettien samanaikainen käyttö lisää EE:n AUC-arvoja noin 20 %. Askorbiinihappo ja asetaminofeeni voivat lisätä plasman EE-pitoisuuksia, mahdollisesti estämällä konjugaatiota.
Kohtalaisten tai vahvojen CYP3A4:n estäjien, kuten atsoli-sienilääkkeiden (esim. ketokonatsoli, itrakonatsoli, vorikonatsoli, flukonatsoli), verapamiilin, makrolidien (esim. klaritromysiini, erytromysiini), diltiatseemin ja greippimehun samanaikainen käyttö voi lisätä estrogeenipitoisuutta plasmassa tai progestiini tai molemmat. Premenopausaalisilla naisilla tehdyssä kliinisessä lääkkeiden yhteisvaikutustutkimuksessa DRSP 3 mg/EE 0,02 mg sisältävien tablettien ja vahvan CYP3A4-estäjän, ketokonatsolin 200 mg kahdesti vuorokaudessa 10 päivän ajan samanaikainen antaminen kerran vuorokaudessa johti kohtalaiseen systeemisen DRSP-altistuksen lisääntymiseen. . EE-altistus lisääntyi lievästi [katso VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ].
Ihmisen immuunikatoviruksen (HIV)/hepatiitti C-viruksen (HCV) proteaasi-inhibiittorit ja ei-nukleosidikäänteiskopioijaentsyymin estäjät
Merkittäviä muutoksia (nousua tai laskua) plasman estrogeeni- ja progestiinin pitoisuuksissa on havaittu joissakin tapauksissa, kun niitä on annettu samanaikaisesti HIV/HCV-proteaasiestäjien tai muiden kuin nukleosidisten käänteiskopioijaentsyymin estäjien kanssa.
Antibiootit
Raskautta on raportoitu hormonaalisten ehkäisyvalmisteiden ja antibioottien käytön aikana, mutta kliiniset farmakokineettiset tutkimukset eivät ole osoittaneet antibioottien johdonmukaisia vaikutuksia plasman synteettisten steroidien pitoisuuksiin.
Oraalisten yhdistelmäehkäisyvalmisteiden vaikutukset muihin lääkkeisiin
EE:tä sisältävät yhdistelmäehkäisytabletit voivat estää muiden yhdisteiden metaboliaa. Yhdistelmäehkäisytablettien on osoitettu vähentävän merkittävästi plasman lamotrigiinipitoisuuksia, mikä johtuu todennäköisesti lamotrigiinin glukuronidaation induktiosta. Tämä voi heikentää kohtausten hallintaa; siksi lamotrigiinin annoksen muuttaminen saattaa olla tarpeen. Katso samanaikaisesti käytetyn lääkkeen merkinnöistä lisätietoja yhteisvaikutuksista yhdistelmäehkäisytablettien kanssa tai mahdollisista entsyymimuutosten mahdollisista muutoksista.
COC:t, jotka lisäävät CYP450-entsyymien pitoisuutta plasmassa
Kliinisissä tutkimuksissa EE:tä sisältävän hormonaalisen ehkäisyvalmisteen antaminen ei johtanut plasman CYP3A4-substraattien (esim. midatsolaamin) pitoisuuden nousuun tai vain vähäiseen nousuun, kun taas CYP2C19-substraattien (esim. omepratsoli ja vorikonatsoli) ja CYP1A2-substraattien pitoisuudet plasmassa (esim. teofylliini ja tisanidiini) voi olla heikko tai kohtalainen nousu.
Kliiniset tutkimukset eivät osoittaneet DRSP:n estävää potentiaalia ihmisen CYP-entsyymejä kohtaan kliinisesti merkittävillä pitoisuuksilla [ks. KLIININEN FARMAKOLOGIA ].
Kilpirauhashormonikorvaushoitoa saavat naiset saattavat tarvita suurempia kilpirauhashormoniannoksia, koska kilpirauhasta sitovan globuliinin pitoisuus seerumissa kasvaa yhdistelmäehkäisytablettien käytön myötä.
Mahdollisuus lisätä seerumin kaliumpitoisuutta
Seerumin kaliumpitoisuus saattaa nousta naisilla, jotka käyttävät Yasminia muiden lääkkeiden kanssa, jotka voivat lisätä seerumin kaliumpitoisuutta [ks. VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ].
Häiriö laboratoriotutkimuksiin
Ehkäisysteroidien käyttö voi vaikuttaa tiettyjen laboratoriotutkimusten tuloksiin, kuten hyytymistekijöihin, lipideihin, glukoosinsietokykyyn ja sitoutuviin proteiineihin. DRSP lisää plasman reniiniaktiivisuutta ja plasman aldosteroniaktiivisuutta sen lievän antimineralokortikoidiaktiivisuuden indusoimana [ks. VAROITUKSET JA VAROTOIMET ja HUUMEIDEN VUOROVAIKUTUKSET ].
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Tromboemboliset häiriöt ja muut verisuoniongelmat
Lopeta Yasmin-hoito, jos valtimo- tai laskimotromboottinen (VTE) -tapahtuma ilmenee.
Yasmin 0,03 mg:sta tällä hetkellä saatavilla olevien tietojen perusteella DRSP:tä sisältäviin yhdistelmäehkäisytabletteihin saattaa liittyä suurempi laskimotromboembolian (VTE) riski kuin progestiinia, levonorgestreeliä tai joitain muita progestiineja sisältäviin yhdistelmäehkäisytabletteihin. Epidemiologisissa tutkimuksissa, joissa verrattiin laskimotromboembolian riskiä, raportoitiin, että riski vaihteli ei-lisäyksestä kolminkertaistumiseen. Ennen kuin aloitat Yasminin käytön uudella yhdistelmäehkäisytablettien käyttäjällä tai naisella, joka on siirtymässä DRSP:tä sisältämättömästä ehkäisystä, harkitse DRSP:tä sisältävän yhdistelmäehkäisytablettien riskejä ja etuja hänen laskimotromboemboliaan liittyvän riskin valossa. Tunnettuja laskimotromboembolian riskitekijöitä ovat tupakointi, liikalihavuus ja suvussa esiintynyt laskimotromboembolia muiden tekijöiden lisäksi, jotka estävät yhdistelmäehkäisytablettien käytön [ks. VASTA-AIHEET ].
Useissa tutkimuksissa on verrattu laskimotromboemboliaa Yasminin käyttäjille muiden yhdistelmäehkäisytablettien, mukaan lukien levonorgestreeliä sisältävien yhdistelmäehkäisytablettien, käyttäjien riskiin. Ne, jotka sääntelyvirastot vaativat tai sponsoroivat, on yhteenveto taulukossa 1.
Näiden "sääntelytutkimusten" lisäksi on tehty muitakin erilaisia tutkimuksia. Kaiken kaikkiaan on olemassa kaksi prospektiivista kohorttitutkimusta (katso taulukko 1): Yhdysvaltain hyväksynnän jälkeinen turvallisuustutkimus Ingenix [Seeger 2007], eurooppalainen hyväksynnän jälkeinen turvallisuustutkimus EURAS (European Active Surveillance Study) [Dinger 2007]. EURAS-tutkimuksen laajennus, Long-Term Active Surveillance Study (LASS) -tutkimukseen ei otettu uusia koehenkilöitä, vaan se jatkoi VTE-riskin arviointia. On olemassa kolme retrospektiivistä kohorttitutkimusta: yksi FDA:n rahoittama tutkimus Yhdysvalloissa (katso taulukko 1) ja kaksi Tanskasta [Lidegaard 2009, Lidegaard 2011]. On olemassa kaksi tapauskontrollitutkimusta: hollantilainen MEGA-tutkimusanalyysi [van Hylckama Vlieg 2009] ja saksalainen tapauskontrollitutkimus [Dinger 2010]. On olemassa kaksi sisäkkäistä tapauskontrollitutkimusta, joissa arvioitiin ei-fataalin idiopaattisen laskimotromboembolian riskiä: PharMetrics-tutkimus [Jick 2011] ja GPRD-tutkimus [Parkin 2011]. Kaikkien näiden tutkimusten tulokset on esitetty kuvassa 1.
Kuva 1: VTE-riski Yasmin 0,03 mg:n kanssa suhteessa LNG:tä sisältäviin yhdistelmäehkäisytabletteihin (mukautettu riskinro) 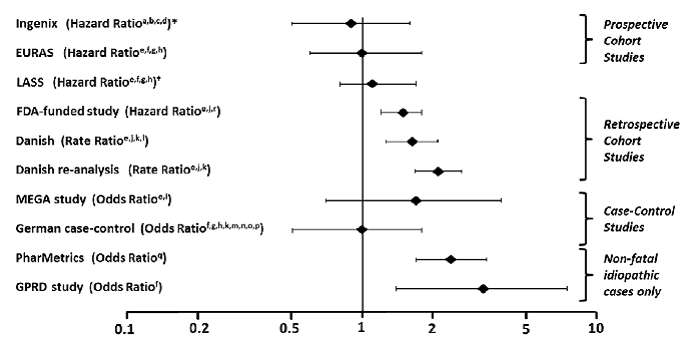
Riskisuhteet näytetään logaritmisella asteikolla; riskisuhde 1 tarkoittaa lisääntynyttä laskimotromboemboliaa DRSP:lle.
*Vertailu "Muut COC:t", mukaan lukien LNG:tä sisältävät yhdistelmäehkäisytabletit † LASS on EURAS-tutkimuksen laajennus
#Jotkut säätötekijät on merkitty yläkirjaimilla: a) Nykyinen runsas tupakointi, b) verenpainetauti, c) liikalihavuus, d) sukuhistoria, e) ikä, f) BMI, g) käytön kesto, h) laskimotromboemboli, i) sisällyttämisaika, j) kalenterivuosi, k) koulutus, l) käytön pituus, m) pariteetti, n) krooninen sairaus, o) samanaikainen lääkitys, p) tupakointi, q) altistuksen kesto, r) paikka
(Viitteet: Ingenix [Seeger 2007]1, EURAS (European Active Surveillance Study) [Dinger 2007]2, LASS (Long-Term Active Surveillance Study) [Dinger, julkaisematon asiakirja tiedostossa], FDA:n rahoittama tutkimus [Sidney 2011]3 , tanskalainen [Lidegaard 2009]4, tanskalainen uudelleenanalyysi [ Lidegaard 2011]5, MEGA-tutkimus [van Hylckama Vlieg 2009]6, saksalainen Case-Control-tutkimus [Dinger 2010]7, PharMetrics [Jick 2011]8, GPRD-tutkimus [1] 9)
Vaikka absoluuttiset laskimotromboembolit ovat korkeampia hormonaalisia ehkäisyvälineitä käyttävillä verrattuna ei-käyttäjiin, raskauden aikana esiintyvyys on vielä suurempi, erityisesti synnytyksen jälkeisenä aikana (ks. kuva 2). VTE:n riskin yhdistelmäehkäisytabletteja käyttävillä naisilla on arvioitu olevan 3–9 tapausta 10 000 naisvuotta kohden. Laskimotautiriski on suurin ensimmäisen käyttövuoden aikana. Eri yhdistelmäehkäisytablettien laajan, prospektiivisen kohorttiturvallisuustutkimuksen tiedot viittaavat siihen, että tämä lisääntynyt riski verrattuna yhdistelmäehkäisytablettien käyttäjiin on suurin ensimmäisten 6 kuukauden aikana yhdistelmäehkäisytablettien käytön aikana. Tämän turvallisuustutkimuksen tiedot osoittavat, että suurin laskimotromboemboliariski on, kun yhdistelmäehkäisytablettien yhdistelmä on aloitettu tai aloitettu uudelleen (4 viikon tai pidemmän pilleritauon jälkeen) sama tai eri yhdistelmäehkäisytablettien käyttö.
Oraalisista ehkäisyvalmisteista johtuva tromboembolisen sairauden riski häviää vähitellen yhdistelmäehkäisytablettien käytön lopettamisen jälkeen.
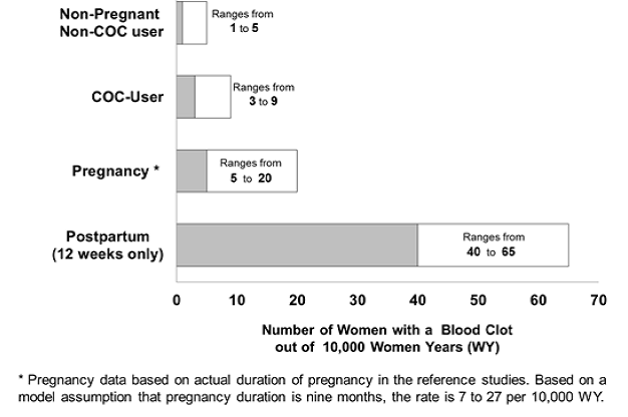
Kuvassa 2 esitetään riski saada laskimotromboembolia naisille, jotka eivät ole raskaana eivätkä käytä ehkäisyvalmisteita, naisille, jotka käyttävät suun kautta otettavia ehkäisyvalmisteita, raskaana oleville naisille ja naisille synnytyksen jälkeen. Laskimotromboembolian kehittymisen riskin tarkastelu: Jos 10 000 naista, jotka eivät ole raskaana ja eivät käytä ehkäisyvalmisteita, seurataan vuoden ajan, 1–5 näistä naisista kehittyy laskimotromboemboliaan.
Kuva 2: VTE:n kehittymisen todennäköisyys 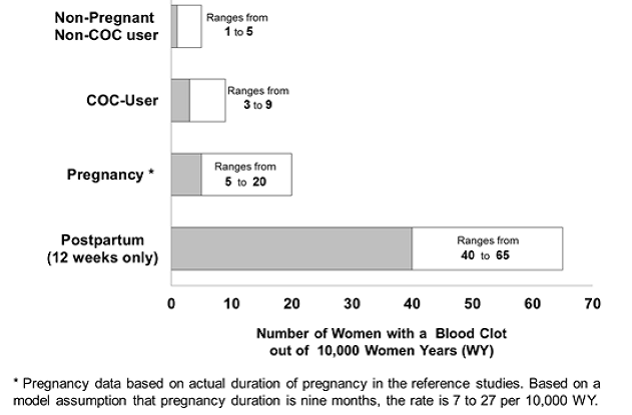
Jos mahdollista, lopeta Yasmin-hoito vähintään 4 viikkoa ennen ja 2 viikkoa suuren leikkauksen tai muun leikkauksen jälkeen, jolla tiedetään olevan kohonnut tromboembolian riski.
Aloita Yasmin aikaisintaan 4 viikkoa synnytyksen jälkeen naisilla, jotka eivät imetä. Synnytyksen jälkeisen tromboembolian riski pienenee kolmannen synnytyksen jälkeisen viikon jälkeen, kun taas ovulaation riski kasvaa kolmannen synnytyksen jälkeisen viikon jälkeen.
Yhdistelmäehkäisytablettien käyttö lisää myös valtimotromboosien, kuten aivohalvausten ja sydäninfarktien, riskiä, erityisesti naisilla, joilla on muita näiden tapahtumien riskitekijöitä.
Yhdistelmäehkäisytablettien on osoitettu lisäävän aivoverisuonitapahtumien (tromboottisten ja hemorragisten aivohalvausten) sekä suhteellista että aiheellista riskiä, vaikka yleensä riski on suurin iäkkäillä (> 35-vuotiailla) verenpainepotilailla, jotka myös tupakoivat. COC:t lisäävät myös aivohalvauksen riskiä naisilla, joilla on muita taustalla olevia riskitekijöitä.
Suun kautta otettavia ehkäisyvalmisteita tulee käyttää varoen naisilla, joilla on sydän- ja verisuonitautien riskitekijöitä.
Lopeta Yasmin 0,03 mg, jos sinulla on selittämätön näönmenetys, proptoosi, diplopia, papilledema tai verkkokalvon verisuonivaurioita. Arvioi verkkokalvon laskimotromboosi välittömästi. [Katso HAITTAVAIKUTUKSET ]
Hyperkalemia
Yasmin sisältää 3 mg progestiinia DRSP:tä, jolla on antimineralokortikoidivaikutusta, mukaan lukien mahdollisuus hyperkalemiaan suuren riskin potilailla, mikä on verrattavissa 25 mg:n spironolaktoniannokseen. Yasmin on vasta-aiheinen potilailla, joilla on hyperkalemialle altistavia sairauksia (eli munuaisten vajaatoimintaa, maksan vajaatoimintaa ja lisämunuaisten vajaatoimintaa). Naisten, jotka saavat päivittäistä pitkäaikaista kroonisten sairauksien tai sairauksien hoitoa lääkkeillä, jotka voivat lisätä seerumin kaliumpitoisuutta, on tarkistettava seerumin kaliumpitoisuus ensimmäisen hoitojakson aikana. Lääkkeitä, jotka voivat lisätä seerumin kaliumpitoisuutta, ovat ACE:n estäjät, angiotensiini-II-reseptorin salpaajat, kaliumia säästävät diureetit, kaliumlisäaineet, hepariini, aldosteroniantagonistit ja tulehduskipulääkkeet. Harkitse seerumin kaliumpitoisuuden seurantaa suuren riskin potilailla, jotka käyttävät vahvaa CYP3A4-estäjää pitkään ja samanaikaisesti. Vahvoja CYP3A4:n estäjiä ovat atsoli-sienilääkkeet (esim. ketokonatsoli, itrakonatsoli, vorikonatsoli), HIV/HCV-proteaasin estäjät (esim. indinaviiri, bosepreviiri) ja klaritromysiini [ks. KLIININEN FARMAKOLOGIA ].
Rintojen ja sukuelinten karsinooma
Naiset, joilla on tai on ollut rintasyöpä, eivät saa käyttää Yasminia, koska rintasyöpä on hormonaalisesti herkkä kasvain.
On olemassa merkittävää näyttöä siitä, että yhdistelmäehkäisytabletit eivät lisää rintasyövän ilmaantuvuutta. Vaikka jotkin aiemmat tutkimukset ovat osoittaneet, että yhdistelmäehkäisytabletit saattavat lisätä rintasyövän ilmaantuvuutta, uudemmat tutkimukset eivät ole vahvistaneet tällaisia löydöksiä.
Jotkut tutkimukset viittaavat siihen, että yhdistelmäehkäisytablettien käyttö lisää kohdunkaulasyövän tai intraepiteliaalisen neoplasian riskiä. On kuitenkin kiistaa siitä, missä määrin nämä havainnot voivat johtua eroista seksuaalisessa käyttäytymisessä ja muista tekijöistä.
Maksasairaus
Lopeta Yasmin-hoito, jos keltaisuutta kehittyy. Steroidihormonit saattavat metaboloitua heikosti potilailla, joilla on maksan vajaatoiminta. Akuutit tai krooniset maksan toimintahäiriöt voivat edellyttää yhdistelmäehkäisytablettien käytön lopettamista, kunnes maksan toiminnan merkkiaineet palaavat normaaleiksi ja yhdistelmäehkäisytablettien syy-yhteys on suljettu pois.
Maksaadenoomit liittyvät yhdistelmäehkäisytablettien käyttöön. Arviolta johtuva riski on 3,3 tapausta/100 000 yhdistelmäehkäisytablettien käyttäjää. Maksaadenoomien repeämä voi aiheuttaa kuoleman vatsansisäisen verenvuodon seurauksena.
Tutkimukset ovat osoittaneet lisääntynyttä hepatosellulaarisen karsinooman riskiä pitkäaikaisilla (> 8-vuotiailla) yhdistelmäehkäisytablettien käyttäjillä. Kuitenkin yhdistelmäehkäisytablettien käyttäjien maksasyövän riski on alle yksi tapaus miljoonaa käyttäjää kohden.
Ehkäisyvalmisteeseen liittyvää kolestaasia voi esiintyä naisilla, joilla on aiemmin ollut raskauteen liittyvää kolestaasi. Naisilla, joilla on ollut yhdistelmäehkäisytablettien aiheuttamaa kolestaasi, tila voi uusiutua myöhemmän yhdistelmäehkäisytablettien käytön yhteydessä.
Korkea verenpaine
Naisille, joilla on hyvin hallinnassa oleva verenpaine, tarkkaile verenpainetta ja lopeta Yasmin 0,03 mg:n käyttö, jos verenpaine nousee merkittävästi. Naisten, joilla on hallitsematon verenpainetauti tai verenpainetauti, jolla on verisuonisairaus, ei tule käyttää yhdistelmäehkäisytabletteja.
Verenpaineen nousua on raportoitu yhdistelmäehkäisytabletteja käyttävillä naisilla, ja tämä nousu on todennäköisempää iäkkäillä naisilla ja pitkäaikaisen käytön aikana. Verenpainetaudin ilmaantuvuus lisääntyy progestiinipitoisuuden kasvaessa.
Sappirakon sairaus
Tutkimukset viittaavat hieman lisääntyneeseen suhteelliseen riskiin sairastua sappirakkosairauksiin yhdistelmäehkäisytablettien käyttäjillä.
Hiilihydraattien ja lipidien metaboliset vaikutukset
Seuraa huolellisesti prediabeettisia ja diabeettisia naisia, jotka käyttävät Yasminia. COC:t voivat heikentää glukoosinsietokykyä annoksen mukaan.
Harkitse vaihtoehtoista ehkäisyä naisille, joilla on hallitsematon dyslipidemia. Pienellä osalla naisista esiintyy haitallisia lipidimuutoksia yhdistelmäehkäisytablettien aikana.
Naisilla, joilla on hypertriglyseridemia tai suvussa sitä on esiintynyt, voi olla lisääntynyt haimatulehduksen riski yhdistelmäehkäisytablettien käytön aikana.
Päänsärky
Jos Yasmin 0,03 mg -valmistetta käyttävälle naiselle kehittyy uusia, toistuvia, jatkuvia tai vakavia päänsärkyä, arvioi syy ja keskeytä Yasmin 3 mg -valmisteen käyttö tarvittaessa.
Migreenin yleistyminen tai vaikeusaste yhdistelmäehkäisytablettien käytön aikana (joka voi olla aivoverisuonitapahtuman esiaste) voi olla syy yhdistelmäehkäisytablettien käytön välittömään lopettamiseen.
Verenvuotohäiriöt
Suunnittelematonta (läpäisy- tai intrasyklistä) verenvuotoa ja tiputtelua esiintyy joskus yhdistelmäehkäisytabletteja käyttävillä potilailla, erityisesti kolmen ensimmäisen käyttökuukauden aikana. Jos verenvuoto jatkuu tai ilmaantuu aiemmin säännöllisten syklien jälkeen, tarkista syyt, kuten raskaus tai pahanlaatuisuus. Jos patologia ja raskaus suljetaan pois, verenvuotohäiriöt voivat hävitä ajan myötä tai vaihtamalla yhdistelmäehkäisytabletteja.
Tiedot kymmenestä ehkäisytehoa koskevasta kliinisestä tutkimuksesta (N=2 467) osoittavat, että Yasminia käyttäneiden naisten prosenttiosuus, jotka kokivat odottamatonta verenvuotoa, laski ajan myötä 12 prosentista 2. syklissä 6 prosenttiin (sykli 13). Yhteensä 24 henkilöä 2 837:stä Yasmin-tutkimuksissa (
Suunniteltujen verenvuotojaksojen keskimääräinen kesto suurimmalla osalla koehenkilöistä (86–88 %) oli 4–7 päivää. Naiset, jotka käyttävät Yasmin 3 mg:aa, saattavat kokea vieroitusverenvuotoa, vaikka he eivät olisi raskaana. Ehkäisytehoa koskevista tutkimuksista saatujen koehenkilöiden päiväkirjojen perusteella syklien 2–13 aikana 1–11 % naisista sykliä kohden ei kokenut vieroitusvuotoa. Jotkut naiset voivat kohdata pillereiden jälkeistä amenorreaa tai oligomenorreaa, varsinkin kun tällainen tila on ollut olemassa.
Jos vieroitusvuotoa ei esiinny, harkitse raskauden mahdollisuutta. Jos potilas ei ole noudattanut määrättyä annosteluaikataulua (jäänyt väliin yhden tai useamman vaikuttavan tabletin tai aloittanut niiden ottamisen päivää myöhemmin kuin olisi pitänyt), harkitse raskauden mahdollisuutta ensimmäisten kuukautisten väliin jäämisen yhteydessä ja ryhdy asianmukaisiin diagnostisiin toimenpiteisiin. . Jos potilas on noudattanut määrättyä hoito-ohjelmaa ja häneltä jää kaksi peräkkäistä kuukautisia, sulje pois raskaus.
COC:n käyttö ennen raskautta tai sen aikana
Laajat epidemiologiset tutkimukset eivät ole osoittaneet lisääntynyttä synnynnäisten epämuodostumien riskiä naisilla, jotka ovat käyttäneet ehkäisyä ennen raskautta. Tutkimukset eivät myöskään viittaa teratogeeniseen vaikutukseen, kun yhdistelmäehkäisytabletteja otetaan vahingossa raskauden alkuvaiheessa, etenkään mitä tulee sydämen poikkeavuuksiin ja raajojen supistumishäiriöihin.
Oraalisten ehkäisyvalmisteiden antamista vieroitusverenvuodon aiheuttamiseksi ei tule käyttää raskaustestinä [ks. Käyttö tietyissä populaatioissa ].
Masennus
Naisia, joilla on ollut masennusta, tulee tarkkailla huolellisesti, ja Yasmin-hoito on lopetettava, jos masennus uusiutuu vakavasti.
Häiriö laboratoriotutkimuksiin
Yhdistelmäehkäisytablettien käyttö saattaa muuttaa joidenkin laboratoriotutkimusten tuloksia, kuten hyytymistekijöitä, lipidejä, glukoosinsietokykyä ja sitoutuvia proteiineja. Kilpirauhashormonikorvaushoitoa saavat naiset saattavat tarvita suurempia kilpirauhashormoniannoksia, koska kilpirauhasta sitovan globuliinin pitoisuudet seerumissa suurenevat yhdistelmäehkäisytablettien käytön myötä [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
DRSP aiheuttaa plasman reniiniaktiivisuuden ja plasman aldosteronin lisääntymisen sen lievän antimineralokortikoidiaktiivisuuden indusoimana.
Valvonta
yhdistelmäehkäisytabletteja käyttävän naisen tulee käydä vuosittain terveydenhuollon tarjoajansa luona verenpaineen mittausta ja muuta tarpeellista terveydenhuoltoa varten.
Muut edellytykset
Naisilla, joilla on perinnöllinen angioödeema, eksogeeniset estrogeenit voivat aiheuttaa tai pahentaa angioedeeman oireita. Chloasma saattaa joskus ilmaantua, erityisesti naisilla, joilla on ollut chloasma gravidarum. Naisten, joilla on taipumusta kloasmaan, tulee välttää altistumista auringolle tai ultraviolettisäteilylle yhdistelmäehkäisytablettien käytön aikana.
Potilasneuvontatiedot
Katso "FDA:n hyväksymä potilasmerkintä ( POTILASTIEDOT ).”
- Neuvo potilaita, että tupakointi lisää yhdistelmäehkäisytablettien käytön aiheuttamien vakavien sydän- ja verisuonitapahtumien riskiä ja että yli 35-vuotiaat ja tupakoivat naiset eivät saa käyttää yhdistelmäehkäisytabletteja.
- Neuvo potilaita, että kohonnut laskimotromboemboliariski verrattuna yhdistelmäehkäisytablettien käyttäjiin on suurin yhdistelmäehkäisytablettien käytön aloittamisen tai uudelleen aloittamisen (4 viikon tai pidemmän pilleritauon jälkeen) saman tai toisen yhdistelmäehkäisytablettien käytön jälkeen.
- Neuvo potilaita tiedoista laskimotromboembolian riskistä DRSP:tä sisältävien yhdistelmäehkäisytablettien kanssa verrattuna levonorgestreelia tai joitain muita progestiineja sisältäviin yhdistelmäehkäisytabletteihin.
- Neuvo potilaita, että Yasmin ei suojaa HIV-infektiolta (AIDS) ja muilta sukupuolitaudeilta.
- Neuvo potilaita VAROITUKSET JA VAROTOIMET yhdistelmäehkäisytablettien kanssa.
- Kerro potilaille, että Yasmin 3mg sisältää DRSP:tä. Drospirenoni voi lisätä kaliumia. Potilaita tulee neuvoa ilmoittamaan terveydenhuollon tarjoajalleen, jos heillä on munuais-, maksa- tai lisämunuaissairaus, koska Yasminin käyttö näiden sairauksien yhteydessä voi aiheuttaa vakavia sydän- ja terveysongelmia. Heidän tulee myös kertoa terveydenhuollon tarjoajalle, jos he ovat parhaillaan päivittäisessä pitkäaikaisessa hoidossa (NSAID:t, kaliumia säästävät diureetit, kaliumlisähoito, ACE:n estäjät, angiotensiini-II-reseptorin salpaajat, hepariini tai aldosteroniantagonistit) krooniseen sairauteen tai voimakkaaseen hoitoon. CYP3A4:n estäjät.
- Kerro potilaille, että Yasmin 0,03 mg ei ole tarkoitettu raskauden aikana. Jos raskaus tulee Yasmin 3 mg -hoidon aikana, neuvo potilasta lopettamaan lääkkeen käyttö.
- Neuvo potilaita ottamaan yksi tabletti päivässä suun kautta samaan aikaan joka päivä. Kerro potilaille, mitä tehdä, jos pillerit jäävät ottamatta. Katso "Mitä tehdä, jos unohdat ottaa pillerit" jakso sisään FDA:n hyväksymä potilasmerkintä.
- Neuvo potilaita käyttämään vara- tai vaihtoehtoista ehkäisymenetelmää, kun entsyymi-induktoreita käytetään yhdistelmäehkäisytablettien kanssa.
- Neuvo imettäville tai imetystä haluaville potilaille, että yhdistelmäehkäisytabletit voivat vähentää rintamaidon tuotantoa. Tämä on vähemmän todennäköistä, jos imetys on vakiintunut.
- Neuvo jokaista potilasta, joka aloittaa yhdistelmäehkäisytablettien käytön synnytyksen jälkeen ja jolla ei ole vielä kuukautisia, käyttämään lisäehkäisymenetelmää, kunnes hän on ottanut keltaisen tabletin 7 peräkkäisenä päivänä.
- Neuvo potilaita, että amenorrea voi ilmaantua. Sulje pois raskaus, jos kuukautisia esiintyy kahdessa tai useammassa peräkkäisessä jaksossa.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
24 kuukauden karsinogeenisuustutkimuksessa hiirillä, joille annettiin 10 mg/kg/vrk pelkkä DRSP tai 1 + 0,01, 3 + 0,03 ja 10 + 0,1 mg/kg/vrk DRSP:tä ja EE:tä, 0,1-2 kertaa altistus (AUC DRSP) ehkäisyannosta käyttävien naisten kovettunut rauhanen karsinoomien määrä lisääntyi ryhmässä, joka sai suuren annoksen DRSP:tä yksinään. Samanlaisessa tutkimuksessa rotilla, joille annettiin 10 mg/kg/vrk DRSP:tä yksinään tai 0,3 + 0,003, 3 + 0,03 ja 10 + 0,1 mg/kg/vrk DRSP:tä ja EE:tä, 0,8-10 kertaa ehkäisyannosta saaneiden naisten altistus. oli lisämunuaisen hyvänlaatuisten ja kokonaisten (hyvänlaatuisten ja pahanlaatuisten) feokromosytoomien lisääntynyt esiintyvyys ryhmässä, joka sai suuren annoksen DRSP:tä. DRSP:n mutageneesitutkimukset suoritettiin in vivo ja in vitro, eikä näyttöä mutageenisesta aktiivisuudesta havaittu.
Käyttö tietyissä populaatioissa
Raskaus
Synnynnäisten epämuodostumien riski on vähäinen tai ei ollenkaan lisääntynyt naisilla, jotka vahingossa käyttävät yhdistelmäehkäisytabletteja raskauden alkuvaiheessa. Epidemiologiset tutkimukset ja meta-analyysit eivät ole havainneet lisääntynyttä sukupuolielinten tai ei-sukupuolielinten synnynnäisten epämuodostumien riskiä (mukaan lukien sydämen poikkeavuudet ja raajojen supistumishäiriöt) pieniannoksisille yhdistelmäehkäisytableteille altistumisen jälkeen ennen hedelmöitystä tai raskauden alkuvaiheessa.
Yhdistelmäehkäisytablettien antamista vieroitusverenvuodon aiheuttamiseksi ei tule käyttää raskaustestinä. Yhdistelmäehkäisytabletteja ei tule käyttää raskauden aikana uhkaavan tai tavanomaisen abortin hoitoon.
Naiset, jotka eivät imetä, voivat aloittaa yhdistelmäehkäisytablettien käytön aikaisintaan neljä viikkoa synnytyksen jälkeen.
Imettävät äidit
Mikäli mahdollista, kehota imettävää äitiä käyttämään muita ehkäisymenetelmiä, kunnes hän on vieroittanut lapsensa. Estrogeenia sisältävät yhdistelmäehkäisytabletit voivat vähentää maidontuotantoa imettävillä äideillä. Tämä on vähemmän todennäköistä, kun imetys on vakiintunut; Joillakin naisilla se voi kuitenkin ilmaantua milloin tahansa. Pieniä määriä oraalisia ehkäisyvalmisteita steroideja ja/tai metaboliitteja erittyy äidinmaitoon.
Suun kautta annetun Yasmin 0,03 mg:n jälkeen noin 0,02 % DRSP-annoksesta erittyi synnytyksen jälkeen syntyneiden naisten rintamaitoon 24 tunnin kuluessa. Tämä johtaa maksimaaliseen päivittäiseen annokseen, joka on noin 0,003 mg DRSP:tä pikkulapsella.
Käyttö lapsille
Yasminin turvallisuus ja teho on osoitettu lisääntymisikäisillä naisilla. Tehon odotetaan olevan sama alle 18-vuotiailla murrosikäisillä nuorilla ja 18-vuotiailla ja sitä vanhemmilla käyttäjillä. Tämän tuotteen käyttöä ennen kuukautisia ei ole tarkoitettu.
Geriatrinen käyttö
Yasminia ei ole tutkittu postmenopausaalisilla naisilla, eikä sitä ole tarkoitettu tälle populaatiolle.
Potilaat, joilla on munuaisten vajaatoiminta
Yasmin 0,03 mg on vasta-aiheinen potilailla, joilla on munuaisten vajaatoiminta [katso VASTA-AIHEET ja VAROITUKSET JA VAROTOIMET ].
Koehenkilöillä, joiden kreatiniinipuhdistuma (CLcr) oli 50–79 ml/min, seerumin DRSP-konsentraatiot olivat verrattavissa vertailuryhmään, jonka CLcr oli ≥ 80 ml/min. Koehenkilöillä, joiden CLcr oli 30–49 ml/min, seerumin DRSP-pitoisuudet olivat keskimäärin 37 % korkeammat kuin kontrolliryhmässä. Lisäksi on mahdollista kehittyä hyperkalemia potilailla, joilla on munuaisten vajaatoiminta ja joiden seerumin kaliumpitoisuus on ylemmän vertailualueen sisällä ja jotka käyttävät samanaikaisesti kaliumia säästäviä lääkkeitä [ks. KLIININEN FARMAKOLOGIA ].
Potilaat, joilla on maksan vajaatoiminta
Yasmin on vasta-aiheinen potilailla, joilla on maksasairaus [katso VASTA-AIHEET ja VAROITUKSET JA VAROTOIMET ]. Keskimääräinen altistuminen DRSP:lle naisilla, joilla on kohtalainen maksan vajaatoiminta, on noin kolme kertaa suurempi kuin altistus naisilla, joilla on normaali maksan toiminta. Yasminia ei ole tutkittu naisilla, joilla on vaikea maksan vajaatoiminta.
Rotu
Kliinisesti merkitsevää eroa ei havaittu DRSP:n tai EE:n farmakokinetiikan välillä japanilaisilla ja valkoihoisilla naisilla [ks. KLIININEN FARMAKOLOGIA ].
VIITTEET
1. Seeger, JD, Loughlin, J., Eng, PM, Clifford, CR, Cutone, J. ja Walker, AM (2007). Tromboembolian riski naisilla, jotka käyttävät etinyyliestradiolia/drospirenonia ja muita suun kautta otettavia ehkäisyvalmisteita. Obstet Gynecol 110, 587-593.
2. Dinger, JC, Heinemann, LA ja Kuhl-Habich, D. (2007). Drospirenonia sisältävän oraalisen ehkäisyvalmisteen turvallisuus: lopulliset tulokset eurooppalaisesta aktiivisen seurantatutkimuksen oraalisista ehkäisyvalmisteista, jotka perustuvat 142 475 naisvuoden seurantaan. Ehkäisy 75, 344-354.
3. Yhdistetyt hormonaaliset ehkäisyvalmisteet (CHC) ja kardiovaskulaaristen päätepisteiden riski. Sidney, S. (ensisijainen kirjoittaja) http://www.fda.gov/downloads/Drugs/DrugSafety/UCM277384.pdf, käytetty 27. lokakuuta 2011.
4. Lidegaard, O., Lokkegaard, E., Svendsen, AL ja Agger, C. (2009). Hormonaalinen ehkäisy ja laskimotromboembolian riski: kansallinen seurantatutkimus. BMJ 339, b2890.
5. Lidegaard, O., Nielsen, LH, Skovlund, CW, Skjeldestad, FE ja Lokkegaard, E. (2011). Laskimotromboembolian riski erilaisia progestogeeneja ja estrogeeniannoksia sisältävien oraalisten ehkäisyvalmisteiden käytöstä: Tanskalainen kohorttitutkimus, 2001-9. BMJ 343, d6423.
6. van Hylckama Vlieg, A., Helmerhorst, FM, Vandenbroucke, JP, Doggen, CJ ja Rosendaal, FR (2009). Suun kautta otettavien ehkäisyvalmisteiden laskimotukosriski, estrogeeniannoksen vaikutukset ja progestiinityyppi: MEGA-tapauskontrollitutkimuksen tulokset. BMJ 339, b2921.
7. Dinger, J., Assmann, A., Mohner, S. ja Minh, TD (2010). Laskimotromboembolian riski ja dienogestia ja drospirenonia sisältävien oraalisten ehkäisyvalmisteiden käyttö: tulokset saksalaisesta tapauskontrollitutkimuksesta. J Fam Plann Reprod Health Care 36, 123-129.
8. Jick, SS, ja Hernandez, RK (2011). Ei-kuolemaan johtavan laskimotromboembolian riski naisilla, jotka käyttävät drospirenonia sisältäviä oraalisia ehkäisyvalmisteita, verrattuna naisiin, jotka käyttävät levonorgestreeliä sisältäviä ehkäisyvalmisteita: tapauskontrollitutkimus, jossa käytettiin Yhdysvaltojen väitetietoja. BMJ 342, d2151.
9. Parkin, L., Sharples, K., Hernandez, RK ja Jick, SS (2011). Laskimotromboembolian riski drospirenonia tai levonorgestreeliä sisältävien oraalisten ehkäisyvalmisteiden käyttäjillä: sisäkkäinen tapauskontrollitutkimus, joka perustuu UK General Practice Research -tietokantaan. BMJ 342, d2139.
YLIANNOSTUS
Yliannostuksen vakavista haittavaikutuksista, mukaan lukien lasten nieleminen, ei ole raportoitu. Yliannostus voi aiheuttaa vieroitusverenvuotoa naisilla ja pahoinvointia.
DRSP on spironolaktonianalogi, jolla on antimineralokortikoidiominaisuuksia. Seerumin kalium- ja natriumpitoisuutta sekä merkkejä metabolisesta asidoosista tulee seurata yliannostustapauksissa.
VASTA-AIHEET
Älä määrää Yasmin 3mg -valmistetta naisille, joilla tiedetään olevan seuraavat:
- Munuaisten vajaatoiminta
- Lisämunuaisen vajaatoiminta
- Suuri valtimo- tai laskimotromboottisten sairauksien riski. Esimerkkejä ovat naiset, joiden tiedetään:
- Tupakoida, jos yli 35-vuotias [katso LAATIKKO VAROITUS ja VAROITUKSET JA VAROTOIMET ]
- Onko sinulla syvä laskimotromboosi tai keuhkoembolia, nyt tai aiemmin [katso VAROITUKSET JA VAROTOIMET ]
- Onko sinulla aivoverenkiertohäiriö [katso VAROITUKSET JA VAROTOIMET ]
- Onko sinulla sepelvaltimotauti [katso VAROITUKSET JA VAROTOIMET ]
- Onko sinulla trombogeenisiä läppä- tai trombogeenisia sydämen rytmisairauksia (esimerkiksi subakuutti bakteeriperäinen endokardiitti läppäsairauteen tai eteisvärinä) [ks. VAROITUKSET JA VAROTOIMET ]
- Onko sinulla perinnöllisiä tai hankittuja hyperkoagulopatioita [katso VAROITUKSET JA VAROTOIMET ]
- Sinulla on hallitsematon hypertensio [katso VAROITUKSET JA VAROTOIMET ]
- Onko sinulla diabetes mellitus ja verisuonisairaus [katso VAROITUKSET JA VAROTOIMET ]
- Sinulla on päänsärkyä, johon liittyy fokaalisia neurologisia oireita, tai sinulla on migreenipäänsärkyä auralla tai ilman, jos olet yli 35-vuotias [ks. VAROITUKSET JA VAROTOIMET ]
- Diagnosoimaton epänormaali kohdun verenvuoto [katso VAROITUKSET JA VAROTOIMET ]
- Rintasyöpä tai muu estrogeenille tai progestiinille herkkä syöpä, nyt tai aiemmin [katso VAROITUKSET JA VAROTOIMET ]
- Maksakasvain (hyvänlaatuinen tai pahanlaatuinen) tai maksasairaus [katso VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ]
- Raskaus, koska ei ole syytä käyttää yhdistelmäehkäisytabletteja raskauden aikana [katso VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ]
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Yhdistelmätabletit vähentävät raskaaksi tulemisen riskiä ensisijaisesti estämällä ovulaation. Muita mahdollisia mekanismeja voivat olla kohdunkaulan liman muutokset, jotka estävät siittiöiden tunkeutumista ja endometriumin muutokset, jotka vähentävät implantaation todennäköisyyttä.
Farmakodynamiikka
Drospirenoni on spironolaktonianalogi, jolla on antimineralokortikoidivaikutus. Yasminin estrogeeni on etinyyliestradioli (EE).
Yasminilla ei tehty erityisiä farmakodynaamisia tutkimuksia.
Farmakokinetiikka
Imeytyminen
DRSP:n absoluuttinen biologinen hyötyosuus yhdestä tabletista on noin 76 %. EE:n absoluuttinen biologinen hyötyosuus on noin 40 % presysteemisen konjugaation ja ensikierron metabolian seurauksena. Yasmin 3 mg:n, joka on DRSP:n ja EE:n yhdistelmätabletti, absoluuttista biologista hyötyosuutta ei ole arvioitu. Seerumin DRSP- ja EE-pitoisuudet saavuttivat huipputason 1-2 tunnin kuluessa Yasminin annon jälkeen.
DRSP:n farmakokinetiikka on suhteessa annokseen 1-10 mg:n kerta-annosten jälkeen. Yasminin päivittäisen annostelun jälkeen vakaan tilan DRSP-pitoisuudet havaittiin 8 päivän kuluttua. DRSP:n seerumin Cmax- ja AUC-arvot (0-24h) kumuloituivat noin 2–3-kertaisesti Yasminin toistuvan annon jälkeen (katso taulukko 2).
EE:n osalta vakaan tilan tilat raportoidaan hoitosyklin toisella puoliskolla. Päivittäisen Yasmin- seerumin annon jälkeen EE:n Cmax- ja AUC (0-24h) -arvot kumuloituvat noin 1,5-2-kertaisesti (katso taulukko 2).
Ruoan vaikutus
DRSP:n ja EE:n imeytymisnopeus Yasminin kaltaisen formulaation kerta-annoksen jälkeen oli hitaampi ruokailuolosuhteissa (runsaasti rasvainen ateria) ja seerumin Cmax pieneni noin 40 % molemmilla komponenteilla. DRSP:n imeytymisaste pysyi kuitenkin ennallaan. Sitä vastoin EE:n absorption määrä väheni noin 20 % ruokailuolosuhteissa.

Jakelu
Seerumin DRSP- ja EE-pitoisuudet laskevat kahdessa vaiheessa. DRSP:n näennäinen jakautumistilavuus on noin 4 l/kg ja EE:n noin 4–5 l/kg.
DRSP ei sitoudu sukupuolihormoneja sitovaan globuliiniin (SHBG) tai kortikosteroideja sitovaan globuliiniin (CBG), mutta se sitoutuu noin 97 % muihin seerumin proteiineihin. Usein annostelu 3 syklin aikana ei aiheuttanut muutosta vapaassa fraktiossa (mitattuna pienimmillä pitoisuuksilla). EE:n on raportoitu sitoutuvan voimakkaasti, mutta epäspesifisesti seerumin albumiiniin (noin 98,5 %) ja se indusoi sekä SHBG- että CBG-pitoisuuksia seerumissa. EE:n aiheuttamiin vaikutuksiin SHBG:hen ja CBG:hen ei vaikuttanut DRSP-annoksen vaihtelu välillä 2-3 mg.
Aineenvaihdunta
Ihmisen plasmassa löydettyjen DRSP:n kahden päämetaboliitin tunnistettiin olevan DRSP:n happomuoto, joka muodostuu laktonirenkaan avaamisesta ja 4,5-dihydrodrospirenoni-3-sulfaatti, joka muodostuu pelkistymisen ja myöhemmän sulfaation seurauksena.
Näiden metaboliittien ei osoitettu olevan farmakologisesti aktiivisia. Drospirenoni on myös alttiina oksidatiiviselle metabolialle, jota katalysoi CYP3A4.
EE:n on raportoitu olevan alttiina merkittävälle suoliston ja maksan ensikierron metabolialle. EE:n ja sen oksidatiivisten metaboliittien metabolia tapahtuu pääasiassa konjugoimalla glukuronidin tai sulfaatin kanssa. CYP3A4 maksassa on vastuussa 2-hydroksylaatiosta, joka on tärkein oksidatiivinen reaktio. 2-hydroksimetaboliitti muuttuu edelleen metylaatiolla ja glukuronidaatiolla ennen kuin se erittyy virtsaan ja ulosteeseen.
Erittyminen
Seerumin DRSP-pitoisuuksille on tunnusomaista terminaalinen dispositiovaiheen puoliintumisaika, joka on noin 30 tuntia sekä kerta- että useiden annosten jälkeen. DRSP:n erittyminen oli lähes täydellinen kymmenen päivän kuluttua ja erittyneet määrät olivat hieman suuremmat ulosteessa kuin virtsassa. DRSP metaboloitui laajalti ja vain pieniä määriä muuttumatonta DRSP:tä erittyi virtsaan ja ulosteisiin. Virtsassa ja ulosteissa havaittiin ainakin 20 erilaista metaboliittia. Noin 38–47 % virtsan metaboliiteista oli glukuronidi- ja sulfaattikonjugaatteja. Noin 17-20 % metaboliiteista erittyi ulosteeseen glukuronideina ja sulfaatteina.
EE:n terminaalisen jakautumisvaiheen puoliintumisajan on raportoitu olevan noin 24 tuntia. EE ei erity muuttumattomana. EE erittyy virtsaan ja ulosteisiin glukuronidin ja sulfaatin konjugaatteihin ja käy läpi enterohepaattisen verenkierron.
Käyttö tietyissä populaatioissa
Käyttö lapsille: Yasmin 0,03 mg:n turvallisuus ja teho on osoitettu lisääntymisikäisillä naisilla. Tehon odotetaan olevan sama alle 18-vuotiailla murrosikäisillä nuorilla ja 18-vuotiailla ja sitä vanhemmilla käyttäjillä. Tämän tuotteen käyttöä ennen kuukautisia ei ole tarkoitettu.
Geriatrinen käyttö: Yasminia ei ole tutkittu postmenopausaalisilla naisilla, eikä sitä ole tarkoitettu tälle populaatiolle.
Rotu: Kliinisesti merkitsevää eroa ei havaittu DRSP:n tai EE:n farmakokinetiikassa japanilaisilla ja valkoihoisilla naisilla (25–35-vuotiaat), kun 3 mg DRSP:tä/0,02 mg EE:tä annettiin päivittäin 21 päivän ajan. Muita etnisiä ryhmiä ei ole erityisesti tutkittu.
Munuaisten vajaatoiminta: Yasmin on vasta-aiheinen potilailla, joilla on munuaisten vajaatoiminta.
Munuaisten vajaatoiminnan vaikutusta DRSP:n (3 mg päivässä 14 päivän ajan) farmakokinetiikkaan ja DRSP:n vaikutusta seerumin kaliumpitoisuuksiin tutkittiin kolmessa erillisessä naishenkilöryhmässä (n=28, ikä 30-65). Kaikki koehenkilöt olivat vähäkaliumia sisältävällä ruokavaliolla. Tutkimuksen aikana 7 henkilöä jatkoi kaliumia säästävien lääkkeiden käyttöä perussairautensa hoidossa. DRSP-hoidon 14. päivänä (steady-state) seerumin DRSP-pitoisuudet ryhmässä, jonka CLcr oli 50–79 ml/min, olivat verrattavissa vertailuryhmään, jonka CLcr oli ≥ 80 ml/min. Seerumin DRSP-pitoisuudet olivat keskimäärin 37 % korkeammat ryhmässä, jonka CLcr oli 30–49 ml/min verrattuna kontrolliryhmään. DRSP-hoidolla ei havaittu kliinisesti merkittävää vaikutusta seerumin kaliumpitoisuuteen. Vaikka hyperkalemiaa ei havaittu tutkimuksessa, viidellä seitsemästä koehenkilöstä, jotka jatkoivat kaliumia säästävien lääkkeiden käyttöä tutkimuksen aikana, seerumin kaliumpitoisuudet nousivat jopa 0,33 mEq/l. [Katso VASTA-AIHEET ja VAROITUKSET JA VAROTOIMET ]
Maksan vajaatoiminta: Yasmin 0,03 mg on vasta-aiheinen potilailla, joilla on maksasairaus.
Keskimääräinen altistuminen DRSP:lle naisilla, joilla on kohtalainen maksan vajaatoiminta, on noin kolme kertaa suurempi kuin altistus naisilla, joilla on normaali maksan toiminta. Yasminia ei ole tutkittu naisilla, joilla on vaikea maksan vajaatoiminta. [Katso VASTA-AIHEET ja VAROITUKSET JA VAROTOIMET ]
Huumeiden vuorovaikutukset
Katso kaikkien samanaikaisesti käytettyjen lääkkeiden merkinnöistä lisätietoja interaktioista oraalisten ehkäisyvalmisteiden kanssa tai mahdollisista entsyymimuutoksista.
Muiden lääkkeiden vaikutukset yhdistelmäehkäisyvalmisteisiin
Aineet, jotka heikentävät yhdistelmäehkäisytablettien tehoa: Lääkkeet tai kasviperäiset tuotteet, jotka indusoivat tiettyjä entsyymejä, mukaan lukien CYP3A4, voivat heikentää yhdistelmäehkäisytablettien tehoa tai lisätä läpäisyvuotoa.
Aineet, jotka lisäävät yhdistelmäehkäisytablettien pitoisuutta plasmassa: Atorvastatiinin ja tiettyjen EE:tä sisältävien yhdistelmäehkäisytablettien samanaikainen käyttö lisää EE:n AUC-arvoja noin 20 %. Askorbiinihappo ja asetaminofeeni voivat lisätä plasman EE-pitoisuuksia, mahdollisesti estämällä konjugaatiota. Kliinisessä lääkkeiden yhteisvaikutustutkimuksessa, joka tehtiin 20 premenopausaalisella naisella, DRSP (3 mg)/EE (0,02 mg) COC:n ja vahvan CYP3A4-estäjän ketokonatsolin (200 mg kahdesti vuorokaudessa) samanaikainen anto 10 päivän ajan suurensi AUC 0-24 h) DRSP:tä ja EE:tä 2,68-kertaisesti (90 % CI: 2,44, 2,95) ja 1,40-kertaisesti (90 % CI: 1,31, 1,49). Cmax-arvon nousu oli 1,97-kertainen (90 % CI: 1,79, 2,17) ja 1,39-kertainen (90 % CI: 1,28, 1,52) DRSP:n ja EE:n osalta. Vaikka kliinisesti merkittäviä vaikutuksia turvallisuuteen tai laboratorioparametreihin, mukaan lukien seerumin kalium, ei havaittu, tässä tutkimuksessa arvioitiin koehenkilöitä vain 10 päivän ajan. Kliinistä vaikutusta potilaaseen, joka käyttää DRSP:tä sisältävää yhdistelmäehkäisytabletteja samanaikaisesti CYP3A4/5-estäjän kroonisen käytön kanssa, ei tunneta [ks. VAROITUKSET JA VAROTOIMET ].
HIV/HCV-proteaasin estäjät ja ei-nukleosidikäänteiskopioijaentsyymin estäjät: Merkittäviä muutoksia (nousua tai laskua) plasman estrogeeni- ja progestiinin pitoisuuksissa on havaittu joissakin tapauksissa, kun niitä on annettu samanaikaisesti HIV/HCV-proteaasiestäjien tai muiden kuin nukleosidisten käänteiskopioijaentsyymin estäjien kanssa.
Antibiootit: Raskautta on raportoitu hormonaalisten ehkäisyvalmisteiden ja antibioottien käytön aikana, mutta kliiniset farmakokineettiset tutkimukset eivät ole osoittaneet antibioottien johdonmukaisia vaikutuksia plasman synteettisten steroidien pitoisuuksiin.
Oraalisten yhdistelmäehkäisyvalmisteiden vaikutukset muihin lääkkeisiin
EE:tä sisältävät yhdistelmäehkäisytabletit voivat estää muiden yhdisteiden metaboliaa. Yhdistelmäehkäisytablettien on osoitettu vähentävän merkittävästi plasman lamotrigiinipitoisuuksia, mikä johtuu todennäköisesti lamotrigiinin glukuronidaation induktiosta. Tämä voi heikentää kohtausten hallintaa; siksi lamotrigiinin annoksen muuttaminen saattaa olla tarpeen. Katso samanaikaisesti käytetyn lääkkeen merkinnöistä lisätietoja yhteisvaikutuksista yhdistelmäehkäisytablettien kanssa tai mahdollisista entsyymimuutosten mahdollisista muutoksista.
In vitro EE on CYP2C19:n, CYP1A1:n ja CYP1A2:n palautuva estäjä sekä CYP3A4/5:n, CYP2C8:n ja CYP2J2:n mekanismiin perustuva estäjä. DRSP:n metaboliaa ja DRSP:n mahdollisia vaikutuksia maksan CYP-entsyymeihin on tutkittu in vitro ja in vivo -tutkimuksissa. In vitro -tutkimuksissa DRSP ei vaikuttanut CYP1A2- ja CYP2D6-mallisubstraattien vaihtumiseen, mutta sillä oli estävä vaikutus CYP1A1-, CYP2C9-, CYP2C19- ja CYP3A4-mallisubstraattien kiertoon, ja CYP2C19 oli herkin entsyymi. DRSP:n mahdollista vaikutusta CYP2C19-aktiivisuuteen tutkittiin kliinisessä farmakokineettisessä tutkimuksessa, jossa käytettiin omepratsolia merkkiainesubstraattina. Tutkimuksessa, johon osallistui 24 postmenopausaalista naista [mukaan lukien 12 naista, joilla oli homotsygoottinen (villityyppi) CYP2C19-genotyyppi ja 12 naista, joilla oli heterotsygoottinen CYP2C19-genotyyppi], 3 mg:n DRSP:n päivittäinen antaminen suun kautta 14 päivän ajan ei vaikuttanut omepratsolin (40 mg, kerta-annos suun kautta) ja CYP2C19-tuote 5-hydroksiomepratsoli. Lisäksi DRSP:llä ei havaittu merkittävää vaikutusta CYP3A4-tuotteen omepratsolisulfonin systeemiseen puhdistumaan. Nämä tulokset osoittavat, että DRSP ei estänyt CYP2C19:ää ja CYP3A4:ää in vivo.
Kaksi muuta kliinistä lääkeaineiden yhteisvaikutustutkimusta, joissa käytettiin simvastatiinia ja midatsolaamia CYP3A4:n merkkiaineina, suoritettiin kumpikin 24 terveellä postmenopausaalisella naisella. Näiden tutkimusten tulokset osoittivat, että vakaan tilan DRSP-pitoisuudet eivät vaikuttaneet CYP3A4-substraattien farmakokinetiikkaan 3 mg:n DRSP:n/vrk antamisen jälkeen.
Kilpirauhashormonikorvaushoitoa saavat naiset saattavat tarvita suurempia kilpirauhashormoniannoksia, koska kilpirauhasta sitovan globuliinin pitoisuus seerumissa kasvaa yhdistelmäehkäisytablettien käytön myötä.
Vuorovaikutukset lääkkeiden kanssa, jotka voivat lisätä seerumin kaliumpitoisuutta: Seerumin kaliumpitoisuus saattaa nousta naisilla, jotka käyttävät Yasmin 3 mg muiden lääkkeiden kanssa, jotka voivat lisätä seerumin kaliumpitoisuutta [ks. VAROITUKSET JA VAROTOIMET ].
Lääkkeiden yhteisvaikutustutkimus DRSP 3 mg/estradioli (E2) 1 mg vs. lumelääke suoritettiin 24 lievästi hypertensiivisellä postmenopausaalisella naisella, jotka ottivat enalapriilimaleaattia 10 mg kahdesti vuorokaudessa. Kaliumpitoisuudet saatiin joka toinen päivä yhteensä 2 viikon ajan kaikilta koehenkilöiltä. Seerumin keskimääräiset kaliumpitoisuudet DRSP/E2-hoitoryhmässä suhteessa lähtötasoon olivat 0,22 mekv/l korkeammat kuin lumeryhmässä. Seerumin kaliumpitoisuudet mitattiin myös useissa aikapisteissä 24 tunnin aikana lähtötilanteessa ja päivänä 14. Päivänä 14 seerumin kaliumin Cmax- ja AUC-suhteet DRSP/E2-ryhmässä ja lumeryhmässä olivat 0,955 (90 % CI : 0,914, 0,999) ja 1,010 (90 % CI: 0,944, 1,08). Yhdellekään potilaalle kummassakaan hoitoryhmässä ei kehittynyt hyperkalemiaa (seerumin kaliumpitoisuus > 5,5 mekv/l).
Kliiniset tutkimukset
Enintään 2 vuotta kestäneissä kliinisissä tehokkuustutkimuksissa 2 629 henkilöä suoritti 33 160 käyttösykliä ilman muuta ehkäisyä. Tutkittavien keski-ikä oli 25,5 ± 4,7 vuotta. Ikähaarukka oli 16-37 vuotta. Demografiset rodut olivat: 83 % valkoihoisia, 1 % latinalaisamerikkalaisia, 1 % mustia,
POTILASTIEDOT
Yasminin käyttöopas
VAROITUS TUPKOJA NAISILLE
Älä käytä Yasminia, jos poltat savukkeita ja olet yli 35-vuotias. Tupakointi lisää ehkäisypillereiden aiheuttamien vakavien kardiovaskulaaristen sivuvaikutusten (sydän- ja verisuoniongelmien) riskiä, mukaan lukien sydänkohtauksen, veritulppien tai aivohalvauksen aiheuttama kuolema. Tämä riski kasvaa iän ja polttamiesi savukkeiden määrän myötä.
Ehkäisypillerit vähentävät raskaaksi tulemisen mahdollisuutta, kun niitä otetaan ohjeiden mukaan. Ne eivät suojaa HIV-tartunnalta (AIDS) ja muilta sukupuolitaudeilta.
Mikä on Yasmin 3mg?
Yasmin on ehkäisypillere. Se sisältää kahta naishormonia, synteettistä estrogeenia, jota kutsutaan etinyyliestradioliksi, ja progestiinia nimeltä drospirenoni.
Progestiini drospirenoni voi lisätä kaliumia. Siksi sinun ei tule ottaa Yasmin 3 mg -valmistetta, jos sinulla on munuais-, maksa- tai lisämunuaissairaus, koska se voi aiheuttaa vakavia sydän- ja terveysongelmia. Muut lääkkeet voivat myös lisätä kaliumia. Jos saat tällä hetkellä päivittäistä pitkäaikaista kroonista sairauden hoitoa jollakin alla olevista lääkkeistä, sinun tulee kysyä terveydenhuollon tarjoajaltasi, sopiiko Yasmin 3mg sinulle, ja ensimmäisen kuukauden aikana, jolloin käytät Yasminia, sinun tulee verikoe kaliumtasosi tarkistamiseksi.
- Tulehduskipulääkkeet (ibuprofeeni [Motrin, Advil], naprokseeni [Aleve ja muut], kun niitä käytetään pitkään ja päivittäin niveltulehduksen tai muiden ongelmien hoitoon)
- Kaliumia säästävät diureetit (spironolaktoni ja muut)
- Kaliumlisäys
- ACE:n estäjät (Capoten, Vasotec, Zestril ja muut)
- Angiotensiini-II-reseptoriantagonistit (Cozaar, Diovan, Avapro ja muut)
- Hepariini
- Aldosteronin antagonistit
Kuinka hyvin Yasmin toimii?
Mahdollisuutesi tulla raskaaksi riippuu siitä, kuinka hyvin noudatat ehkäisypillereiden ottamista koskevia ohjeita. Mitä paremmin noudatat ohjeita, sitä pienempi on mahdollisuus tulla raskaaksi.
Kahden kliinisen tutkimuksen tulosten perusteella noin 1 nainen 100 naisesta voi tulla raskaaksi ensimmäisen vuoden aikana, kun he käyttävät Yasminia.
Seuraavassa taulukossa näkyy mahdollisuus tulla raskaaksi naisilla, jotka käyttävät erilaisia ehkäisymenetelmiä. Jokainen kaavion laatikko sisältää luettelon ehkäisymenetelmistä, jotka ovat teholtaan samanlaisia. Tehokkaimmat menetelmät ovat kaavion yläosassa. Kaavion alareunassa oleva laatikko näyttää mahdollisuuden tulla raskaaksi naisilla, jotka eivät käytä ehkäisyä ja yrittävät tulla raskaaksi.
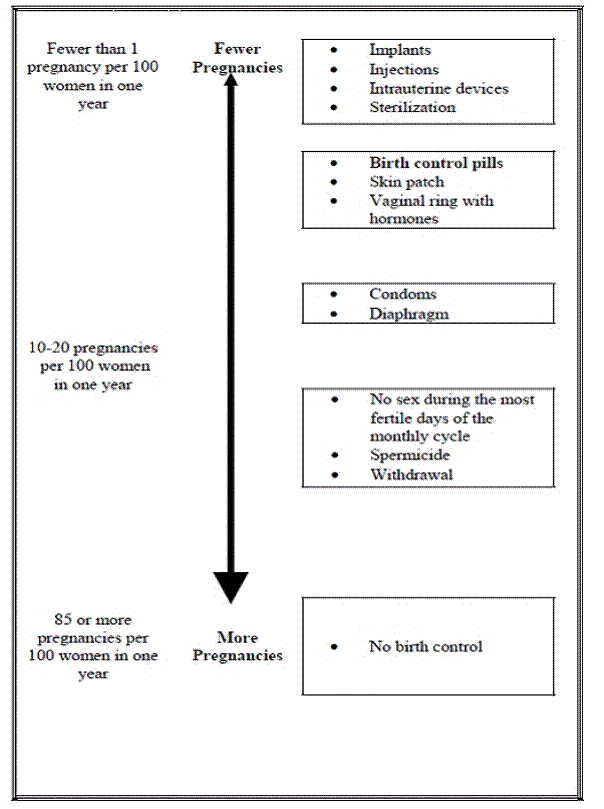
Kuinka otan Yasminin?
1. Muista lukea nämä ohjeet ennen kuin aloitat pillereiden käytön tai milloin tahansa et ole varma mitä tehdä.
2. Oikea tapa ottaa pilleri on ottaa yksi pilleri joka päivä samaan aikaan pakkauksen osoittamassa järjestyksessä. Ota pilleri mieluiten ilta-aterian jälkeen tai nukkumaan mennessä, tarvittaessa nesteen kanssa. Yasmin voidaan ottaa aterioista riippumatta.
Jos unohdat ottaa pillerit, voit tulla raskaaksi. Tämä sisältää paketin aloittamisen myöhässä. Mitä enemmän pillereitä unohdat, sitä todennäköisemmin tulet raskaaksi. Katso kohta "MITÄ TEHDÄ, JOS SINÄ MITTAAT PILLEERIT" alla.
3. Monilla naisilla esiintyy tiputtelua tai lievää verenvuotoa odottamattomina aikoina, tai he voivat tuntea vatsaan pahoinvointia ensimmäisten 1-3 pilleripakkauksen aikana.
Jos sinulla on tiputtelua tai lievää verenvuotoa tai tunnet olosi pahoinvoitavaksi vatsassasi, älä lopeta pillereiden ottamista. Ongelma yleensä poistuu. Jos se ei häviä, ota yhteyttä terveydenhuollon tarjoajaan.
4. Unohtuneet pillerit voivat myös aiheuttaa tiputtelua tai lievää verenvuotoa, vaikka korvaisit nämä unohtaneet pillerit. Päivinä, jolloin otat kaksi pilleriä korvataksesi unohdetut pillerit, saatat myös tuntea olosi hieman pahoinvoivaksi.
5. Jos oksennat (3–4 tunnin sisällä pillerin ottamisen jälkeen), noudata ohjeita kohdassa "MITÄ TEHDÄ, JOS SINÄ MITTAAT PILLEERIT". Jos sinulla on ripulia tai käytät tiettyjä lääkkeitä, mukaan lukien antibiootteja ja joitain kasviperäisiä tuotteita, kuten mäkikuismaa, pillerisi eivät välttämättä toimi yhtä hyvin.
Käytä varamenetelmää (kuten kondomeja ja siittiöiden torjunta-aineita), kunnes otat yhteyttä terveydenhuollon tarjoajaan.
6. Jos sinulla on vaikeuksia muistaa ottaa pilleri, keskustele terveydenhuollon tarjoajan kanssa siitä, kuinka voit helpottaa pillereiden ottamista tai käyttää jotakin muuta ehkäisymenetelmää.
7. Jos sinulla on kysyttävää tai olet epävarma tämän esitteen tiedoista, soita terveydenhuollon tarjoajallesi.
Ennen kuin aloitat pillereiden ottamisen
1. Päätä mihin aikaan vuorokaudesta haluat ottaa pillerisi. On tärkeää ottaa Yasmin 3mg pakkauksessa olevan järjestyksessä samaan aikaan joka päivä, mieluiten ilta-aterian jälkeen tai nukkumaan mennessä, nesteen kera tarpeen mukaan. Yasmin voidaan ottaa aterioista riippumatta.
2. Katso pilleripakkaustasi – siinä on 28 pilleriä
Yasmin-pilleripakkauksessa on 21 keltaista pilleriä (hormonien kanssa), jotka otetaan kolmen viikon ajan, ja sen jälkeen 7 valkoista pilleriä (ilman hormoneja) yhden viikon ajan.
3. Etsi myös:
a) Mistä pakkauksen kohdasta aloittaa pillereiden käyttö,
b) Missä järjestyksessä pillerit otetaan (noudata nuolia)
4. Varmista, että sinulla on aina valmiina (a) muunlainen ehkäisyväline (kuten kondomit ja siittiöiden torjunta-aineet) käytettäväksi vara-apuna, jos unohdat ottaa pillerit, ja (b) ylimääräinen täysi pilleripakkaus.
Milloin aloittaa ensimmäinen pilleripakkaus
Voit valita, minä päivänä aloitat ensimmäisen pilleripakkauksen ottamisen. Päätä terveydenhuollon tarjoajan kanssa, mikä päivä on sinulle paras. Valitse kellonaika, joka on helppo muistaa.
Päivän 1 alku:
1. Ota pakkauksen ensimmäinen keltainen pilleri kuukautistenne ensimmäisten 24 tunnin aikana.
2. Sinun ei tarvitse käyttää varaehkäisymenetelmää, koska aloitat pillereiden käytön kuukautistenne alussa. Jos kuitenkin aloitat Yasmin 3 mg:n käytön myöhemmin kuin kuukautistenne ensimmäisenä päivänä, sinun tulee käyttää toista ehkäisymenetelmää (kuten kondomia ja siittiöiden torjunta-ainetta) varamenetelmänä, kunnes olet ottanut 7 keltaista pilleriä.
Sunnuntai aloitus:
1. Ota pakkauksen ensimmäinen keltainen pilleri kuukautisten alkamisen jälkeisenä sunnuntaina, vaikka verenvuoto jatkuisikin. Jos kuukautisesi alkavat sunnuntaina, aloita pakkaus samana päivänä.
2. Käytä toista ehkäisymenetelmää (kuten kondomia ja siittiöiden torjunta-ainetta) varamenetelmänä, jos harrastat seksiä milloin tahansa ensimmäisen pakkauksen aloittamisen sunnuntaina seuraavaan sunnuntaihin (7 päivää). Tämä pätee myös, jos aloitat Yasmin-valmisteen raskauden jälkeen ja sinulla ei ole ollut kuukautisia raskauden jälkeen.
Kun vaihdat eri ehkäisypillereistä
Toisesta ehkäisypillereistä vaihdettaessa Yasmin-hoito tulee aloittaa samana päivänä, kun uusi pakkaus edellistä ehkäisypillerettä olisi aloitettu.
Kun vaihdat toisesta ehkäisymenetelmästä
Kun vaihdetaan depotlaastarista tai emätinrenkaasta, Yasmin 3 mg -valmisteen käyttö tulee aloittaa, kun seuraavan kerran olisi pitänyt kiinnittää. Kun vaihdetaan injektiosta, Yasmin-hoito tulee aloittaa heti, kun seuraava annos olisi pitänyt ottaa. Kun vaihdetaan kohdunsisäisestä ehkäisyvalmisteesta tai implantista, Yasmin-hoito tulee aloittaa poistopäivänä.
Mitä tehdä kuukauden aikana
1. Ota yksi pilleri samaan aikaan joka päivä, kunnes pakkaus on tyhjä.
Älä jätä pillereitä väliin, vaikka tiputtelut tai verenvuoto olisivat kuukautisten välillä tai vatsasi pahoinvointi (pahoinvointi).
Älä jätä pillereitä väliin, vaikka et harrastaisikaan seksiä kovin usein.
2. Kun lopetat pilleripakkauksen, aloita seuraava pakkaus seuraavana päivänä viimeisen valkoisen pillerin ottamisen jälkeen. Älä odota päivääkään pakkausten välillä.
Mitä tehdä, jos unohdat ottaa pillerit
Jos unohdat yhden keltaisen pillerin pakkauksestasi:
- Ota se heti kun muistat. Ota seuraava pilleri normaaliin aikaan. Tämä tarkoittaa, että voit ottaa kaksi pilleriä yhden päivän aikana.
- Sinun ei tarvitse käyttää varaehkäisymenetelmää, jos harrastat seksiä.
Jos unohdat ottaa 2 keltaista pilleriä peräkkäin viikolla 1 tai 2 pakkauksestasi:
- Ota kaksi pilleriä sinä päivänä, jonka muistat, ja kaksi pilleriä seuraavana päivänä.
- Ota sitten yksi pilleri päivässä, kunnes pakkaus on valmis.
- Voit tulla raskaaksi, jos harrastat seksiä 7 päivän kuluessa pillereiden uudelleen aloittamisesta. Sinun on käytettävä jotain muuta ehkäisymenetelmää (kuten kondomia ja siittiöiden torjunta-ainetta) näiden 7 päivän ajan.
Jos unohdat ottaa 2 keltaista pilleriä peräkkäin viikolla 3 tai 4 pakkauksestasi:
1. Jos olet 1. päivän aloittaja:
Heitä pois pilleripakkauksen loput ja aloita uusi pakkaus samana päivänä.
2. Jos olet sunnuntain aloittaja:
Ota yksi pilleri joka päivä sunnuntaihin asti. Sunnuntaina heitä loput pakkauksesta pois ja aloita uusi pilleripakkaus samana päivänä.
3. Voit tulla raskaaksi, jos harrastat seksiä 7 päivän kuluessa pillereiden uudelleen aloittamisesta. Sinun on käytettävä jotain muuta ehkäisymenetelmää (kuten kondomia ja siittiöiden torjunta-ainetta) näiden 7 päivän ajan.
4. Sinulla ei ehkä ole kuukautisia tässä kuussa, mutta tämä on odotettavissa. Jos kuukautiset jäävät kuitenkin kaksi kuukautta peräkkäin, soita terveydenhuollon tarjoajallesi, koska saatat olla raskaana.
Jos unohdat ottaa 3 tai useampaa keltaista pilleriä peräkkäin millä tahansa viikolla:
1. Jos olet 1. päivän aloittaja:
Heitä pois pilleripakkauksen loput ja aloita uusi pakkaus samana päivänä.
2. Jos olet sunnuntain aloittaja:
Ota 1 pilleri joka päivä sunnuntaihin asti. Sunnuntaina heitä loput pakkauksesta pois ja aloita uusi pilleripakkaus samana päivänä.
3. Voit tulla raskaaksi, jos harrastat seksiä 7 päivän kuluessa pillereiden uudelleen aloittamisesta. Sinun on käytettävä jotain muuta ehkäisymenetelmää (kuten kondomia ja siittiöiden torjunta-aineita) vara-apuna näiden 7 päivän ajan.
4. Sinulla ei ehkä ole kuukautisia tässä kuussa, mutta tämä on odotettavissa. Jos kuukautiset jäävät kuitenkin kaksi kuukautta peräkkäin, soita terveydenhuollon tarjoajallesi, koska saatat olla raskaana.
Jos unohdat ottaa yhden 7 valkoisesta pilleristä viikolla 4:
Heitä pois jääneet pillerit.
Ota yksi pilleri joka päivä, kunnes pakkaus on tyhjä.
Varamenetelmää ei tarvita.
Lopuksi, jos et vieläkään ole varma, mitä tehdä unohdetuille pillereille:
Käytä varamenetelmiä (kuten kondomeja ja siittiöiden torjunta-aineita) aina, kun harrastat seksiä.
Ota yhteyttä terveydenhuollon tarjoajaasi ja jatka yhden aktiivisen keltaisen pillerin ottamista joka päivä, kunnes toisin määrätään.
KENEN EI PIDÄ OTTA Yasminia?
Terveydenhuollon tarjoaja ei anna sinulle Yasmin 0,03 mg:aa, jos:
- sinulla on koskaan ollut veritulppia jaloissasi (syvä laskimotromboosi), keuhkoissasi (keuhkoembolia) tai silmissäsi (verkkokalvon tromboosi)
- Onko koskaan ollut aivohalvaus
- Koskaan saanut sydänkohtauksen
- sinulla on tiettyjä sydänläppäongelmia tai sydämen rytmihäiriöitä, jotka voivat aiheuttaa verihyytymien muodostumista sydämeen
- Sinulla on perinnöllinen verenkiertohäiriö, joka saa sen hyytymään normaalia enemmän
- Sinulla on korkea verenpaine, jota lääke ei pysty hallitsemaan
- Sinulla on diabetes, johon liittyy munuais-, silmä-, hermo- tai verisuonivaurioita
- Onko sinulla koskaan ollut tietyntyyppisiä vakavia migreenipäänsärkyä, johon liittyy aura, puutuminen, heikkous tai näkömuutoksia
- Onko sinulla koskaan ollut rintasyöpää tai mitä tahansa naishormoneille herkkää syöpää
- Sinulla on maksasairaus, mukaan lukien maksakasvaimet
- Onko munuaissairaus
- Onko sinulla lisämunuaissairaus
Älä myöskään ota ehkäisypillereitä, jos:
- Tupakoivat ja ovat yli 35-vuotiaita
- Oletko tai epäilet olevasi raskaana
Ehkäisypillerit eivät ehkä ole hyvä valinta sinulle, jos sinulla on joskus ollut raskauden aiheuttamaa keltaisuutta (ihon tai silmien keltaisuutta) (kutsutaan myös raskauden kolestaasiksi).
Kerro terveydenhuollon tarjoajallesi, jos sinulla on koskaan ollut jokin yllä mainituista tiloista (terveydenhuollon tarjoaja voi suositella jotain muuta ehkäisymenetelmää).
Mitä muuta minun pitäisi tietää Yasminin ottamisesta?
Ehkäisypillerit eivät suojaa sinua miltään sukupuolitaudeilta, mukaan lukien HIV:ltä, aidsia aiheuttavalta virukselta.
Älä jätä väliin mitään pillereitä, vaikka et harrastaisikaan seksiä usein.
Jos kuukautiset jäävät kesken, saatat olla raskaana. Joillakin naisilla kuukautiset jäävät kuitenkin väliin tai he käyttävät ehkäisypillereitä kevyesti, vaikka he eivät olisikaan raskaana. Ota yhteyttä terveydenhuollon tarjoajaan saadaksesi neuvoja, jos:
- Ajattele olevasi raskaana
- Kuukautiset puuttuvat, etkä ole ottanut ehkäisypillereitäsi ajoissa joka päivä
- Jäi väliin kaksi jaksoa peräkkäin
Ehkäisypillereitä ei pidä ottaa raskauden aikana. Raskauden aikana vahingossa otetut ehkäisypillerit eivät kuitenkaan tiedetä aiheuttavan synnynnäisiä epämuodostumia.
Veritulppariskin lisääntymisen vuoksi sinun tulee lopettaa Yasmin 0,03 mg -valmisteen käyttö vähintään neljä viikkoa ennen suurta leikkausta ja aloittaa se uudelleen vasta vähintään kaksi viikkoa leikkauksen jälkeen.
Jos imetät, harkitse toista ehkäisymenetelmää, kunnes olet valmis lopettamaan imetyksen. Estrogeenia sisältävät ehkäisypillerit, kuten Yasmin, voivat vähentää tuottamasi maidon määrää. Pieni määrä pillereiden hormoneja erittyy äidinmaitoon.
Jos sinulla on oksentelua tai ripulia, ehkäisypillerit eivät välttämättä toimi yhtä hyvin. Ota toinen pilleri, jos oksennat 3–4 tunnin kuluessa pillerin ottamisesta, tai käytä jotakin muuta ehkäisymenetelmää, kuten kondomia ja siittiöiden torjunta-ainetta, kunnes tarkistat asian terveydenhuollon tarjoajaltasi.
Jos sinulle on määrä tehdä laboratoriotutkimuksia, kerro lääkärillesi, että käytät ehkäisypillereitä. Ehkäisypillerit voivat vaikuttaa tiettyihin verikokeisiin.
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien resepti- ja käsikauppalääkkeet, vitamiinit ja yrttilisät.
Yasmin voi vaikuttaa muiden lääkkeiden tehoon, ja muut lääkkeet voivat vaikuttaa Yasmin 3mg:n tehoon. Tunne käyttämäsi lääkkeet.
Pidä niistä luetteloa näyttääksesi terveydenhuollon tarjoajalle ja apteekkihenkilökunnalle, kun saat uuden lääkkeen.
Mitkä ovat vakavimmat ehkäisypillereiden ottamisen riskit?
Kuten raskaus, ehkäisypillerit lisäävät vakavien veritulppien riskiä (katso seuraava kaavio), erityisesti naisilla, joilla on muita riskitekijöitä, kuten tupakointi, liikalihavuus tai yli 35-vuotiaat. Tämä lisääntynyt riski on suurin, kun aloitat käytön ensimmäisen kerran. ehkäisypillereitä ja kun aloitat samojen tai eri ehkäisypillereiden käytön uudelleen, kun et ole käyttänyt niitä kuukauteen tai pidempään. Naisilla, jotka käyttävät ehkäisypillereitä drospirenonin kanssa (kuten Yasmin), voi olla suurempi riski saada veritulppa. Jotkut tutkimukset raportoivat, että veritulppien riski oli suurempi naisilla, jotka käyttävät drospirenonia sisältäviä ehkäisypillereitä kuin naisilla, jotka käyttävät drospirenonia sisältämättömiä ehkäisypillereitä.
Keskustele terveydenhuollon tarjoajan kanssa riskistäsi saada veritulppa, ennen kuin päätät, mikä ehkäisypillere sopii sinulle.
On mahdollista kuolla tai tulla pysyvästi toimintakyvyttömäksi veritulpan aiheuttamaan ongelmaan, kuten sydänkohtaukseen tai aivohalvaukseen. Joitakin esimerkkejä vakavista hyytymistä ovat verihyytymät:
- Jalat (syvä laskimotromboosi tai DVT)
- Keuhkot (keuhkoembolia tai PE)
- Silmät (näön menetys)
- Sydän (sydänkohtaus)
- Aivot (halvaus)
Veritulpan kehittymisen riskin tarkastelu: Jos 10 000 naista, jotka eivät ole raskaana ja eivät käytä ehkäisypillereitä, seurataan vuoden ajan, 1–5 näistä naisista kehittyy veritulppa. Alla oleva kuva näyttää vakavan veritulpan kehittymisen todennäköisyydellä naisille, jotka eivät ole raskaana eivätkä käytä ehkäisypillereitä, naisille, jotka käyttävät ehkäisypillereitä, raskaana oleville naisille ja naisille ensimmäisten 12 viikon aikana synnytyksen jälkeen. .
Vakavan veritulpan kehittymisen todennäköisyys
Muutamat ehkäisypillereitä käyttävät naiset voivat saada:
- Korkea verenpaine
- Sappirakon ongelmat
- Harvinaiset syöpä- tai ei-syöpäkasvaimet
Kaikki nämä tapahtumat ovat harvinaisia terveillä naisilla.
Soita heti terveydenhuollon tarjoajallesi, jos sinulla on:
- Jatkuva jalkakipu
- Äkillinen hengenahdistus
- Äkillinen sokeus, osittainen tai täydellinen
- Kova kipu rinnassa
- Äkillinen, voimakas päänsärky toisin kuin tavalliset päänsäryt
- Heikkous tai tunnottomuus kädessä tai jalassa tai puhevaikeuksia
- Ihon tai silmämunien kellastuminen
Mitkä ovat ehkäisypillereiden yleiset sivuvaikutukset?
Ehkäisypillereiden yleisimmät sivuvaikutukset ovat:
- Tiputtelu tai verenvuoto kuukautisten välillä
- Pahoinvointi
- Rintojen arkuus
- Päänsärky
Nämä haittavaikutukset ovat yleensä lieviä ja häviävät yleensä ajan myötä.
Vähemmän yleisiä sivuvaikutuksia ovat:
- Akne
- Vähemmän seksuaalista halua
- Turvotus tai nesteen kertyminen
- Laikkuinen ihon tummuminen, erityisesti kasvoilla
- Korkea verensokeri, erityisesti naisilla, joilla on jo diabetes
- Korkeat rasva- (kolesteroli, triglyseridi) tasot veressä
- Masennus, varsinkin jos sinulla on ollut masennusta aiemmin. Soita välittömästi terveydenhuollon tarjoajallesi, jos sinulla on ajatuksia itsesi vahingoittamisesta.
- Ongelmia piilolinssien sietämisessä
- Painon muutokset
Tämä ei ole täydellinen luettelo mahdollisista sivuvaikutuksista. Keskustele terveydenhuollon tarjoajan kanssa, jos sinulle ilmaantuu haittavaikutuksia. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Mitään vakavia ongelmia ei ole raportoitu ehkäisypillereiden yliannostuksesta, vaikka lapset olisivat sen vahingossa ottaneet.
Aiheuttavatko ehkäisypillerit syöpää?
Ehkäisypillerit eivät näytä aiheuttavan rintasyöpää. Jos sinulla on nyt tai on ollut rintasyöpä, älä kuitenkaan käytä ehkäisypillereitä, koska jotkut rintasyövät ovat herkkiä hormoneille.
Naisilla, jotka käyttävät ehkäisypillereitä, saattaa olla hieman suurempi mahdollisuus saada kohdunkaulan syöpä. Tämä voi kuitenkin johtua muista syistä, kuten useammista seksikumppaneista.
Mitä minun pitäisi tietää kuukautisistani, kun käytän Yasminia?
Epäsäännöllistä emättimen verenvuotoa tai tiputtelua voi esiintyä Yasmin-hoidon aikana. Epäsäännöllinen verenvuoto voi vaihdella lievästä värjäytymisestä kuukautisten välillä läpimurtovuotoon, joka on säännöllisen kuukautisvuodon kaltaista. Epäsäännöllistä verenvuotoa esiintyy useimmiten suun kautta otettavien ehkäisyvalmisteiden ensimmäisten kuukausien aikana, mutta sitä voi esiintyä myös sen jälkeen, kun olet käyttänyt pilleriä jonkin aikaa. Tällainen verenvuoto voi olla tilapäistä, eikä se yleensä osoita vakavia ongelmia. On tärkeää jatkaa pillereiden ottamista aikataulun mukaisesti. Jos verenvuoto esiintyy useammassa kuin yhdessä syklissä, on epätavallisen voimakasta tai kestää yli muutaman päivän, soita terveydenhuollon tarjoajalle.
Joillakin naisilla ei ehkä ole kuukautisia, mutta tämän ei pitäisi olla syytä huoleen, kunhan olet ottanut pillerit säännöllisesti ajoissa.
Entä jos missaan suunnitellun kuukautiseni, kun käytän Yasminia?
Ei ole harvinaista, että kuukautiset jäävät väliin. Jos kuitenkin jää kaksi kuukautisia peräkkäin tai yksi kuukautiset jäävät väliin, jos et ole ottanut ehkäisypillereitä säännöllisesti ajoissa, soita terveydenhuollon ammattilaiselle. Ilmoita myös terveydenhuollon tarjoajallesi, jos sinulla on raskauden oireita, kuten aamupahoinvointia tai epätavallista rintojen arkuutta. On tärkeää, että terveydenhuollon tarjoaja tarkistaa sinut selvittääkseen, oletko raskaana. Lopeta Yasmin 3 mg:n käyttö, jos olet raskaana.
Entä jos haluan tulla raskaaksi?
Voit lopettaa pillereiden käytön milloin haluat. Harkitse käyntiä terveydenhuollon tarjoajan kanssa raskautta edeltävässä tarkastuksessa ennen kuin lopetat pillereiden käytön.
Yleisiä neuvoja Yasminista
Terveydenhuollon tarjoaja on määrännyt sinulle Yasmin 0,03 mg:n. Älä jaa Yasminia kenenkään muun kanssa. Pidä Yasmin poissa lasten ulottuvilta.
Jos sinulla on huolenaiheita tai kysymyksiä, kysy terveydenhuollon tarjoajaltasi. Voit myös pyytää terveydenhuollon tarjoajalta tarkempaa lääketieteen ammattilaisille kirjoitettua etikettiä.
