Mircette 0.15/0.02 mg Desogestrel Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mikä Mircette 0,15 mg on ja miten sitä käytetään?
Mircette on reseptilääke, jota käytetään ehkäisynä raskauden ehkäisyyn. Mircetteä voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Mircette kuuluu lääkeluokkaan, jota kutsutaan estrogeeniksi/progestiiniksi; Ehkäisyvälineet, Oraaliset.
Ei tiedetä, onko Mircette turvallinen ja tehokas lasten premenarcheilla.
Mitkä ovat Mircetten mahdolliset sivuvaikutukset?
Mircette voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- nokkosihottuma,
- vaikeuksia hengittää,
- kasvojen, huulten, kielen tai kurkun turvotus,
- äkillinen puutuminen tai heikkous (etenkin toisella kehon puolella),
- äkillinen kova päänsärky,
- sammaltava puhe,
- näkö- tai tasapainoongelmia,
- äkillinen näönmenetys,
- pistävä rintakipu,
- hengenahdistus,
- yskii verta,
- kipu tai lämpö toisessa tai molemmissa jaloissa,
- rintakipu tai paine,
- kipu leviää leukaan tai olkapäähän,
- pahoinvointi,
- hikoilu,
- ruokahalun menetys,
- ylävatsakipu,
- väsymys,
- kuume,
- tumma virtsa,
- savenväriset ulosteet,
- ihon tai silmien keltaisuus (keltatauti),
- kova päänsärky,
- näön hämärtyminen,
- hakkaa niskassasi tai korvissasi,
- turvotus käsissäsi, nilkoissasi tai jaloissasi,
- muutokset migreenipäänsäryn rakenteessa tai vaikeusasteessa,
- rintojen kyhmy,
- unihäiriöt,
- heikkous,
- väsynyt tunne ja
- mielialan muutoksia
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Mircetten yleisimpiä sivuvaikutuksia ovat:
- pahoinvointi,
- oksentelu (varsinkin kun aloitat tämän lääkkeen käytön),
- rintojen arkuus,
- läpimurtoverenvuoto,
- akne,
- kasvojen ihon tummuminen,
- painonnousu ja
- ongelmia piilolinssien kanssa
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Mircetten mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Potilaita tulee neuvoa, että tämä tuote ei suojaa HIV-infektiolta (AIDS) ja muilta sukupuolitaudeilta.
KUVAUS
Mircette® (desogestreeli/etinyyliestradioli ja etinyyliestradioli) -tabletit tarjoavat suun kautta otettavan ehkäisyohjelman, jossa on 21 valkoista pyöreää tablettia, joista jokainen sisältää 0,15 mg desogestreeliä (13-etyyli-11-metyleeni-18,19-dinor-17-alfa-pregn-4-en-fi). -yn-17-oli), 0,02 mg etinyyliestradiolia (19-nor17-alfa-pregna-1,3,5 (10)-trien-20-yne-3,17-diol) ja inaktiivisia aineosia, jotka sisältävät kolloidista piidioksidia , hypromelloosi, laktoosimonohydraatti, polyetyleeniglykoli, povidoni, esigelatinoitu tärkkelys, steariinihappo ja E-vitamiini, minkä jälkeen 2 inerttiä vaaleanvihreää pyöreää tablettia, joissa on seuraavat inaktiiviset aineet: FD&C blue no. 1 alumiinijärvi, FD & C keltainen nro. 6 alumiinijärvi, D&C keltainen nro. 10 alumiinilakka, laktoosimonohydraatti, magnesiumstearaatti, mikrokiteinen selluloosa ja esigelatinoitu tärkkelys. Mircette® sisältää myös 5 keltaista pyöreää tablettia, jotka sisältävät 0,01 mg etinyyliestradiolia (19-nor-17-alfa-pregna-1,3,5 (10)-trien-20-yne3,17-dioli) ja inaktiivisia aineita, kuten kolloidista piidioksidia , D&C keltainen nro. 10, alumiinijärvi, FD&C keltainen nro. 6 alumiinilakka, hypromelloosi, laktoosimonohydraatti, polyetyleeniglykoli, povidoni, polysorbaatti 80, esigelatinoitu tärkkelys, steariinihappo, titaanidioksidi ja E-vitamiini. Desogestreelin ja etinyyliestradiolin molekyylipainot ovat vastaavasti 310,48 ja 296. Rakennekaavat ovat seuraavat:
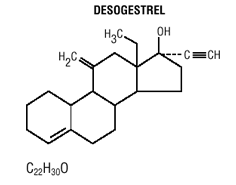
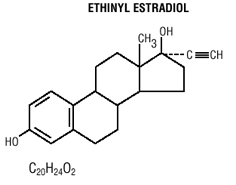
INDIKAATIOT
Mircette® (desogestreeli/etinyyliestradioli ja etinyyliestradioli) -tabletit on tarkoitettu raskauden ehkäisyyn naisille, jotka päättävät käyttää tätä tuotetta ehkäisymenetelmänä.
Suun kautta otettavat ehkäisyvalmisteet ovat erittäin tehokkaita. Taulukossa II on lueteltu tyypilliset vahingossa tapahtuneiden raskauksien määrä oraalisten yhdistelmäehkäisyvalmisteiden ja muiden ehkäisymenetelmien käyttäjillä. Näiden ehkäisymenetelmien tehokkuus sterilointia lukuun ottamatta riippuu niiden käytön luotettavuudesta. Näiden menetelmien oikea ja johdonmukainen käyttö voi johtaa pienempään vikaantumiseen.
TAULUKKO II: Prosenttiosuus naisista, jotka kokivat tahattoman raskauden ensimmäisen tyypillisen ehkäisyvuoden ja ensimmäisen täydellisen ehkäisyvuoden aikana, ja prosenttiosuus, jotka jatkavat käyttöä ensimmäisen vuoden lopussa, Yhdysvallat.
ANNOSTELU JA HALLINNOINTI
Maksimaalisen ehkäisytehon saavuttamiseksi Mircette® (desogestreeli/etinyyliestradioli ja etinyyliestradioli) -tabletit on otettava täsmälleen ohjeiden mukaisesti ja enintään 24 tunnin välein. Mircette® voidaan käynnistää joko sunnuntai- tai 1. päivän aloituksella.
HUOMAUTUS: Jokaiseen syklipakkauksen annostelijaan on esipainettu viikonpäivät sunnuntaista alkaen sunnuntain aloitusohjelman helpottamiseksi. Jokaisen syklipakkauksen annostelijan mukana toimitetaan kuusi erilaista "päivätarraliuskaa", jotta se soveltuu 1. päivän aloitusohjelmaan. Tässä tapauksessa potilaan tulee asettaa itseliimautuva "päiväetikettiliuska", joka vastaa hänen aloituspäivää, esipainettujen päivien päälle.
TÄRKEÄÄ: Ovulaation ja hedelmöittymisen mahdollisuus tulee ottaa huomioon ennen Mircette®-hoidon aloittamista.
Mircette®-valmisteen käyttö ehkäisyyn voidaan aloittaa 4 viikkoa synnytyksen jälkeen naisilla, jotka eivät halua imettää. Kun tabletteja annetaan synnytyksen jälkeisenä aikana, on otettava huomioon synnytyksen jälkeiseen aikaan liittyvä lisääntynyt tromboembolisen sairauden riski (ks. VASTA-AIHEET ja VAROITUKSET tromboembolisesta sairaudesta. Katso myös VAROTOIMENPITEET varten Imettävät äidit ).
Jos potilas aloittaa Mircette®-hoidon synnytyksen jälkeen eikä kuukautisia ole vielä alkanut, häntä tulee neuvoa käyttämään toista ehkäisymenetelmää, kunnes valkoinen tabletti on otettu päivittäin 7 päivän ajan.
Sunnuntai Alku
Sunnuntai-aloitushoitoa aloitettaessa tulee käyttää toista ehkäisymenetelmää ensimmäisten 7 peräkkäisen antopäivän jälkeen.
Sunnuntai-aloitusta käytettäessä tabletit otetaan päivittäin keskeytyksettä seuraavasti: Ensimmäinen valkoinen tabletti tulee ottaa ensimmäisenä sunnuntaina kuukautisten alkamisen jälkeen (jos kuukautiset alkavat sunnuntaina, ensimmäinen valkoinen tabletti otetaan sinä päivänä). Yksi valkoinen tabletti otetaan päivittäin 21 päivän ajan, sen jälkeen 1 vaaleanvihreä (inertti) tabletti päivittäin 2 päivän ajan ja 1 keltainen (aktiivinen) tabletti päivittäin 5 päivän ajan. Kaikilla myöhemmillä jaksoilla potilas aloittaa uuden 28 tabletin hoito-ohjelman seuraavana päivänä (sunnuntaina) viimeisen keltaisen tabletin ottamisen jälkeen. [Jos vaihdetaan sunnuntai-aloitusehkäisyvalmisteesta, ensimmäinen Mircette® (desogestreeli/etinyyliestradioli ja etinyyliestradioli) -tabletti tulee ottaa toisena sunnuntaina 21 päivän hoito-ohjelman viimeisen tabletin jälkeen tai ensimmäisenä sunnuntaina hoidon jälkeen. viimeinen inaktiivinen tabletti 28 päivän hoito-ohjelmassa.]
Jos potilas unohtaa ottaa yhden valkoisen tabletin, hänen tulee ottaa unohtunut tabletti heti kun muistaa. Jos potilas unohtaa ottaa 2 peräkkäistä valkoista tablettia viikolla 1 tai 2, potilaan tulee ottaa 2 tablettia seuraavana päivänä ja 2 tablettia seuraavana päivänä. sen jälkeen potilaan tulee jatkaa 1 tabletin ottamista päivässä, kunnes syklipakkaus on päättynyt. Potilasta tulee neuvoa käyttämään varaehkäisymenetelmää, jos hän on yhdynnässä 7 päivän aikana pillereiden puuttumisen jälkeen. Jos potilas unohtaa ottaa 2 peräkkäistä valkoista tablettia kolmannella viikolla tai unohtaa 3 tai useampia valkoisia tabletteja peräkkäin milloin tahansa syklin aikana, potilaan tulee ottaa 1 valkoinen tabletti päivittäin seuraavaan sunnuntaihin asti. Sunnuntaina potilaan tulee heittää pois syklipakkauksen loppuosa ja aloittaa uusi kiertopaketti samana päivänä. Potilasta tulee neuvoa käyttämään varaehkäisymenetelmää, jos hän on yhdynnässä 7 päivän aikana pillereiden puuttumisen jälkeen.
Päivä 1 aloitus
Kun kuukautisten ensimmäinen päivä lasketaan "päiväksi 1", tabletit otetaan keskeytyksettä seuraavasti: Yksi valkoinen tabletti vuorokaudessa 21 päivän ajan, yksi vaaleanvihreä (inertti) tabletti päivittäin 2 päivän ajan ja sen jälkeen 1 keltainen (etinyyliestradioli) tabletti päivässä. 5 päivän ajan. Kaikilla myöhemmillä jaksoilla potilas aloittaa uuden 28 tabletin hoito-ohjelman seuraavana päivänä viimeisen keltaisen tabletin ottamisen jälkeen. [Jos vaihdetaan suoraan toisesta ehkäisyvalmisteesta, ensimmäinen valkoinen tabletti tulee ottaa kuukautisten ensimmäisenä päivänä, joka alkaa edellisen tuotteen viimeisen AKTIIVISEN tabletin jälkeen.]
Jos potilas unohtaa ottaa yhden valkoisen tabletin, hänen tulee ottaa unohtunut tabletti heti kun muistaa. Jos potilas unohtaa ottaa 2 peräkkäistä valkoista tablettia viikolla 1 tai 2, potilaan tulee ottaa 2 tablettia seuraavana päivänä ja 2 tablettia seuraavana päivänä. sen jälkeen potilaan tulee jatkaa 1 tabletin ottamista päivässä, kunnes syklipakkaus on päättynyt. Potilasta tulee neuvoa käyttämään varaehkäisymenetelmää, jos hän on yhdynnässä 7 päivän aikana pillereiden puuttumisen jälkeen. Jos potilas unohtaa ottaa 2 peräkkäistä valkoista tablettia kolmannella viikolla tai jos potilas unohtaa 3 tai useampia valkoisia tabletteja peräkkäin missä tahansa vaiheessa syklin aikana, potilaan tulee heittää pois syklipakkauksen loppuosa ja aloittaa uusi syklipakkaus. samana päivänä. Potilasta tulee neuvoa käyttämään varaehkäisymenetelmää, jos hän on yhdynnässä 7 päivän aikana pillereiden puuttumisen jälkeen.
Kaikki suun kautta otettavat ehkäisyvalmisteet
Läpäisyverenvuoto, tiputtelu ja amenorrea ovat yleisiä syitä siihen, miksi potilaat lopettavat ehkäisytablettien käytön. Läpäisyverenvuodossa, kuten kaikissa epäsäännöllisissä emättimen verenvuodoissa, ei-toiminnalliset syyt on pidettävä mielessä. Jos emättimestä vuotaa epänormaalia, jatkuvaa tai toistuvaa, diagnosoimatonta, riittävät diagnostiset toimenpiteet ovat aiheellisia raskauden tai pahanlaatuisuuden sulkemiseksi pois. Jos sekä raskaus että patologia on suljettu pois, aika tai vaihto toiseen valmisteeseen voi ratkaista ongelman. Vaihtaminen oraaliseen ehkäisyyn, jossa on korkeampi estrogeenipitoisuus, vaikka se saattaa olla hyödyllinen kuukautiskierron epäsäännöllisyyksien minimoinnissa, tulee tehdä vain tarvittaessa, koska tämä voi lisätä tromboembolisen sairauden riskiä.
Suun kautta otettavien ehkäisyvälineiden käyttö kuukautisten puuttuessa:
MITEN TOIMITETAAN
Mircette ® (desogestreeli/etinyyliestradioli ja etinyyliestradioli) Tabletit sisältävät 21 pyöreää valkoista tablettia, 2 pyöreää vihreää tablettia ja 5 pyöreää keltaista tablettia läpipainopakkauksessa kierrätettävässä muovisessa annostelijassa. Jokainen valkoinen tabletti (toisella puolella merkintä "dp" ja toisella puolella "021") sisältää 0,15 mg desogestreeliä ja 0,02 mg etinyyliestradiolia. Jokainen vihreä tabletti (toisella puolella merkintä "dp" ja toisella puolella "331") sisältää inerttejä aineosia. Jokainen keltainen tabletti (toisella puolella merkintä "dp" ja toisella puolella "457") sisältää 0,01 mg etinyyliestradiolia.
Laatikot 6 kpl NDC 51285-114-58
Säilytä 20° - 25°C (68° - 77°F) [Katso USP-ohjattu huonelämpötila ].
VIITTEET
1. Hatcher RA, Trussell J, Stewart F et ai. Ehkäisytekniikka: Seitsemäntoista tarkistettu painos, New York: Irvington Publishers, 1998, painossa.
2. Stadel BV. Suun kautta otettavat ehkäisyvalmisteet ja sydän- ja verisuonisairaudet. (Pt. 1). N Engl J Med 1981; 305:612–618.
3. Stadel BV. Suun kautta otettavat ehkäisyvalmisteet ja sydän- ja verisuonisairaudet. (Pt. 2). N Engl J Med 1981; 305:672-677.
44. Shapiro S. Suun kautta otettavat ehkäisyvälineet – aika arvioida. N Engl J Med 1987; 315:450–451.
73. Syöpä- ja steroidihormonitutkimus Centers for Disease Control ja National Institute of Child Health and Human Development: Suun kautta otettavien ehkäisyvälineiden käyttö ja munasarjasyövän riski. JAMA 1983; 249:1596–1599.
74. Syöpä- ja steroidihormonitutkimus Centers for Disease Control ja National Institute of Child Health and Human Development: Suun kautta otettavien ehkäisyvalmisteiden yhdistelmäkäyttö ja endometriumin syövän riski. JAMA 1987; 257:796–800.
75. Ory HW. Toiminnalliset munasarjakystat ja suun kautta otettavat ehkäisyvalmisteet: negatiivinen yhteys varmistettu kirurgisesti. JAMA 1974; 228:68–69.
76. Ory HW, Cole P, Macmahon B, Hoover R. Suun kautta otettavat ehkäisyvalmisteet ja pienentynyt hyvänlaatuisen rintasairauden riski. N Engl J Med 1976; 294:419–422.
77. Ory HW. Ei-ehkäisyhyötyjä suun kautta otettavien ehkäisyvalmisteiden käytöstä. Fam Plann Perspect 1982; 14:182–184.
78. Ory HW, Forrest JD, Lincoln R. Valintojen tekeminen: Ehkäisymenetelmien terveysriskien ja hyötyjen arviointi. New York, Alan Guttmacher Institute, 1983; s. 1.
90. Godsland, I et ai. Oraalisten ehkäisyvalmisteiden eri formulaatioiden vaikutukset lipidi- ja hiilihydraattiaineenvaihduntaan. N Engl J Med 1990; 323:1375–81.
91. Kloosterboer, HJ et ai. Selektiivisyys progesteronin ja androgeenireseptorin sitoutumisessa oraalisessa ehkäisyssä käytettyjen progestogeenien suhteen. Ehkäisy, 1988; 38:325–32.
92. Van der Vies, J ja de Visser, J. Endokrinologiset tutkimukset desogestreelillä. Arzneim. Forsch./Drug Res., 1983; 33(l),2:231–6.
93. Tiedostossa olevat tiedot, Organon Inc.
94. Fotherby, K. Suun kautta otettavat ehkäisyvalmisteet, lipidit ja sydän- ja verisuonitaudit. Ehkäisy, 1985; Voi. 31; 4:367–94.
95. Lawrence, DM et ai. Vähentynyt sukupuolihormoneja sitova globuliini ja johdettu vapaan testosteronin taso naisilla, joilla on vaikea akne. Clinical Endocrinology, 1981; 15:87–91.
96. Cullberg, G et ai. Pienen annoksen desogestreeli-etinyyliestradioliyhdistelmän vaikutukset hirsutismiin, androgeeniin ja sukupuolihormoneja sitovaan globuliiniin naisilla, joilla on munasarjojen monirakkulatauti. Acta Obstet Gynecol Scand, 1985; 64:195–202.
97. Jung-Hoffmann, C ja Kuhl, H. Kahden pieniannoksisen oraalisen ehkäisyvalmisteen erilaiset vaikutukset sukupuolihormonia sitovaan globuliiniin ja vapaaseen testosteroniin. AJOG, 1987; 156:199–203.
98. Hammond, G et ai. Seerumin steroideja sitovien proteiinien pitoisuudet, progestogeenien jakautuminen ja testosteronin hyötyosuus desogestreeliä tai levonorgestreeliä sisältävien ehkäisyvalmisteiden käytön aikana. Hedelmällinen. Steril., 1984; 42:44–51.
99. Palatsi, R et ai. Seerumin kokonais- ja sitoutumaton testosteroni- ja sukupuolihormoneja sitova globuliini (SHBG) akne-naispotilailla, joita hoidetaan kahdella eri oraalisella ehkäisyvalmisteella. Acta Derm Venereol, 1984; 64:517–23.
Teva Women's Health, Inc., Teva Pharmaceuticals USA, Inc.:n tytäryhtiö Sellersville, PA 18960. Rev. 06/2012
SIVUVAIKUTUKSET
Seuraavien vakavien haittavaikutusten riski on lisääntynyt oraalisten ehkäisyvalmisteiden käyttöön (ks VAROITUKSET jakso):
- Tromboflebiitti ja laskimotromboosi embolialla tai ilman
- Valtimotromboembolia
- Keuhkoveritulppa
- Sydäninfarkti
- Aivoverenvuoto
- Aivojen tromboosi
- Hypertensio
- Sappirakon sairaus
- Maksan adenoomat tai hyvänlaatuiset maksakasvaimet
Seuraavien sairauksien ja suun kautta otettavien ehkäisyvalmisteiden käytön välillä on näyttöä yhteydestä:
- Suoliliepeen tromboosi
- Verkkokalvon tromboosi
Seuraavia haittavaikutuksia on raportoitu potilailla, jotka ovat saaneet suun kautta otettavia ehkäisyvalmisteita ja joiden uskotaan liittyvän lääkkeisiin:
- Pahoinvointi
- Oksentelu
- Ruoansulatuskanavan oireet (kuten vatsakrampit ja turvotus)
- Läpimurtoverenvuoto
- Tarkkailu
- Muutos kuukautiskierrossa
- Amenorrea
- Väliaikainen hedelmättömyys hoidon lopettamisen jälkeen
- Turvotus
- Melasma, joka saattaa jatkua
- Rintojen muutokset: arkuus, suureneminen, eritys
- Painon muutos (lisää tai laske)
- Kohdunkaulan eroosion ja erityksen muutos
- Imetyksen väheneminen heti synnytyksen jälkeen annettuna
- Kolestaattinen keltaisuus
- Migreeni
- Ihottuma (allerginen)
- Henkinen masennus
- Vähentynyt toleranssi hiilihydraateille
- Emättimen kandidiaasi
- Sarveiskalvon kaarevuuden muutos (jyrkkyys)
- Piilolinssien intoleranssi
Seuraavia haittavaikutuksia on raportoitu oraalisten ehkäisyvalmisteiden käyttäjillä, eikä yhteyttä ole vahvistettu eikä kumottu:
- Premenstruaalinen oireyhtymä
- Kaihi
- Ruokahalun muutokset
- Kystiitin kaltainen oireyhtymä
- Päänsärky
- Hermostuneisuus
- Huimaus
- Hirsutismi
- Päänahan hiusten menetys
- Erythema multiforme
- Erythema nodosum
- Hemorraginen purkaus
- Vaginiitti
- Porfyria
- Munuaisten vajaatoiminta
- Hemolyyttinen ureeminen oireyhtymä
- Akne
- Muutokset libidossa
- Koliitti
- Budd-Chiarin oireyhtymä
HUUMEIDEN VUOROVAIKUTUKSET
Rifampiinin samanaikaiseen käyttöön on yhdistetty tehon heikkeneminen ja läpilyöntiverenvuotojen ja kuukautiskierron epäsäännöllisyyksien lisääntyminen. Samanlaista yhteyttä, vaikkakin vähemmän merkittävää, on ehdotettu barbituraattien, fenyylibutatsonin, fenytoiininatriumin, karbamatsepiinin ja mahdollisesti griseofulviinin, ampisilliinin ja tetrasykliinien kanssa (72).
Yhdistelmähormonaalisten ehkäisyvalmisteiden on osoitettu vähentävän merkittävästi plasman lamotrigiinipitoisuuksia, kun niitä käytetään samanaikaisesti, mikä johtuu todennäköisesti lamotrigiinin glukuronidaation induktiosta. Tämä voi heikentää kohtausten hallintaa; siksi lamotrigiinin annoksen muuttaminen saattaa olla tarpeen.
Katso samanaikaisesti käytetyn lääkkeen merkinnöistä lisätietoja interaktioista hormonaalisten ehkäisyvalmisteiden kanssa tai mahdollisista entsyymimuutoksista.
Vuorovaikutukset laboratoriotutkimusten kanssa
Suun kautta otettavat ehkäisyvalmisteet voivat vaikuttaa tiettyihin endokriinisiin ja maksan toimintakokeisiin ja veren komponentteihin:
VAROITUKSET
Tupakointi lisää suun kautta otettavien ehkäisyvalmisteiden käytön aiheuttamien vakavien kardiovaskulaaristen sivuvaikutusten riskiä. Tämä riski kasvaa iän ja runsaan tupakoinnin (vähintään 15 savuketta päivässä) myötä, ja se on huomattava yli 35-vuotiailla naisilla. Naisia, jotka käyttävät suun kautta otettavia ehkäisyvalmisteita, tulee ehdottomasti neuvoa olemaan tupakoimatta.
Suun kautta otettavien ehkäisyvalmisteiden käyttöön liittyy useiden vakavien sairauksien, kuten sydäninfarktin, tromboembolian, aivohalvauksen, maksaneoplasian ja sappirakon sairauden, lisääntynyt riski, vaikka vakavan sairastuvuuden tai kuolleisuuden riski on hyvin pieni terveillä naisilla ilman taustalla olevia riskitekijöitä. Sairastuvuuden ja kuolleisuuden riski kasvaa merkittävästi muiden taustalla olevien riskitekijöiden, kuten verenpainetaudin, hyperlipidemioiden, liikalihavuuden ja diabeteksen läsnä ollessa.
Oraalisia ehkäisyvalmisteita määräävien lääkärien tulee tuntea seuraavat näihin riskeihin liittyvät tiedot.
Tämän pakkausselosteen sisältämät tiedot perustuvat pääasiassa tutkimuksiin, jotka on suoritettu potilailla, jotka käyttivät suun kautta otettavia ehkäisyvalmisteita, joissa oli suurempia annoksia estrogeenia ja progestogeenia kuin nykyisin yleisesti käytettyjä. Oraalisten ehkäisyvalmisteiden pitkäaikaisen käytön vaikutus sekä estrogeeni- että progestogeenivalmisteiden pienempien annosten kanssa on vielä määrittämättä.
Tämän merkinnän aikana raportoidut epidemiologiset tutkimukset ovat kahdenlaisia: retrospektiiviset tai tapauskontrollitutkimukset ja prospektiiviset tai kohorttitutkimukset. Tapauskontrollitutkimukset tarjoavat mittarin sairauden suhteellisesta riskistä, nimittäin suun kautta otettavien ehkäisyvalmisteiden käyttäjien ja ei-käyttäjien sairauksien ilmaantuvuuden suhteen. Suhteellinen riski ei anna tietoa sairauden todellisesta kliinisestä esiintymisestä. Kohorttitutkimukset tarjoavat mittarin johtuvan riskin, joka on ero sairauksien ilmaantuvuuden välillä ehkäisytablettien käyttäjien ja ei-käyttäjien välillä. Syyksi laskettava riski antaa tietoa taudin todellisesta esiintymisestä väestössä (Muokattu viitteistä 2 ja 3 tekijän luvalla). Lisätietoa lukija saa epidemiologisia menetelmiä käsittelevästä tekstistä.
Tromboemboliset häiriöt ja muut verisuoniongelmat
Tromboembolia
Suun kautta otettavien ehkäisyvalmisteiden käyttöön liittyvä tromboembolisten ja tromboottisten sairauksien lisääntynyt riski on vakiintunut. Tapauskontrollitutkimukset ovat osoittaneet, että käyttäjien suhteellinen riski verrattuna ei-käyttäjiin on 3 pintalaskimotromboembolian ensimmäisessä episodissa, 4 - 11 syvän laskimotukoksen tai keuhkoembolian osalta ja 1,5 - 6 naisilla, joilla on altistava laskimotauti. tromboembolinen sairaus (2,3,19-24). Kohorttitutkimukset ovat osoittaneet, että suhteellinen riski on hieman pienempi, noin 3 uusissa tapauksissa ja noin 4,5 uusissa sairaalahoitoa vaativissa tapauksissa (25). Oraalisiin ehkäisyvalmisteisiin liittyvä tromboembolisen sairauden riski ei liity käytön pituuteen ja häviää pillereiden käytön lopettamisen jälkeen (2).
Useat epidemiologiset tutkimukset osoittavat, että kolmannen sukupolven ehkäisyvalmisteet, mukaan lukien desogestreeliä sisältävät ehkäisyvalmisteet, liittyvät suurempaan laskimotromboembolian riskiin kuin tietyt toisen sukupolven oraaliset ehkäisyvalmisteet (102–104). Yleensä nämä tutkimukset osoittavat suunnilleen kaksinkertaisen suurentunutta riskiä, mikä vastaa 1–2:ta ylimääräistä laskimotromboemboliatapausta 10 000 käyttövuotta kohden. Lisätutkimuksista saadut tiedot eivät kuitenkaan ole osoittaneet tätä kaksinkertaistaa riskiä.
Leikkauksen jälkeisten tromboembolisten komplikaatioiden suhteellinen riski on 2-4-kertainen lisääntynyt oraalisten ehkäisyvalmisteiden käytön yhteydessä (9,26). Suhteellinen laskimotromboosin riski naisilla, joilla on altistavia sairauksia, on kaksi kertaa suurempi kuin naisilla, joilla ei ole tällaisia sairauksia (9,26). Jos mahdollista, ehkäisyvalmisteiden käyttö tulee lopettaa vähintään neljä viikkoa ennen ja kahdeksi viikoksi sen jälkeen elektiivistä leikkausta, johon liittyy tromboembolian riskin lisääntyminen, sekä pitkittyneen immobilisaation aikana ja sen jälkeen. Koska myös välittömästi synnytyksen jälkeiseen aikaan liittyy lisääntynyt tromboembolian riski, ehkäisytablettien käyttö tulee aloittaa aikaisintaan neljä viikkoa synnytyksen jälkeen naisilla, jotka eivät halua imettää.
Sydäninfarkti
Suun kautta otettavien ehkäisyvalmisteiden käytön on katsottu suurentavan sydäninfarktin riskiä. Tämä riski on ensisijaisesti tupakoitsijoilla tai naisilla, joilla on muita sepelvaltimotaudin taustalla olevia riskitekijöitä, kuten verenpainetauti, hyperkolesterolemia, sairaalloinen liikalihavuus ja diabetes. Suhteellisen sydänkohtausriskin nykyisten ehkäisytablettien käyttäjien on arvioitu olevan kahdesta kuuteen (4–10). Riski on erittäin pieni alle 30-vuotiailla naisilla.
Tupakoinnin ja suun kautta otettavien ehkäisyvalmisteiden käytön on osoitettu lisäävän merkittävästi sydäninfarktin ilmaantuvuutta yli 30-vuotiailla naisilla, ja tupakoinnin osuus on suurin osa tapauksista (11). Verenkiertosairauksiin liittyvän kuolleisuuden on osoitettu lisääntyvän huomattavasti tupakoitsijoilla, yli 35-vuotiailla ja tupakoimattomilla yli 40-vuotiailla (taulukko III) suun kautta otettavien ehkäisyvalmisteita käyttävien naisten keskuudessa.
TAULUKKO III: VERIVERENKIERTOTAUTEIDEN KUOLLEET 100 000 NAISVUOTTA kohden IKÄN, TUPAKOINTITILANNEN JA SUUSUN EHKÄISYN KÄYTÖN MUKAAN
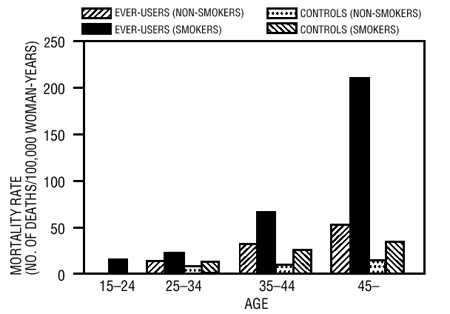
Mukautettu PM Laydesta ja V. Beralista, viite. #12.
Suun kautta otettavat ehkäisyvalmisteet voivat lisätä tunnettujen riskitekijöiden, kuten verenpainetaudin, diabeteksen, hyperlipidemioiden, iän ja liikalihavuuden, vaikutuksia (13). Erityisesti joidenkin progestogeenien tiedetään alentavan HDL-kolesterolia ja aiheuttavan glukoosi-intoleranssia, kun taas estrogeenit voivat aiheuttaa hyperinsulinismin tilan (14–18). Suun kautta otettavien ehkäisyvalmisteiden on osoitettu nostavan verenpainetta käyttäjien keskuudessa (ks VAROITUKSET ). Samanlaisia vaikutuksia riskitekijöihin on liitetty kohonneeseen sydänsairauksien riskiin. Suun kautta otettavia ehkäisyvalmisteita tulee käyttää varoen naisilla, joilla on sydän- ja verisuonitautien riskitekijöitä.
Aivoverenkierron sairaudet
Suun kautta otettavien ehkäisyvalmisteiden on osoitettu lisäävän aivoverisuonitapahtumien (tromboottisten ja verenvuotoa aiheuttavien aivohalvausten) sekä suhteellista että aiheellista riskiä, vaikka yleensä riski on suurin iäkkäillä (>35-vuotiailla) verenpainepotilailla, jotka myös tupakoivat. Hypertension havaittiin olevan riskitekijä sekä käyttäjille että ei-käyttäjille molemmissa aivohalvaustyypeissä, kun taas tupakointi lisäsi verenvuotohalvauksen riskiä (27–29).
Suuressa tutkimuksessa tromboottisten aivohalvausten suhteellisen riskin on osoitettu vaihtelevan 3:sta normotensiivisillä käyttäjillä 14:een potilailla, joilla on vaikea verenpaine (30). Hemorragisen aivohalvauksen suhteellisen riskin on raportoitu olevan 1,2 tupakoimattomilla, jotka käyttivät suun kautta otettavia ehkäisyvalmisteita, 2,6 tupakoitsijoilla, jotka eivät käyttäneet ehkäisyvalmisteita, 7,6 tupakoitsijoilla, jotka käyttivät ehkäisyvalmisteita, 1,8 normaalia verenpainetta käyttävillä ja 25,7 käyttäjillä, joilla on vaikea verenpaine ( 30). Syynä oleva riski on myös suurempi iäkkäillä naisilla (3).
Suun kautta otettavien ehkäisyvalmisteiden aiheuttama annoksesta riippuva verisuonisairauden riski
Positiivinen yhteys on havaittu oraalisten ehkäisyvalmisteiden estrogeenin ja progestiinin määrän ja verisuonisairauksien riskin välillä (31–33). Seerumin korkeatiheyksisten lipoproteiinien (HDL) vähenemistä on raportoitu monien progestatiivisten aineiden käytön yhteydessä (14–16). Seerumin korkeatiheyksisten lipoproteiinien väheneminen on yhdistetty iskeemisen sydänsairauden ilmaantuvuuden lisääntymiseen. Koska estrogeenit lisäävät HDL-kolesterolia, suun kautta otettavan ehkäisyvalmisteen nettovaikutus riippuu estrogeeni- ja progestiiniannosten välisestä tasapainosta ja ehkäisyvälineissä käytettyjen progestogeenien luonteesta ja absoluuttisesta määrästä. Molempien hormonien määrä tulee ottaa huomioon suun kautta otettavaa ehkäisyä valittaessa.
Estrogeeni- ja progestiinialtistuksen minimointi on terapeuttisten periaatteiden mukaista. Jollekin tietylle estrogeeni/progestogeeni-yhdistelmälle määrätyn annostusohjelman tulee olla sellainen, joka sisältää vähiten estrogeenia ja progestiinia, mikä on yhteensopiva alhaisen epäonnistumisasteen ja yksittäisen potilaan tarpeiden kanssa. Oraalisten ehkäisyvalmisteiden uusien vastaanottajien käyttö tulee aloittaa valmisteilla, jotka sisältävät 0,035 mg tai vähemmän estrogeenia.
Verisuonisairauksien riskin säilyminen
On olemassa kaksi tutkimusta, jotka ovat osoittaneet verisuonisairauksien riskin jatkuvan oraalisten ehkäisyvalmisteiden käyttäjillä. Yhdysvalloissa tehdyssä tutkimuksessa sydäninfarktin riski oraalisten ehkäisyvalmisteiden käytön lopettamisen jälkeen säilyy vähintään 9 vuotta 40–49-vuotiailla naisilla, jotka olivat käyttäneet suun kautta otettavia ehkäisyvalmisteita vähintään viisi vuotta, mutta tätä lisääntynyttä riskiä ei osoitettu muut ikäryhmät (8). Eräässä toisessa Isossa-Britanniassa tehdyssä tutkimuksessa riski sairastua aivoverisuonitautiin säilyi vähintään 6 vuotta ehkäisytablettien lopettamisen jälkeen, vaikka ylimääräinen riski oli hyvin pieni (34). Molemmat tutkimukset suoritettiin kuitenkin oraalisilla ehkäisyvalmisteilla, jotka sisälsivät 50 mikrogrammaa tai enemmän estrogeenia.
Arviot kuolleisuudesta ehkäisyvälineiden käytöstä
Eräässä tutkimuksessa kerättiin tietoja useista lähteistä, joissa on arvioitu eri ikäryhmien eri ehkäisymenetelmiin liittyvää kuolleisuutta (taulukko IV). Nämä arviot sisältävät ehkäisymenetelmiin liittyvän kuolemanriskin ja raskaudesta johtuvan riskin, jos menetelmä epäonnistuu. Jokaisella ehkäisymenetelmällä on omat etunsa ja riskinsä. Tutkimuksessa todettiin, että lukuun ottamatta 35-vuotiaita ja sitä vanhempia tupakoivia ja 40-vuotiaita ja sitä vanhempia, jotka eivät tupakoi, kaikkiin ehkäisymenetelmiin liittyvä kuolleisuus on alhainen ja pienempi kuin synnytykseen liittyvä kuolleisuus.
Havainto ehkäisyn käyttäjien kuolleisuusriskin mahdollisesta lisääntymisestä iän myötä perustuu 1970-luvulla kerättyihin tietoihin, mutta niistä on raportoitu vasta vuonna 1983 (35). Nykyinen kliininen käytäntö sisältää kuitenkin alemman estrogeenin formulaatioiden käytön yhdistettynä riskitekijöiden huolelliseen harkintaan.
Näiden käytännön muutosten ja myös joidenkin rajallisten uusien tietojen vuoksi, jotka viittaavat siihen, että sydän- ja verisuonitautien riski suun kautta otettavien ehkäisyvalmisteiden käytön yhteydessä saattaa nyt olla pienempi kuin aiemmin (100 101), hedelmällisyyden ja äitien terveyden lääkkeiden neuvoa-antava komitea päätettiin. Komitea totesi, että vaikka sydän- ja verisuonitautien riskit voivat lisääntyä suun kautta otettavien ehkäisyvalmisteiden käytön jälkeen 40 vuoden iän jälkeen terveillä tupakoimattomilla naisilla (jopa uudemmilla pieniannoksisilla formulaatioilla), mahdolliset terveysriskit ovat myös suurempia. jotka liittyvät iäkkäiden naisten raskauteen ja vaihtoehtoisiin kirurgisiin ja lääketieteellisiin toimenpiteisiin, jotka voivat olla tarpeellisia, jos näillä naisilla ei ole saatavilla tehokkaita ja hyväksyttäviä ehkäisykeinoja.
Siksi komitea suositteli, että terveiden yli 40-vuotiaiden tupakoimattomien naisten pieniannoksisesta ehkäisyvalmisteesta saatavat hyödyt voivat olla suuremmat kuin mahdolliset riskit. Tietenkin iäkkäiden naisten, kuten kaikkien naisten, jotka käyttävät suun kautta otettavia ehkäisyvalmisteita, tulee ottaa pienin mahdollinen annosmuoto, joka on tehokas.
TAULUKKO IV: SYNTYMISEEN TAI MENETELMIIN LIITTYVIEN HEDELMÄLLYYDEN HALLINTAAN LIITTYVIEN KULEMIEN VUOSImäärä 100 000 EI STERIILIÄ NAISTA kohden hedelmöitysmenetelmällä IKÄN MUKAISESTI
Sukuelinten ja rintojen karsinooma
Lukuisia epidemiologisia tutkimuksia on suoritettu rinta-, kohdun limakalvo-, munasarja- ja kohdunkaulasyövän esiintyvyydestä naisilla, jotka käyttävät oraalisia ehkäisyvalmisteita. Vaikka on olemassa ristiriitaisia raportteja, useimmat tutkimukset viittaavat siihen, että suun kautta otettavien ehkäisyvalmisteiden käyttö ei liity yleiseen rintasyövän kehittymisriskiin. Jotkut tutkimukset ovat raportoineet lisääntyneen suhteellisen riskin sairastua rintasyöpään erityisesti nuoremmalla iällä. Tämä lisääntynyt suhteellinen riski näyttää liittyvän käytön kestoon (36–43, 79–89).
Jotkut tutkimukset viittaavat siihen, että suun kautta otettavien ehkäisyvalmisteiden käyttö on yhdistetty kohdunkaulan intraepiteelin neoplasian riskiin joissakin naisryhmissä (45–48). Siitä huolimatta, missä määrin tällaiset havainnot voivat johtua eroista seksuaalisessa käyttäytymisessä ja muista tekijöistä, on edelleen kiistaa.
Maksan neoplasia
Hyvänlaatuiset maksaadenoomit liittyvät oraalisten ehkäisyvalmisteiden käyttöön, vaikka hyvänlaatuisten kasvainten ilmaantuvuus on harvinaista Yhdysvalloissa. Epäsuorat laskelmat ovat arvioineet käyttäjien aiheuttaman riskin olevan alueella 3,3 tapausta/100 000, mikä riski kasvaa neljän tai useamman vuoden käytön jälkeen erityisesti suuremman annoksen oraalisilla ehkäisyvalmisteilla (49). Harvinaisten hyvänlaatuisten maksaadenoomien repeämä voi aiheuttaa kuoleman vatsansisäisen verenvuodon kautta (50,51).
Isossa-Britanniassa tehdyt tutkimukset ovat osoittaneet lisääntyneen maksasolusyövän (52–54) riskin pitkäaikaisilla (> 8-vuotiailla) oraalisten ehkäisyvalmisteiden käyttäjillä. Nämä syövät ovat kuitenkin erittäin harvinaisia Yhdysvalloissa, ja maksasyöpien aiheuttama riski (ylimääräinen ilmaantuvuus) suun kautta otettavien ehkäisyvalmisteiden käyttäjillä on alle yksi miljoonaa käyttäjää kohden.
Silmävauriot
On raportoitu kliinisiä tapauksia verkkokalvon tromboosista, joka liittyy oraalisten ehkäisyvalmisteiden käyttöön. Suun kautta otettavien ehkäisyvalmisteiden käyttö tulee lopettaa, jos näön menetys on selittämätön osittainen tai kokonaan. proptoosin tai diplopian puhkeaminen; papillideema; tai verkkokalvon verisuonivauriot. Asianmukaisiin diagnostisiin ja terapeuttisiin toimenpiteisiin on ryhdyttävä välittömästi.
Suun kautta otettavan ehkäisyn käyttö ennen raskautta tai sen alkuvaiheessa
Laajat epidemiologiset tutkimukset eivät ole osoittaneet lisääntynyttä synnynnäisten epämuodostumien riskiä naisilla, jotka ovat käyttäneet ehkäisyä ennen raskautta (55–57). Tutkimukset eivät myöskään viittaa teratogeeniseen vaikutukseen, etenkään mitä tulee sydämen poikkeavuuksiin ja raajojen pienenemishäiriöihin (55, 56, 58, 59), kun oraaliset ehkäisyvalmisteet otetaan vahingossa raskauden alkuvaiheessa.
Suun kautta otettavien ehkäisyvalmisteiden käyttöä vieroitusverenvuotoa varten ei tule käyttää raskaustestinä. Suun kautta otettavia ehkäisyvalmisteita ei tule käyttää raskauden aikana uhkaavan tai tavanomaisen abortin hoitoon. On suositeltavaa, että jokaiselle potilaalle, jolta on jäänyt kaksi peräkkäistä kuukautisia väliin, raskaus suljetaan pois ennen ehkäisyvalmisteen käytön jatkamista. Jos potilas ei ole noudattanut määrättyä aikataulua, raskauden mahdollisuus tulee ottaa huomioon ensimmäisten kuukautisten välissä. Suun kautta otettavien ehkäisyvalmisteiden käyttö tulee lopettaa, kunnes raskaus on suljettu pois.
Sappirakon sairaus
Aiemmissa tutkimuksissa on raportoitu lisääntyneen elinikäisen sappirakkoleikkauksen suhteellisen riskin oraalisten ehkäisyvalmisteiden ja estrogeenien käyttäjillä (60, 61). Uusimmat tutkimukset ovat kuitenkin osoittaneet, että suhteellinen riski sairastua sappirakon sairauksiin suun kautta otettavien ehkäisyvalmisteiden käyttäjien keskuudessa voi olla minimaalinen (62–64). Viimeaikaiset havainnot minimaalisesta riskistä voivat liittyä oraalisten ehkäisyvalmisteiden käyttöön, jotka sisältävät pienempiä hormonaalisia annoksia estrogeenia ja progestogeeneja.
Hiilihydraattien ja lipidien metaboliset vaikutukset
Suun kautta otettavien ehkäisyvalmisteiden on osoitettu heikentävän glukoosinsietokykyä merkittävällä osalla käyttäjistä (17). Yli 75 mikrogrammaa estrogeenia sisältävät suun kautta otettavat ehkäisyvalmisteet aiheuttavat hyperinsulinismia, kun taas pienemmät estrogeeniannokset aiheuttavat vähemmän glukoosi-intoleranssia (65). Progestogeenit lisäävät insuliinin eritystä ja synnyttävät insuliiniresistenssiä, tämä vaikutus vaihtelee eri progestatiivisten aineiden mukaan (17,66). Ei-diabeettisella naisella oraalisilla ehkäisyvalmisteilla ei kuitenkaan näytä olevan vaikutusta paastoverensokeriarvoon (67). Näiden todistettujen vaikutusten vuoksi prediabeettisia ja diabeettisia naisia tulee seurata huolellisesti oraalisten ehkäisyvalmisteiden käytön aikana.
Pienellä osalla naisista on jatkuva hypertriglyseridemia pillereiden käytön aikana. Kuten aiemmin mainittiin (katso VAROITUKSET ), seerumin triglyseridi- ja lipoproteiinipitoisuuksia on raportoitu oraalisten ehkäisyvalmisteiden käyttäjillä.
Kohonnut verenpaine
Verenpaineen nousua on raportoitu naisilla, jotka käyttävät suun kautta otettavia ehkäisyvalmisteita (68), ja tämä nousu on todennäköisempää iäkkäillä ehkäisytablettien käyttäjillä (69) ja käytön jatkuessa (61). Royal College of General Practitionersin (12) tiedot ja myöhemmät satunnaistetut tutkimukset ovat osoittaneet, että verenpainetaudin ilmaantuvuus lisääntyy progestogeenien lisääntyessä.
Naisia, joilla on ollut verenpainetauti tai verenpaineeseen liittyviä sairauksia tai munuaissairaus (70), tulee rohkaista käyttämään jotakin muuta ehkäisymenetelmää. Jos naiset päättävät käyttää ehkäisyvalmisteita, heitä on seurattava tarkoin, ja jos verenpaine kohoaa merkittävästi, suun kautta otettavien ehkäisyvalmisteiden käyttö on lopetettava. Useimmilla naisilla kohonnut verenpaine palautuu normaaliksi suun kautta otettavien ehkäisyvalmisteiden lopettamisen jälkeen (69), eikä verenpainetaudin esiintymisessä ole eroa aina ja ei koskaan käyttäneiden välillä (68, 70, 71).
Päänsärky
Migreenin puhkeaminen tai paheneminen tai päänsäryn kehittyminen uudella tavalla, joka on toistuva, jatkuva tai vaikea, vaatii ehkäisyvalmisteiden käytön lopettamista ja syyn selvittämistä.
Verenvuotohäiriöt
Oraalista ehkäisyvalmistetta käyttävillä potilailla esiintyy joskus läpimurto- ja tiputteluvuotoa, erityisesti kolmen ensimmäisen käyttökuukauden aikana. Ei-hormonaaliset syyt on otettava huomioon ja ryhdyttävä riittäviin diagnostisiin toimenpiteisiin pahanlaatuisuuden tai raskauden poissulkemiseksi läpilyöntiverenvuodon yhteydessä, kuten minkä tahansa epänormaalin emättimen verenvuodon tapauksessa. Jos patologia on suljettu pois, aika tai muutos toiseen formulaatioon voi ratkaista ongelman. Amenorrean tapauksessa raskaus on suljettava pois.
Jotkut naiset voivat kohdata pillereiden jälkeistä amenorreaa tai oligomenorreaa, varsinkin kun tällainen tila on ollut olemassa.
Kohdunulkoinen raskaus
Kohdunulkoinen ja kohdunsisäinen raskaus voi ilmetä, jos ehkäisy epäonnistuu.
VAROTOIMENPITEET
Kenraali
Potilaita tulee neuvoa, että tämä tuote ei suojaa HIV-infektiolta (AIDS) ja muilta sukupuolitaudeilta.
Fyysinen tarkastus ja seuranta
On hyvä lääketieteellinen käytäntö, että kaikki naiset käyvät vuosittain anamneesissa ja lääkärintarkastuksessa, myös suun kautta otettavia ehkäisyvalmisteita käyttävät naiset. Fyysistä tarkastusta voidaan kuitenkin lykätä suun kautta otettavien ehkäisyvalmisteiden käytön aloittamisen jälkeen, jos nainen sitä pyytää ja kliinikko katsoo sopivaksi. Fyysisessä tutkimuksessa tulee erityisesti huomioida verenpaine, rinnat, vatsa ja lantion elimet, mukaan lukien kohdunkaulan sytologia, ja asiaankuuluvat laboratoriotutkimukset. Jos emättimestä ilmenee diagnosoimatonta, jatkuvaa tai toistuvaa epänormaalia verenvuotoa, on ryhdyttävä asianmukaisiin toimenpiteisiin pahanlaatuisten kasvainten poissulkemiseksi. Naisia, joilla on vahva suvussa rintasyöpä tai joilla on rintakyhmyjä, tulee seurata erityisen huolellisesti.
Lipidihäiriöt
Naisia, joita hoidetaan hyperlipidemioiden vuoksi, tulee seurata tarkasti, jos he päättävät käyttää suun kautta otettavia ehkäisyvalmisteita. Jotkut progestogeenit voivat nostaa LDL-tasoja ja vaikeuttaa hyperlipidemioiden hallintaa.
Maksan toiminta
Jos jollakin tällaisia lääkkeitä saaneella naisella kehittyy keltaisuutta, lääkitys on lopetettava. Steroidihormonit saattavat metaboloitua heikosti potilailla, joilla on maksan vajaatoiminta.
Nesteenpidätys
Suun kautta otettavat ehkäisyvalmisteet voivat aiheuttaa jonkin verran nesteretentiota. Niitä tulee määrätä varoen ja vain huolellisella seurannalla potilaille, joilla on sairauksia, joita nesteretentio saattaa pahentaa.
Emotionaaliset häiriöt
Naisia, joilla on aiemmin ollut masennusta, tulee tarkkailla huolellisesti ja lääkkeen käyttö lopettaa, jos masennus uusiutuu vakavasti.
Piilolinssit
Silmälääkärin tulee arvioida piilolinssien käyttäjien, joille kehittyy näkömuutoksia tai muutoksia linssien sietokyvyssä.
Karsinogeneesi
Katso VAROITUKSET osio.
Raskaus
Raskauskategoria X (ks VASTA-AIHEET ja VAROITUKSET osiot).
Imettävät äidit
Pieniä määriä oraalisia ehkäisyvalmisteita on havaittu imettävien äitien maidosta, ja muutamia lapseen kohdistuvia haittavaikutuksia on raportoitu, mukaan lukien keltaisuus ja rintojen suureneminen. Lisäksi synnytyksen jälkeen annetut ehkäisyvalmisteet voivat häiritä imetystä heikentämällä rintamaidon määrää ja laatua. Jos mahdollista, imettävää äitiä tulee neuvoa olemaan käyttämättä suun kautta otettavia ehkäisyvalmisteita vaan käyttämään muita ehkäisymenetelmiä, kunnes hän on täysin vieroittanut lapsensa.
Lasten käyttö
Mircette®-tablettien (desogestreeli/etinyyliestradioli ja etinyyliestradioli) -tablettien turvallisuus ja tehokkuus on osoitettu lisääntymisikäisillä naisilla. Turvallisuuden ja tehon odotetaan olevan sama alle 16-vuotiailla murrosikäisillä nuorilla ja 16-vuotiailla ja sitä vanhemmilla käyttäjillä. Tämän tuotteen käyttöä ennen kuukautisia ei ole tarkoitettu.
Tietoja potilaalle
Katso Potilaan merkintä
VIITTEET
1. Hatcher RA, Trussell J, Stewart F et ai. Ehkäisytekniikka: Seitsemäntoista tarkistettu painos, New York: Irvington Publishers, 1998, painossa.
2. Stadel BV. Suun kautta otettavat ehkäisyvalmisteet ja sydän- ja verisuonisairaudet. (Pt. 1). N Engl J Med 1981; 305:612–618.
3. Stadel BV. Suun kautta otettavat ehkäisyvalmisteet ja sydän- ja verisuonisairaudet. (Pt. 2). N Engl J Med 1981; 305:672-677.
4. Adam SA, Thorogood M. Suun kautta otettava ehkäisy ja sydäninfarkti uudelleen: uusien valmisteiden vaikutukset ja lääkemääräystavat. Br. J. Obstet ja Gynecol 1981; 88:838–845.
5. Mann JI, Inman WH. Suun kautta otettavat ehkäisyvalmisteet ja kuolema sydäninfarktista. Br Med J 1975; 2(5965):245–248.
6. Mann JI, Vessey MP, Thorogood M, Doll R. Sydäninfarkti nuorilla naisilla erityisesti suun kautta otettavien ehkäisymenetelmien osalta. Br Med J 1975; 2(5956):241–245.
7. Royal College of General Practitioners' Oral Contraception Study: Lisäanalyysejä suun kautta otettavien ehkäisyvalmisteiden käyttäjien kuolleisuudesta. Lancet 1981; 1:541–546.
8. Slone D, Shapiro S, Kaufman DW, Rosenberg L, Miettinen OS, Stolley PD. Sydäninfarktin riski nykyisen ja lopetetun ehkäisytablettien käytön yhteydessä. N Engl J Med 1981; 305:420–424.
9. Vessey kansanedustaja. Naishormonit ja verisuonisairaudet – epidemiologinen katsaus. Br J Fam Plann 1980; 6:1–12.
10. Russell-Briefel RG, Ezzati TM, Fulwood R, Perlman JA, Murphy RS. Kardiovaskulaarinen riskitila ja suun kautta otettavien ehkäisyvälineiden käyttö, Yhdysvallat, 1976–80. Prevent Med 1986; 15:352–362.
11. Goldbaum GM, Kendrick JS, Hogelin GC, Gentry EM. Tupakoinnin ja ehkäisyvälineiden käytön suhteellinen vaikutus naisiin Yhdysvalloissa. JAMA 1987; 258:1339–1342.
12. Layde PM, Beral V. Lisäanalyysejä suun kautta otettavien ehkäisyvalmisteiden käyttäjien kuolleisuudesta: Royal College General Practitioners' Oral Contraception Study. (Taulukko 5) Lancet 1981; 1:541–546.
13. Knopp RH. Valtimotautiriski: suun kautta otettavien ehkäisyvalmisteiden ja postmenopausaalisten estrogeenien roolit. J Reprod Med 1986; 31(9) (täydennys):913–921.
14. Krauss RM, Roy S, Mishell DR, Casagrande J, Pike MC. Kahden pieniannoksisen oraalisen ehkäisyvalmisteen vaikutukset seerumin lipideihin ja lipoproteiineihin: Differentiaaliset muutokset suuritiheyksisten lipoproteiinien alaluokissa. Am J Obstet 1983; 145:446-452.
15. Wahl P, Walden C, Knopp R, Hoover J, Wallace R, Heiss G, Rifkind B. Estrogeenin/progestiinitehokkuuden vaikutus lipidi-/lipoproteiinikolesteroliin. N Engl J Med 1983; 308:862-867.
16. Wynn V, Niththyananthan R. Progestiinin vaikutus yhdistetyissä oraalisissa ehkäisyvalmisteissa seerumin lipideihin, erityisesti korkeatiheyksisiin lipoproteiineihin. Am J Obstet Gynecol 1982; 142:766-771.
17. Wynn V, Godsland I. Suun kautta otettavien ehkäisyvalmisteiden ja hiilihydraattiaineenvaihdunnan vaikutukset. J Reprod Med 1986; 31 (9) (täydennys):892–897.
18. LaRosa JC. Ateroskleroottiset riskitekijät sydän- ja verisuonisairauksissa. J Reprod Med 1986; 31 (9) (täydennys):906–912.
19. Inman WH, Vessey kansanedustaja. Hedelmällisessä iässä olevien naisten keuhko-, sepelvaltimo- ja aivotromboosi- ja emboliakuolemien tutkiminen. Br Med J 1968; 2 (5599):193–199.
20. Maguire MG, Tonascia J, Sartwell PE, Stolley PD, Tockman MS. Suun kautta otettavien ehkäisyvalmisteiden aiheuttama tromboosin riski: lisäraportti. Am J. Epidemiol 1979; 110 (2):188–195.
21. Pettiti DB, Wingerd J, Pellegrin F, Ramacharan S. Verisuonitautien riski naisilla: tupakointi, suun kautta otettavat ehkäisyvalmisteet, ei-ehkäisy estrogeenit ja muut tekijät. JAMA 1979; 242:1150–1154.
22. Vessey MP, Doll R. Oraalisten ehkäisyvalmisteiden käytön ja tromboembolisen sairauden välisen suhteen tutkiminen. Br Med J 1968; 2 (5599):199–205.
23. Vessey MP, Doll R. Oraalisten ehkäisyvalmisteiden käytön ja tromboembolisen sairauden välisen suhteen tutkiminen. Lisäraportti. Br Med J 1969; 2 (5658): 651–657.
24. Porter JB, Hunter JR, Danielson DA, Jick H, Stergachis A. Suun kautta otettavat ehkäisyvalmisteet ja ei-kuolemaan johtavat verisuonisairaudet – viimeaikainen kokemus. Obstet Gynecol 1982; 59 (3): 299–302.
25. Vessey M, Doll R, Peto R, Johnson B, Wiggins P. Pitkäaikainen seurantatutkimus naisista, jotka käyttävät erilaisia ehkäisymenetelmiä: väliraportti. Biosocial Sci 1976; 8:375–427.
26. Royal College of General Practitioners: Suun kautta otettavat ehkäisyvalmisteet, laskimotukos ja suonikohjut. J Royal Coll Gen Pract 1978; 28:393–399.
27. Yhteistyöryhmä nuorten naisten aivohalvauksen tutkimiseksi: Suun kautta otettava ehkäisy ja lisääntynyt aivoiskemian tai tromboosin riski. N Engl J Med 1973; 288:871-878.
28. Petitti DB, Wingerd J. Suun kautta otettavien ehkäisyvalmisteiden käyttö, tupakointi ja subarachnoidaalisen verenvuodon riski. Lancet 1978; 2:234–236.
29. Inman WH. Suun kautta otettavat ehkäisyvalmisteet ja kohtalokas subarachnoidaalinen verenvuoto. Br Med J 1979; 2 (6203):1468–70.
30. Yhteistyöryhmä nuorten naisten aivohalvauksen tutkimiseksi: Suun kautta otettavat ehkäisyvalmisteet ja nuorten naisten aivohalvaus: niihin liittyvät riskitekijät. JAMA 1975; 231:718-722.
31. Inman WH, Vessey MP, Westerholm B, Engelund A. Tromboembolinen sairaus ja suun kautta otettavien ehkäisyvalmisteiden steroidipitoisuus. Mietintö huumeturvallisuusvaliokunnalle. Br Med J 1970; 2:203–209.
32. Meade TW, Greenberg G, Thompson SG. Oraalisiin ehkäisyvalmisteisiin liittyvät progestogeenit ja sydän- ja verisuonireaktiot sekä 50 ja 35 mikrogramman estrogeenivalmisteiden turvallisuuden vertailu. Br Med J 1980; 280 (6224): 1157–1161.
33. Kay CR. Progestogeenit ja valtimotaudit – todisteita Royal College of General Practitioners' -tutkimuksesta. Am J Obstet Gynecol 1982; 142:762-765.
34. Royal College of General Practitioners: Valtimosairauksien ilmaantuvuus oraalisten ehkäisyvalmisteiden käyttäjien keskuudessa. J Royal Coll Gen Pract 1983; 33:75–82.
35. Ory HW. Hedelmällisyyteen ja hedelmällisyyden hallintaan liittyvä kuolleisuus: 1983. Family Planning Perspectives 1983; 15.50-56.
36. Syöpä- ja steroidihormonitutkimus Centers for Disease Control ja National Institute of Child Health and Human Development: Suun kautta otettavien ehkäisyvälineiden käyttö ja rintasyövän riski. N Engl J Med 1986; 315:405–411.
37. Pike MC, Henderson BE, Krailo MD, Duke A, Roy S. Rintasyövän riski nuorilla naisilla ja suun kautta otettavien ehkäisyvalmisteiden käyttö: mahdollinen formulaatiota ja ikää muuttava vaikutus käytössä. Lancet 1983; 2:926–929.
38. Paul C, Skegg DG, Spears GFS, Kaldor JM. Suun kautta otettavat ehkäisyvalmisteet ja rintasyöpä: kansallinen tutkimus. Br Med J 1986; 293:723-725.
39. Miller DR, Rosenberg L, Kaufman DW, Schottenfeld D, Stolley PD, Shapiro S. Rintasyövän riski suhteessa varhaiseen oraalisten ehkäisyvälineiden käyttöön. Obstet Gynecol 1986; 68:863-868.
40. Olson H, Olson KL, Moller TR, Ranstam J, Holm P. Oraalisen ehkäisyn käyttö ja rintasyöpä nuorilla naisilla Ruotsissa (kirje). Lancet 1985; 2:748–749.
41. McPherson K, Vessey M, Neil A, Doll R, Jones L, Roberts M. Varhainen ehkäisyvälineiden käyttö ja rintasyöpä: Tulokset toisesta tapauskontrollitutkimuksesta. Br J Cancer 1987; 56:653–660
42. Huggins GR, Zucker PF. Suun kautta otettavat ehkäisyvalmisteet ja neoplasia: vuoden 1987 päivitys. Fertil Steril 1987; 47:733–761.
43. McPherson K, Drife JO. Pillerit ja rintasyöpä: miksi epävarmuus? Br Med J 1986; 293:709–710.
45. Ory H, Naib Z, Conger SB, Hatcher RA, Tyler CW. Ehkäisyvälineiden valinta ja kohdunkaulan dysplasian ja karsinooman esiintyvyys in situ. Am J Obstet Gynecol 1976; 124:573-577.
46. Vessey MP, Lawless M, McPherson K, Yeates D. Kohdunkaulan neoplasia ja ehkäisy: pillereiden mahdollinen haittavaikutus. Lancet 1983; 2:930.
47. Brinton LA, Huggins GR, Lehman HF, Malli K, Savitz DA, Trapido E, Rosenthal J, Hoover R. Suun kautta otettavien ehkäisyvalmisteiden pitkäaikainen käyttö ja invasiivisen kohdunkaulan syövän riski. Int J Cancer 1986; 38:339–344.
48. WHO:n yhteistyötutkimus neoplasiasta ja steroidiehkäisyvalmisteista: invasiivinen kohdunkaulan syöpä ja yhdistelmäehkäisytabletit. Br Med J 1985; 209:961–965.
49. Rooks JB, Ory HW, Ishak KG, Strauss LT, Greenspan JR, Hill AP, Tyler CW. Hepatosellulaarisen adenooman epidemiologia: suun kautta otettavan ehkäisyn rooli. JAMA 1979; 242:644–648.
50. Bein NN, Goldsmith HS. Toistuva massiivinen verenvuoto hyvänlaatuisista maksakasvaimista, jotka johtuvat suun kautta otetuista ehkäisyvalmisteista. Br J Surg 1977; 64:433–435.
51. Klatskin G. Maksakasvaimet: mahdollinen yhteys suun kautta otettavien ehkäisyvalmisteiden käyttöön. Gastroenterology 1977; 73:386-394.
52. Henderson BE, Preston-Martin S, Edmondson HA, Peters RL, Pike MC. Hepatosellulaarinen syöpä ja suun kautta otettavat ehkäisyvalmisteet. Br J Cancer 1983; 48:437–440.
53. Neuberger J, Forman D, Doll R, Williams R. Oral kontraceptives and hepatosellular carcinoma. Br Med J 1986; 292:1355–1357.
54. Forman D, Vincent TJ, Doll R. Maksasyöpä ja suun kautta otettavat ehkäisyvalmisteet. Br Med J 1986; 292:1357–1361.
55. Harlap S, Eldor J. Synnytykset suun kautta otetun ehkäisyn epäonnistumisen jälkeen. Obstet Gynecol 1980; 55:447–452.
56. Savolainen E, Saksela E, Saxen L. Oraalisten ehkäisyvalmisteiden teratogeeniset vaarat analysoitu kansallisessa epämuodostuneisuusrekisterissä. Am J Obstet Gynecol 1981; 140:521-524.
57. Janerich DT, Piper JM, Glebatis DM. Suun kautta otettavat ehkäisyvalmisteet ja synnynnäiset epämuodostumat. Am J. Epidemiol 1980; 112:73–79.
58. Ferencz C, Matanoski GM, Wilson PD, Rubin JD, Neill CA, Gutberlet R. Äidin hormonihoito ja synnynnäinen sydänsairaus. Teratology 1980; 21:225–239.
59. Rothman KJ, Fyler DC, Goldbatt A, Kreidberg MB. Eksogeeniset hormonit ja muut lääkealtistukset lapsilla, joilla on synnynnäinen sydänsairaus. Am J. Epidemiol 1979; 109:433–439.
60. Boston Collaborative Drug Surveillance Program: Suun kautta otettavat ehkäisyvalmisteet ja laskimotromboembolinen sairaus, kirurgisesti vahvistettu sappirakon sairaus ja rintakasvaimet. Lancet 1973; 1:1399–1404.
61. Royal College of General Practitioners: Suun kautta otettavat ehkäisyvalmisteet ja terveys. New York, Pittman, 1974.
62. Layde PM, Vessey MP, Yeates D. Sappirakon sairauden riski: kohorttitutkimus nuorista naisista, jotka käyvät perhesuunnitteluklinikoilla. J Epidemiol Community Health 1982; 36:274–278.
63. Rome Group for the Epidemiology and Prevention of Colelitiasis (GREPCO): Sappikivitaudin esiintyvyys italialaisessa aikuisväestössä. Am J. Epidemiol 1984; 119:796-805.
64. Strom BL, Tamragouri RT, Morse ML, Lazar EL, West SL, Stolley PD, Jones JK. Suun kautta otettavat ehkäisyvalmisteet ja muut sappirakon sairauden riskitekijät. Clin Pharmacol Ther 1986; 39:335–341.
65. Wynn V, Adams PW, Godsland IF, Melrose J, Niththyananthan R, Oakley NW, Seedj A. Erilaisten yhdistettyjen oraalisten ehkäisyvalmisteiden vaikutusten vertailu hiilihydraatti- ja lipidiaineenvaihduntaan. Lancet 1979; 1:1045–1049.
66. Wynn V. Progesteronin ja progestiinien vaikutus hiilihydraattiaineenvaihduntaan. Progesteronissa ja progestiinissa. Toimittanut Bardin CW, Milgrom E, Mauvis-Jarvis P. New York, Raven Press, 1983, s. 395–410.
67. Perlman JA, Roussell-Briefel RG, Ezzati TM, Lieberknecht G. Suun glukoositoleranssi ja oraalisten ehkäisyvalmisteiden progestogeenien teho. J Chronic Dis 1985; 38:857-864.
68. Royal College of General Practitioners' Oral Contraception Study: Vaikutus kohonneeseen verenpaineeseen ja hyvänlaatuiseen rintasairauteen progestiinikomponentin yhdistelmäehkäisyvalmisteissa. Lancet 1977;
69. Fisch IR, Frank J. Oraaliset ehkäisyvalmisteet ja verenpaine. JAMA 1977; 237:2499–2503.
70. Laragh AJ. Suun kautta otettava ehkäisy aiheutti verenpainetaudin - yhdeksän vuotta myöhemmin. Am J Obstet Gynecol 1976; 126:141–147.
71. Ramcharan S, Peritz E, Pellegrin FA, Williams WT. Verenpainetaudin esiintyvyys Walnut Creekin ehkäisylääkkeiden tutkimuksen kohortissa. Steroidiehkäisylääkkeiden farmakologiassa. Garattini S, Berendes HW. toim. New York, Raven Press, 1977, s. 277–288. (Mario Negrin farmakologisen tutkimuksen instituutin monografioita, Milano).
73. Syöpä- ja steroidihormonitutkimus Centers for Disease Control ja National Institute of Child Health and Human Development: Suun kautta otettavien ehkäisyvälineiden käyttö ja munasarjasyövän riski. JAMA 1983; 249:1596–1599.
79. Schlesselman J, Stadel BV, Murray P, Lai S. Breast Cancer suhteessa oraalisten ehkäisyvalmisteiden varhaiseen käyttöön 1988; 259:1828–1833.
80. Hennekens CH, Speizer FE, Lipnick RJ, Rosner B, Bain C, Belanger C, Stampfer MJ, Willett W, Peto R. Tapauskontrolloitu tutkimus suun kautta otettavien ehkäisyvalmisteiden käytöstä ja rintasyövästä. JNCI 1984; 72:39–42.
81. LaVecchia C, Decarli A, Fasoli M, Franceschi S, Gentile A, Negri E, Parazzini F, Tognoni G. Suun kautta otettavat ehkäisyvalmisteet ja rintojen ja naisten sukupuolielinten syövät. Välitulokset tapaus-verrokkitutkimuksesta. Br. J. Cancer 1986; 54:311-317.
82. Meirik O, Lund E, Adami H, Bergstrom R, Christoffersen T, Bergsjo P. Oral contraceptive use in breast cancer in young women. Joint National Case-control -tutkimus Ruotsissa ja Norjassa. Lancet 1986; 11:650–654.
83. Kay CR, Hannaford PC. Rintasyöpä ja pilleri – lisäraportti Royal College of General Practitionersin suun kautta otettavasta ehkäisytutkimuksesta. Br. J. Cancer 1988; 58:675–680.
84. Stadel BV, Lai S, Schlesselman JJ, Murray P. Suun kautta otettavat ehkäisyvalmisteet ja menopaussia edeltävä rintasyöpä synnyttämättömillä naisilla. Ehkäisy 1988; 38:287–299.
85. Miller DR, Rosenberg L, Kaufman DW, Stolley P, Warshauer ME, Shapiro S. Rintasyöpä ennen 45 vuoden ikää ja suun kautta otettavien ehkäisyvälineiden käyttö: uusia havaintoja. Olen. J. Epidemiol 1989; 129:269–280.
86. UK National Case-Control Study Group, Suun kautta otettavien ehkäisyvälineiden käyttö ja rintasyövän riski nuorilla naisilla. Lancet 1989; 1:973–982.
87. Schlesselman JJ. Rintojen ja sukupuolielinten syöpä suun kautta otettavien ehkäisyvalmisteiden käytön yhteydessä. Ehkäisy 1989; 40:1–38.
88. Vessey MP, McPherson K, Villard-Mackintosh L, Yeates D. Suun kautta otettavat ehkäisyvalmisteet ja rintasyöpä: uusimmat havainnot suuressa kohorttitutkimuksessa. Br. J. Cancer 1989; 59:613–617.
89. Jick SS, Walker AM, Stergachis A, Jick H. Suun kautta otettavat ehkäisyvalmisteet ja rintasyöpä. Br. J. Cancer 1989; 59:618–621.
100. Porter JB, Hunter J, Jick H et ai. Suun kautta otettavat ehkäisyvalmisteet ja ei-kuolemaan johtavat verisuonisairaudet. Obstet Gynecol 1985; 66:1–4.
101. Porter JB, Jick H, Walker AM. Oraalisten ehkäisyvalmisteiden käyttäjien kuolleisuus. Obstet Gynecol 1987; 7029–32.
102. Jick H, Jick SS, Gurewich V, Myers MW, Vasilakis C. Idiopaattisen kardiovaskulaarisen kuoleman ja ei-fataalin laskimotromboembolian riski naisilla, jotka käyttävät oraalisia ehkäisyvalmisteita, joissa on erilaisia progestiinikomponentteja. Lancet, 1995; 346:1589–93.
103. Maailman terveysjärjestön sydän- ja verisuonisairauksien ja steroidihormoniehkäisyn yhteistyötutkimus. Eri progestageenien vaikutus matalan estrogeenin oraalisissa ehkäisyvalmisteissa laskimotromboemboliseen sairauteen. Lancet, 1995; 346:1582–88.
104. Spitzer WO, Lewis MA, Heinemann LAJ, Thorogood M, MacRae KD Transnational Research Group on Oral Contraceptives and Health of Young Women puolesta. Kolmannen sukupolven oraaliset ehkäisyvalmisteet ja laskimotromboembolisten häiriöiden riski: kansainvälinen tapaus-kontrollitutkimus. Br Med J, 1996; 312:83–88.
105. Christensen J, Petrenaite V, Atterman J, et ai. Suun kautta otettavat ehkäisyvalmisteet indusoivat lamotrigiinimetaboliaa: näyttöä kaksoissokkoutetusta lumekontrolloidusta tutkimuksesta. Epilepsia 2007;48(3):484-489.
YLIANNOSTUS
Vakavia haittavaikutuksia ei ole raportoitu pienten lasten suurten oraalisten ehkäisyvalmisteiden akuutin nielemisen jälkeen. Yliannostus voi aiheuttaa pahoinvointia, ja naisilla voi esiintyä vieroitusvuotoa.
Terveyshyödyt ilman ehkäisyä
Epidemiologiset tutkimukset, joissa suurelta osin hyödynnettiin ehkäisyvalmisteita, jotka sisälsivät estrogeeniannoksia yli 0,035 mg etinyyliestradiolia tai 0,05 mg mestranolia (73–78), tukevat seuraavia oraalisten ehkäisyvalmisteiden käyttöön liittyviä terveyshyötyjä.
Vaikutukset kuukautisiin
- lisääntynyt kuukautiskierron säännöllisyys
- vähentynyt verenhukka ja vähentynyt raudanpuuteanemian ilmaantuvuus
- dysmenorrean esiintyvyys väheni
Ovulaation estoon liittyvät vaikutukset
- toiminnallisten munasarjakystojen vähentynyt esiintyvyys
- kohdunulkoisten raskauksien esiintyvyys on vähentynyt
Vaikutukset pitkäaikaisesta käytöstä
- fibroadenoomien ja rintojen fibrokystisen sairauden esiintyvyyden väheneminen
- akuutin lantion alueen tulehdussairauden ilmaantuvuus on vähentynyt
- vähentynyt kohdun limakalvon syövän ilmaantuvuus
- vähentynyt munasarjasyövän ilmaantuvuus
VASTA-AIHEET
Suun kautta otettavia ehkäisyvalmisteita ei pidä käyttää naisilla, joilla on tällä hetkellä seuraavat sairaudet:
- Tromboflebiitti tai tromboemboliset häiriöt
- Aiempi syvä laskimotromboflebiitti tai tromboemboliset häiriöt
- Aivo- tai sepelvaltimotauti
- Tunnettu tai epäilty rintasyöpä
- Endometriumin karsinooma tai muu tunnettu tai epäilty estrogeeniriippuvainen neoplasia
- Diagnosoimaton epänormaali sukuelinten verenvuoto
- Kolestaattinen keltaisuus raskauden aikana tai keltaisuus aiemman pillereiden käytön yhteydessä
- Maksan adenoomat tai karsinoomat
- Tunnettu tai epäilty raskaus
KLIININEN FARMAKOLOGIA
Suun kautta otettavat yhdistelmäehkäisyvalmisteet estävät gonadotropiinien määrää. Vaikka tämän vaikutuksen ensisijainen mekanismi on ovulaation estäminen, muita muutoksia ovat muutokset kohdunkaulan limassa (jotka vaikeuttavat siittiöiden pääsyä kohtuun) ja endometriumissa (jotka vähentävät implantaation todennäköisyyttä).
Reseptorisitoutumistutkimukset sekä eläintutkimukset ovat osoittaneet, että etonogestreelillä, desogestreelin biologisesti aktiivisella metaboliitilla, yhdistyy korkea progestaatioaktiivisuus minimaaliseen luontaiseen androgeenisuuteen (91,92). Tämän jälkimmäisen löydön merkitystä ihmisille ei tunneta.
Farmakokinetiikka
Imeytyminen
Desogestreeli imeytyy nopeasti ja lähes täydellisesti ja muuttuu etonogestreeliksi, sen biologisesti aktiiviseksi metaboliitiksi. Oraalisen annon jälkeen desogestreelin suhteellinen hyötyosuus liuokseen verrattuna on etonogestreelin seerumipitoisuuksilla mitattuna noin 100 %. Mircette® (desogestreeli/etinyyliestradioli ja etinyyliestradioli) -tabletit tarjoavat kaksi erilaista etinyyliestradiolihoito-ohjelmaa; 0,02 mg yhdistelmätabletissa [valkoinen] sekä 0,01 mg keltaisessa tabletissa. Etinyyliestradioli imeytyy nopeasti ja lähes täydellisesti. Mircette®-yhdistelmätabletin [valkoinen] kerta-annoksen jälkeen etinyyliestradiolin suhteellinen hyötyosuus on noin 93 %, kun taas 0,01 mg:n tabletin [keltainen] suhteellinen hyötyosuus on 99 %. Ruoan vaikutusta Mircette®-tablettien biologiseen hyötyosuuteen suun kautta antamisen jälkeen ei ole arvioitu.
Etonogestreelin ja etinyyliestradiolin farmakokinetiikka Mircette®-tablettien toistuvan annostelun jälkeen määritettiin kolmannen jakson aikana 17 koehenkilöllä. Plasman etonogestreelin ja etinyyliestradiolin pitoisuudet saavuttivat vakaan tilan 21. päivään mennessä. Etonogestreelin vakaan tilan AUC(0-24) oli noin 2,2 kertaa suurempi kuin AUC(0-24) kolmannen syklin päivänä 1. . Etonogestreelin ja etinyyliestradiolin farmakokineettiset parametrit Mircette®-tablettien toistuvan annostelun jälkeisen kolmannen syklin aikana on esitetty taulukossa I.
TAULUKKO I: MIRCETTEN® FARMAKOKINEETTISET PARAMETRIT KESKIMÄÄRÄISET (SD) 28 PÄIVÄN ANNOSTUSJAKSOLLA KOLMANNEN JAKSOLLA (n=17).
Jakelu
Etonogestreelin, desogestreelin aktiivisen metaboliitin, havaittiin sitoutuvan 99-prosenttisesti proteiineihin, pääasiassa sukupuolihormoneja sitovaan globuliiniin (SHBG). Etinyyliestradiolista noin 98,3 % sitoutuu, pääasiassa plasman albumiiniin. Etinyyliestradioli ei sitoudu SHBG:hen, mutta indusoi SHBG:n synteesiä. Desogestreeli yhdessä etinyyliestradiolin kanssa ei vaikuta estrogeenin aiheuttamaan SHBG:n nousuun, mikä johtaa alhaisempiin seerumin vapaan testosteronin pitoisuuksiin (96–99).
Aineenvaihdunta
Desogestreeli:
Desogestreeli metaboloituu nopeasti ja täydellisesti hydroksylaation kautta suolen limakalvolla ja ensin maksan läpi etonogestreeliksi. Muita metaboliitteja (ts. 3α-OH-desogestreeli, 3β-OHdesogestreeli ja 3α-OH-5α-H-desogestreeli), joilla ei ole farmakologisia vaikutuksia, on myös tunnistettu ja nämä metaboliitit voivat konjugoitua glukuronidilla ja sulfaatilla.
Etinyyliestradioli:
Etinyyliestradioli on alttiina merkittävässä määrin presysteemiselle konjugaatiolle (vaiheen II metabolia). Etinyyliestradioli, joka pakenee suolen seinämän konjugaatiosta, käy läpi vaiheen I metaboliaa ja maksakonjugaatiota (vaiheen II metabolia). Tärkeimmät faasin I metaboliitit ovat 2-OH-etinyyliestradioli ja 2-metoksietinyyliestradioli. Sekä etinyyliestradiolin että faasin I metaboliittien sulfaatti- ja glukuronidikonjugaatit, jotka erittyvät sappeen, voivat joutua enterohepaattiseen verenkiertoon.
Erittyminen
Etonogestreeli ja etinyyliestradioli erittyvät virtsaan, sappeen ja ulosteisiin. Vakaassa tilassa, päivänä 21, etonogestreelin eliminaation puoliintumisaika on 27,8±7,2 tuntia ja etinyyliestradiolin eliminaation puoliintumisaika yhdistelmätabletilla on 23,9±25,5 tuntia. 0,01 mg:n etinyyliestradiolitabletin [keltainen] eliminaation puoliintumisaika vakaassa tilassa, päivänä 28, on 18,9±8,3 tuntia.
Erikoispopulaatiot
Rotu
Ei ole tietoa rodun vaikutuksen määrittämiseksi Mircette®-tablettien (desogestreeli/etinyyliestradioli ja etinyyliestradioli) farmakokinetiikkaan.
Maksan vajaatoiminta
Virallisia tutkimuksia ei suoritettu maksasairauden vaikutuksen arvioimiseksi Mircette®:n jakautumiseen.
Munuaisten vajaatoiminta
Mitään muodollisia tutkimuksia ei tehty munuaissairauden vaikutuksen arvioimiseksi Mircette®:n jakautumiseen.
Huumeiden väliset vuorovaikutukset
Kirjallisuudessa on raportoitu desogestreelin/etinyyliestradiolin ja muiden lääkkeiden välisiä yhteisvaikutuksia. Virallisia lääkkeiden yhteisvaikutustutkimuksia ei ole tehty (ks VAROTOIMENPITEET jakso).
VIITTEET
90. Godsland, I et ai. Oraalisten ehkäisyvalmisteiden eri formulaatioiden vaikutukset lipidi- ja hiilihydraattiaineenvaihduntaan. N Engl J Med 1990; 323:1375–81.
91. Kloosterboer, HJ et ai. Selektiivisyys progesteronin ja androgeenireseptorin sitoutumisessa oraalisessa ehkäisyssä käytettyjen progestogeenien suhteen. Ehkäisy, 1988; 38:325–32.
92. Van der Vies, J ja de Visser, J. Endokrinologiset tutkimukset desogestreelillä. Arzneim. Forsch./Drug Res., 1983; 33(l),2:231–6.
96. Cullberg, G et ai. Pienen annoksen desogestreeli-etinyyliestradioliyhdistelmän vaikutukset hirsutismiin, androgeeniin ja sukupuolihormoneja sitovaan globuliiniin naisilla, joilla on munasarjojen monirakkulatauti. Acta Obstet Gynecol Scand, 1985; 64:195–202.
97. Jung-Hoffmann, C ja Kuhl, H. Kahden pieniannoksisen oraalisen ehkäisyvalmisteen erilaiset vaikutukset sukupuolihormonia sitovaan globuliiniin ja vapaaseen testosteroniin. AJOG, 1987; 156:199–203.
98. Hammond, G et ai. Seerumin steroideja sitovien proteiinien pitoisuudet, progestogeenien jakautuminen ja testosteronin hyötyosuus desogestreeliä tai levonorgestreeliä sisältävien ehkäisyvalmisteiden käytön aikana. Hedelmällinen. Steril., 1984; 42:44–51.
99. Palatsi, R et ai. Seerumin kokonais- ja sitoutumaton testosteroni- ja sukupuolihormoneja sitova globuliini (SHBG) akne-naispotilailla, joita hoidetaan kahdella eri oraalisella ehkäisyvalmisteella. Acta Derm Venereol, 1984; 64:517–23.
POTILASTIEDOT
Mircette ® (desogestreeli/etinyyliestradioli ja etinyyliestradioli) Tabletit
Tämä tuote (kuten kaikki suun kautta otettavat ehkäisyvalmisteet) on tarkoitettu raskauden estämiseen. Se ei suojaa HIV-tartunnalta (AIDS) ja muilta sukupuolitaudeilta.
HUOMAA: Tätä merkintää tarkistetaan ajoittain, kun tärkeää uutta lääketieteellistä tietoa tulee saataville. Siksi tarkista tämä merkintä huolellisesti.
KUVAUS
Seuraava oraalinen ehkäisyvalmiste sisältää yhdistelmän progestiinia ja estrogeenia, kahdenlaisia naishormoneja:
Yksi valkoinen tabletti sisältää 0,15 mg desogestreeliä ja 0,02 mg etinyyliestradiolia. Jokainen vaaleanvihreä tabletti sisältää inerttejä ainesosia ja jokainen keltainen tabletti sisältää 0,01 mg etinyyliestradiolia.
JOHDANTO
Jokaisen naisen, joka harkitsee suun kautta otettavien ehkäisyvälineiden (ehkäisypilleri tai pilleri) käyttöä, tulee ymmärtää tämän ehkäisymuodon käytön edut ja riskit. Tämä pakkausseloste antaa sinulle suuren osan tiedoista, joita tarvitset tämän päätöksen tekemiseen, ja se auttaa myös sinua määrittämään, onko sinulla riski saada jokin pillereiden vakavista sivuvaikutuksista. Siinä kerrotaan, kuinka pilleriä käytetään oikein, jotta se olisi mahdollisimman tehokas. Tämä pakkausseloste ei kuitenkaan korvaa huolellista keskustelua sinun ja lääkärisi tai terveydenhuollon tarjoajan välillä. Sinun tulee keskustella tässä pakkausselosteessa annetuista tiedoista hänen kanssaan sekä kun aloitat pillereiden käytön ensimmäisen kerran että uusintakäyntien aikana. Sinun tulee myös noudattaa lääkärisi tai terveydenhuollon tarjoajan neuvoja säännöllisissä tarkastuksissa, kun käytät pillereitä.
ORAALISTEN EHKÄISYAINEIDEN TEHOKKUUS
Suun kautta otettavia ehkäisyvalmisteita tai "ehkäisypillereitä" tai "pillereitä" käytetään raskauden ehkäisyyn, ja ne ovat tehokkaampia kuin muut ei-kirurgiset ehkäisymenetelmät. Oikein käytettynä raskaaksi tulemisen mahdollisuus on alle 1 % (1 raskaus 100 naista kohden käyttövuotta kohti), kun niitä käytetään täydellisesti ilman, että pillereitä jäisi väliin. Tyypillinen epäonnistumisaste on itse asiassa 5 % vuodessa. Mahdollisuus tulla raskaaksi kasvaa jokaisella unohdetulla pillerillä kuukautiskierron aikana.
Vertailun vuoksi muiden ehkäisymenetelmien tyypilliset epäonnistumisluvut ensimmäisen käyttövuoden aikana ovat seuraavat:
KENEN EI PIDÄ OTTAA ORAALISIA EHKÄISYVÄLINEITÄ
Tupakointi lisää suun kautta otettavien ehkäisyvalmisteiden käytön aiheuttamien vakavien kardiovaskulaaristen sivuvaikutusten riskiä. Tämä riski kasvaa iän ja runsaan tupakoinnin (vähintään 15 savuketta päivässä) myötä, ja se on huomattava yli 35-vuotiailla naisilla. Naisia, jotka käyttävät suun kautta otettavia ehkäisyvalmisteita, kehotetaan ehdottomasti olemaan tupakoimatta.
Jotkut naiset eivät saa käyttää pilleriä. Älä esimerkiksi ota pilleriä, jos olet raskaana tai epäilet olevasi raskaana. Älä myöskään käytä pilleriä, jos sinulla on jokin seuraavista tiloista:
- Sydänkohtauksen tai aivohalvauksen historia
- Veritulpat jaloissa (tromboflebiitti), keuhkoissa (keuhkoembolia) tai silmissä
- Aiempi veritulppa jalkojen syvissä laskimoissa
- Rintakipu (angina pectoris)
- Tunnettu tai epäilty rintasyöpä tai kohdun, kohdunkaulan tai emättimen limakalvosyöpä
- Selittämätön verenvuoto emättimestä (kunnes lääkärisi on tehnyt diagnoosin)
- Silmänvalkuaisten tai ihon keltaisuus (keltaisuus) raskauden tai pillereiden aikaisemman käytön aikana
- Maksakasvain (hyvänlaatuinen tai syöpä)
- Tunnettu tai epäilty raskaus.
Kerro lääkärillesi tai terveydenhuollon tarjoajalle, jos sinulla on koskaan ollut jokin näistä tiloista. Lääkärisi tai terveydenhuollon tarjoaja voi suositella toista ehkäisymenetelmää.
MUITA NÄKÖKOHTIA ENNEN ORAALISTEN EHKÄISYAINEIDEN OTTOA
Kerro lääkärillesi tai terveydenhuollon tarjoajalle, jos sinulla on:
- Rintojen kyhmyt, rintojen fibrokystinen sairaus, epänormaali rintojen röntgenkuva tai mammografia
- Diabetes
- Kohonnut kolesteroli tai triglyseridit
- Korkea verenpaine
- Migreeni tai muu päänsärky tai epilepsia
- Henkinen masennus
- Sappirakko-, sydän- tai munuaissairaus
- Aiemmat niukat tai epäsäännölliset kuukautiset.
Lääkärin tai terveydenhuollon tarjoajan tulee usein tarkastaa naiset, joilla on jokin näistä sairauksista, jos he haluavat käyttää ehkäisyvalmisteita.
Muista myös kertoa lääkärillesi tai terveydenhuollon tarjoajalle, jos tupakoit tai käytät lääkkeitä.
ORAALISTEN EHKÄISYAINEIDEN OTTAMISEN RISKIT
1. Veritulppien riski
Veritulpat ja verisuonten tukkeutuminen ovat yksi oraalisten ehkäisyvalmisteiden käytön vakavimmista sivuvaikutuksista ja voivat aiheuttaa kuoleman tai vakavan vamman. Erityisesti jalassa oleva hyytymä voi aiheuttaa tromboflebiitin ja keuhkoihin kulkeutuva hyytymä voi aiheuttaa äkillisen tukos verisuonen, joka kuljettaa verta keuhkoihin. Näiden sivuvaikutusten riskit voivat olla suuremmat käytettäessä desogestreeliä sisältäviä oraalisia ehkäisyvalmisteita, kuten Mircette®, kuin käytettäessä tiettyjä muita pieniannoksisia pillereitä. Harvoin silmän verisuonissa esiintyy hyytymiä, jotka voivat aiheuttaa sokeutta, kaksoisnäön tai näön heikkenemistä.
Jos käytät ehkäisytabletteja ja tarvitset valinnaista leikkausta, joudut olemaan sängyssä pitkäaikaisen sairauden vuoksi tai olet äskettäin synnyttänyt lapsen, sinulla voi olla veritulppien riski. Sinun tulee neuvotella lääkärisi tai terveydenhuollon tarjoajan kanssa, jos haluat lopettaa ehkäisytablettien käytön 3–4 viikkoa ennen leikkausta ja olla ottamatta ehkäisyvalmisteita kahteen viikkoon leikkauksen jälkeen tai vuodelevon aikana. Sinun ei myöskään pidä ottaa suun kautta otettavia ehkäisyvalmisteita pian synnytyksen jälkeen. On suositeltavaa odottaa vähintään neljä viikkoa synnytyksen jälkeen, jos et imetä, tai neljä viikkoa toisen raskauskolmanneksen abortin jälkeen. Jos imetät, sinun tulee odottaa, kunnes olet vieroittanut lapsesi ennen pillereiden käyttöä (ks Imetys YLEISET VAROTOIMET ).
Verenkiertosairauksien riski suun kautta otettavien ehkäisyvalmisteiden käyttäjillä voi olla suurempi suuriannoksisia pillereitä käyttävillä ja voi olla suurempi, jos oraalista ehkäisyä käytetään pidempään. Lisäksi osa näistä lisääntyneistä riskeistä voi jatkua useita vuosia ehkäisytablettien lopettamisen jälkeen. Suun kautta otettavien ehkäisyvalmisteiden käyttöön liittyvä laskimotromboembolisen sairauden riski ei kasva käytön pituuden myötä ja häviää pillereiden käytön lopettamisen jälkeen. Epänormaalin veren hyytymisen riski kasvaa iän myötä sekä oraalisten ehkäisyvalmisteiden käyttäjillä että ei-käyttäjillä, mutta ehkäisytablettien aiheuttama lisääntynyt riski näyttää olevan läsnä kaikissa ikäryhmissä. On arvioitu, että 20–44-vuotiaista naisista noin 1/2 000 suun kautta otettavaa ehkäisyä käyttävästä joutuu sairaalaan joka vuosi epänormaalin hyytymisen vuoksi. Saman ikäryhmän ei-käyttäjistä noin yksi 20 000:sta joutuisi sairaalaan vuosittain. Yleensä suun kautta otettavien ehkäisyvalmisteiden käyttäjillä on arvioitu, että 15–34-vuotiailla naisilla verenkiertohäiriön aiheuttaman kuoleman riski on noin 1:12 000 vuodessa, kun taas ei-käyttäjillä noin 1:50 000 vuodessa. Ikäryhmässä 35–44-vuotiaat riskin arvioidaan olevan noin 1/2 500 vuodessa suun kautta otettavien ehkäisyvalmisteiden käyttäjillä ja noin 1/10 000 vuodessa ei-käyttäjillä.
2. Sydänkohtaukset ja aivohalvaukset
Suun kautta otettavat ehkäisyvalmisteet voivat lisätä taipumusta aivohalvauksiin (aivojen verisuonten pysähtyminen tai repeämä), angina pectorikseen ja sydänkohtauksiin (sydämen verisuonten tukkeutuminen). Mikä tahansa näistä tiloista voi aiheuttaa kuoleman tai vakavan vamman.
Tupakointi lisää suuresti sydänkohtausten ja aivohalvausten riskiä. Lisäksi tupakointi ja suun kautta otettavien ehkäisyvalmisteiden käyttö lisäävät suuresti sydänsairauksien kehittymisen ja kuoleman mahdollisuuksia.
3. Sappirakon sairaus
Ehkäisytablettien käyttäjillä on todennäköisesti suurempi riski sairastua sappirakon sairauteen kuin ei-käyttäjillä, vaikka tämä riski saattaa liittyä pillereihin, jotka sisältävät suuria annoksia estrogeenia.
4. Maksakasvaimet
Harvinaisissa tapauksissa suun kautta otettavat ehkäisyvalmisteet voivat aiheuttaa hyvänlaatuisia mutta vaarallisia maksakasvaimia. Nämä hyvänlaatuiset maksakasvaimet voivat repeytyä ja aiheuttaa kuolemaan johtavan sisäisen verenvuodon. Lisäksi mahdollinen mutta ei selvä yhteys pillereiden ja maksasyöpien kanssa on löydetty kahdessa tutkimuksessa, joissa muutamat naiset, joille nämä erittäin harvinaiset syövät kehittyivät, todettiin käyttäneen suun kautta otettavia ehkäisyvalmisteita pitkiä aikoja. Maksasyövät ovat kuitenkin erittäin harvinaisia. Mahdollisuus sairastua maksasyöpään pillereiden käytöstä on siis vielä harvinaisempi.
5. Sukuelinten ja rintojen syöpä
Rintasyöpää ja ehkäisyä koskevien tutkimusten välillä on ristiriitaa. Jotkut tutkimukset ovat raportoineet lisääntyneen riskin sairastua rintasyöpään varsinkin nuorempana. Tämä lisääntynyt riski näyttää liittyvän käytön kestoon. Suurin osa tutkimuksista ei ole havainnut yleistä lisääntynyttä riskiä sairastua rintasyöpään.
Joissakin tutkimuksissa on havaittu lisääntyneen kohdunkaulan syövän ilmaantuvuus naisilla, jotka käyttävät ehkäisyvalmisteita. Tämä havainto voi kuitenkin liittyä muihin tekijöihin kuin suun kautta otettavien ehkäisyvalmisteiden käyttöön. Ei ole riittävästi todisteita sulkeakseen pois mahdollisuuden, että pillerit voivat aiheuttaa tällaisia syöpiä.
ARVIOITU KUOLEMARISKI syntyvyydensäätelymenetelmästä TAI RASKAUDESTA
Kaikki ehkäisymenetelmät ja raskaus liittyvät riskiin sairastua tiettyihin sairauksiin, jotka voivat johtaa vammaisuuteen tai kuolemaan. Arvio erilaisiin ehkäisymenetelmiin ja raskauteen liittyvistä kuolemantapauksista on laskettu, ja se on esitetty seuraavassa taulukossa.
SYNTYMÄLLE TAI MENETELMIIN LIITTYVIEN HEDELMÄTTYMISEEN LIITTYVIEN KULEMIEN VUOSImäärä 100 000 EI-STERIILIÄ NAISTA kohden HEDELLYTYKSENVALVONTAMENETELMÄLLÄ IKÄN MUKAISESTI
Yllä olevassa taulukossa minkä tahansa ehkäisymenetelmän aiheuttama kuolemanriski on pienempi kuin synnytysriski, lukuun ottamatta yli 35-vuotiaita tupakoivia ehkäisyn käyttäjiä ja yli 40-vuotiaita pillereiden käyttäjiä, vaikka he eivät tupakoi. Taulukosta näkyy, että 15–39-vuotiailla naisilla kuolinriski oli suurin raskauden aikana (7–26 kuolemaa 100 000 naista kohden iästä riippuen). Tupakoimattomilla pillereiden käyttäjillä kuolinriski on aina pienempi kuin raskauteen liittyvä missä tahansa ikäryhmässä, vaikka yli 40-vuotiailla riski kasvaa 32 kuolemaan 100 000 naista kohti, kun tuolloin raskauteen liittyy 28. ikä. Kuitenkin tupakoivien ja yli 35-vuotiaiden pillereiden käyttäjien kuolemien arvioitu määrä on suurempi kuin muilla ehkäisymenetelmillä. Jos nainen on yli 40-vuotias ja tupakoi, hänen arvioitu kuolemanriskinsä on neljä kertaa suurempi (117/100 000 naista) kuin arvioitu raskauteen liittyvä riski (28/100 000 naista) kyseisessä ikäryhmässä.
Ehdotus, että yli 40-vuotiaat naiset, jotka eivät tupakoi, eivät saisi käyttää oraalisia ehkäisyvalmisteita, perustuu vanhemmista suuriannoksisista pillereistä saatuihin tietoihin ja pillereiden vähemmän valikoivaan käyttöön kuin nykyään. FDA:n neuvoa-antava komitea keskusteli tästä aiheesta vuonna 1989 ja suositteli, että terveiden, tupakoimattomien yli 40-vuotiaiden naisten suun kautta otettavien ehkäisyvalmisteiden käytön hyödyt voivat olla suurempia kuin mahdolliset riskit. Kaikkia naisia, erityisesti iäkkäitä naisia, kehotetaan kuitenkin käyttämään pienintä tehokasta pilleriannosta.
VAROITUSMERKIT
Jos jokin näistä haittavaikutuksista ilmenee, kun käytät ehkäisyvalmisteita, soita välittömästi lääkärillesi tai terveydenhuollon tarjoajalle:
- Terävä rintakipu, veren yskiminen tai äkillinen hengenahdistus (osoitus mahdollisesta hyytymisestä keuhkoissa)
- Kipu pohkeessa (osoittaa mahdollista hyytymistä jalassa)
- Puristava rintakipu tai raskaus rinnassa (osoitus mahdollisesta sydänkohtauksesta)
- Äkillinen voimakas päänsärky tai oksentelu, huimaus tai pyörtyminen, näkö- tai puhehäiriöt, heikkous tai tunnottomuus käsivarressa tai jalassa (osoitus mahdollisesta aivohalvauksesta)
- Äkillinen osittainen tai täydellinen näön menetys (osoittaa mahdollista hyytymistä silmässä)
- Rintojen kyhmyt (osoitus mahdollisesta rintasyövästä tai rintojen fibrokystisesta sairaudesta; pyydä lääkäriäsi tai terveydenhuollon tarjoajaa näyttämään sinulle, kuinka rintasi tutkitaan)
- Vakava kipu tai arkuus vatsan alueella (osoittaa mahdollisesti repeytyneestä maksakasvaimesta)
- Nukkumisvaikeudet, heikkous, energian puute, väsymys tai mielialan muutos (mahdollisesti osoitus vakavasta masennuksesta)
- Keltaisuus tai ihon tai silmämunien keltaisuus, johon liittyy usein kuumetta, väsymystä, ruokahaluttomuutta, tummaa virtsaa tai vaaleaa suolen liikkeitä (osoittaa mahdollisista maksaongelmista).
ORAALISTEN EHKÄISYAINEIDEN HAITTAVAIKUTUKSET
1. Emättimen verenvuoto
Epäsäännöllistä emättimen verenvuotoa tai tiputtelua saattaa esiintyä pillereiden käytön aikana. Epäsäännöllinen verenvuoto voi vaihdella lievästä värjäytymisestä kuukautisten välillä läpimurtoverenvuotoon, joka on samanlaista kuin säännölliset kuukautiset. Epäsäännöllistä verenvuotoa esiintyy useimmiten suun kautta otettavien ehkäisyvalmisteiden ensimmäisten kuukausien aikana, mutta sitä voi esiintyä myös sen jälkeen, kun olet käyttänyt pilleriä jonkin aikaa. Tällainen verenvuoto voi olla tilapäistä, eikä se yleensä osoita vakavia ongelmia. On tärkeää jatkaa pillereiden ottamista aikataulun mukaisesti. Jos verenvuoto esiintyy useammassa kuin yhdessä syklissä tai kestää yli muutaman päivän, keskustele lääkärisi tai terveydenhuollon tarjoajan kanssa.
2. Piilolinssit
Jos käytät piilolinssejä ja huomaat näkösi muuttuvan tai et pysty käyttämään linssejäsi, ota yhteyttä lääkäriisi tai terveydenhuollon tarjoajaan.
3. Nesteenpidätys
Suun kautta otettavat ehkäisyvalmisteet voivat aiheuttaa turvotusta (nesteen kertymistä), johon liittyy sormien tai nilkkojen turvotusta, ja ne voivat nostaa verenpainetta. Jos havaitset nesteen kertymistä, ota yhteys lääkäriisi tai terveydenhuollon tarjoajaan.
4. Melasma
Ihon täplikäs tummuminen on mahdollista, erityisesti kasvojen.
5. Muut sivuvaikutukset
Muita sivuvaikutuksia voivat olla pahoinvointi ja oksentelu, ruokahalun muutos, päänsärky, hermostuneisuus, masennus, huimaus, päänahan hiustenlähtö, ihottuma ja emättimen infektiot.
Jos jokin näistä haittavaikutuksista vaivaa sinua, ota yhteys lääkäriisi tai terveydenhuollon tarjoajaan.
YLEISET VAROTOIMET
1. Kuukautisten puuttuminen ja ehkäisyvälineiden käyttö ennen raskautta tai sen aikana
Saattaa olla aikoja, jolloin kuukautiset eivät ehkä tule säännöllisin väliajoin, kun olet lopettanut pillerisyklin. Jos olet ottanut pillereitäsi säännöllisesti ja yksi kuukautiset jäävät väliin, jatka pillereiden ottamista seuraavaan kiertoon, mutta muista kertoa asiasta lääkärillesi tai terveydenhuollon tarjoajalle ennen kuin teet niin. Jos et ole ottanut pillereitä päivittäin ohjeiden mukaisesti ja kuukautiset jäivät väliin tai jos sinulla on jäänyt kaksi peräkkäistä kuukautisia, saatat olla raskaana. Tarkista välittömästi lääkäriltäsi tai terveydenhuollon tarjoajalta, oletko raskaana. Älä jatka ehkäisyvalmisteiden käyttöä, ennen kuin olet varma, ettet ole raskaana, vaan jatka jonkin muun ehkäisymenetelmän käyttöä.
Ei ole vakuuttavia todisteita siitä, että suun kautta otettavien ehkäisyvalmisteiden käyttö liittyisi synnynnäisten epämuodostumien lisääntymiseen, jos niitä otetaan vahingossa raskauden alkuvaiheessa. Aiemmin muutamat tutkimukset olivat raportoineet, että suun kautta otettavat ehkäisyvalmisteet voivat liittyä synnynnäisiin epämuodostumisiin, mutta näitä tutkimuksia ei ole vahvistettu. Suun kautta otettavia ehkäisyvalmisteita tai muita lääkkeitä ei kuitenkaan saa käyttää raskauden aikana, ellei se ole selvästi välttämätöntä ja lääkärisi tai terveydenhuollon tarjoaja niin määrää. Sinun tulee tarkistaa lääkäriltäsi tai terveydenhuollon tarjoajalta riskejä, joita raskauden aikana otetut lääkkeet aiheuttavat sikiölle.
2. Imetyksen aikana
Jos imetät, keskustele lääkärisi tai terveydenhuollon tarjoajan kanssa ennen kuin aloitat ehkäisytablettien käytön. Osa lääkkeestä siirtyy lapselle maidon mukana. Muutamia lapseen kohdistuvia haittavaikutuksia on raportoitu, mukaan lukien ihon kellastuminen (keltatauti) ja rintojen suureneminen. Lisäksi suun kautta otettavat ehkäisyvalmisteet voivat heikentää maidon määrää ja laatua. Jos mahdollista, älä käytä ehkäisyvalmisteita imetyksen aikana. Sinun tulee käyttää toista ehkäisymenetelmää, koska imetys antaa vain osittaisen suojan raskaaksi tulemiselta ja tämä osittainen suoja heikkenee merkittävästi, kun imetät pidempiä aikoja.
Sinun tulee harkita suun kautta otettavien ehkäisyvalmisteiden aloittamista vasta, kun olet vieroittanut lapsesi kokonaan.
3. Laboratoriotutkimukset
Jos sinulle on määrä tehdä laboratoriotutkimuksia, kerro lääkärillesi tai terveydenhuollon tarjoajalle, että käytät ehkäisypillereitä. Ehkäisypillerit voivat vaikuttaa tiettyihin verikokeisiin.
4. Lääkkeiden yhteisvaikutukset
Tietyt lääkkeet voivat olla vuorovaikutuksessa ehkäisypillereiden kanssa tehdäkseen niistä vähemmän tehokkaita raskauden ehkäisyssä tai lisätäkseen läpimurtoverenvuotoa. Tällaisia lääkkeitä ovat rifampiini, epilepsialääkkeet, kuten barbituraatit (esimerkiksi fenobarbitaali), fenytoiini (Dilantin® on yksi tämän lääkkeen merkki), fenyylibutatsoni (Butazolidin® on yksi tuotemerkki) ja mahdollisesti tietyt antibiootit. Saatat joutua käyttämään lisäehkäisyä, kun käytät lääkkeitä, jotka voivat heikentää oraalisten ehkäisyvalmisteiden tehoa.
Ehkäisypillerit voivat olla vuorovaikutuksessa lamotrigiinin, epilepsiaan käytettävän kouristuslääkkeen, kanssa. Tämä saattaa lisätä kohtausten riskiä, joten lääkärisi saattaa joutua muuttamaan lamotrigiiniannosta.
Jotkut lääkkeet voivat tehdä ehkäisypillereistä vähemmän tehokkaita, mukaan lukien:
- Barbituraatit
- Bosentaani
- Karbamatsepiini
- Felbamaatti
- Griseofulviini
- Okskarbatsepiini
- Fenytoiini
- Rifampiini
- mäkikuisma
- Topiramaatti
Kuten kaikkien reseptilääkkeiden kohdalla, sinun tulee ilmoittaa terveydenhuollon tarjoajallesi kaikista muista käyttämistäsi lääkkeistä ja rohdosvalmisteista. Saatat joutua käyttämään esteehkäisyä, kun käytät lääkkeitä tai tuotteita, jotka voivat heikentää ehkäisypillereiden tehoa.
5. Sukupuolitaudit
Tämä tuote (kuten kaikki suun kautta otettavat ehkäisyvalmisteet) on tarkoitettu raskauden estämiseen. Se ei suojaa HIV:ltä (AIDS) ja muilta sukupuolitaudeilta, kuten klamydialta, genitaaliherpekseltä, sukupuolielinten syyliltä, tippurilta, hepatiitti B:ltä ja kupalta.
MITEN PILLE OTETAAN
TÄRKEÄÄ MUISTAA
ENNEN KUIN ALOITAT OTTAAN PILLERIT:
1. MUISTA LUE NÄMÄ OHJEET:
Ennen kuin aloitat pillereiden ottamisen.
Aina kun et ole varma mitä tehdä.
2. OIKEIN TAPA OTTA PILLER ON OTTA YKSI PILLE JOKA PÄIVÄ SAMAAN AIKAAN.
Jos unohdat ottaa pillerit, voit tulla raskaaksi. Tämä sisältää paketin aloittamisen myöhässä.
Mitä enemmän pillereitä unohdat, sitä todennäköisemmin tulet raskaaksi.
3. MONEILLE NAISILLE ON TÄPPILLE TAI VÄKEVÄÄ VUOTOA TAI VOITTAA OLLA PAHOILTA vatsaan ENSIMMÄISEN 1 - 3 PILLERIPAKKAUKSEN AIKANA.
Jos tunnet vatsasi pahoinvointia, älä lopeta pillereiden ottamista. Ongelma yleensä poistuu. Jos se ei häviä, tarkista lääkäriltäsi tai terveydenhuollon tarjoajalta.
4. PILLEERIT VOIVAT MYÖS AIHEUTTAA TÄPPILLE TAI KELPAA VUOTOA, vaikka korvaisit nämä unohtaneet pillerit.
Niinä päivinä, kun otat 2 pilleriä korvataksesi unohdetut pillerit, saatat myös tuntea olosi hieman pahoinvoitavaksi.
5. JOS SINULLA ON oksentelu TAI ripuli jostain syystä tai JOS KÄYTÄT JOITAKIN LÄÄKKEITÄ, mukaan lukien jotkin antibiootit, pillerisi eivät ehkä toimi yhtä hyvin.
Käytä varamenetelmää (kuten kondomia, vaahtoa tai sientä), kunnes otat yhteyttä lääkäriisi tai terveydenhuollon tarjoajaan.
6. JOS SINULLA ON ONGELMIA MUISTUTTA PILLERIN OTTAMISESSA, keskustele lääkärisi tai terveydenhuollon tarjoajan kanssa siitä, kuinka voit helpottaa pillereiden ottamista tai käyttää jotakin muuta ehkäisymenetelmää.
7. JOS SINULLA ON KYSYMYKSIÄ TAI ETET EPÄVARMISTA TÄMÄN ESITTEEN TIEDOT, soita lääkärillesi tai terveydenhuollon tarjoajalle.
ENNEN KUIN ALOITAT OTTAAN PILLERIT
8. PÄÄTTÄ MILLOIN KÄYNNISSÄ HALUAT OTTA PILLERIN.
On tärkeää ottaa se suunnilleen samaan aikaan joka päivä.
8. KATSO PILLEPAKKAUKSIA: SIITÄ ON 28 PILLERIA:
Tässä 28 pillerin pakkauksessa on 26 "aktiivista" [valkoista ja keltaista] pilleriä (hormoneilla) ja 2 "inaktiivista" [vaaleanvihreää] pilleriä (ilman hormoneja).
10. LÖYDÄ MYÖS:
1) mistä pakkauksesta aloittaa pillereiden ottaminen,
2) missä järjestyksessä pillerit otetaan (noudata nuolia) ja
3) viikkonumerot alla olevan kuvan mukaisesti.
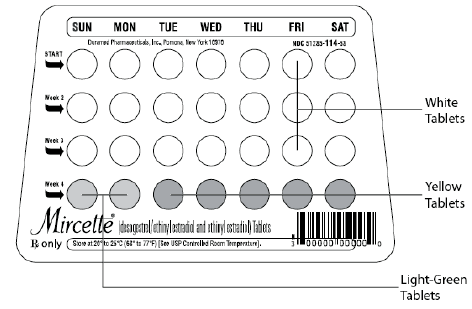
11. VARMISTA, ETTÄ OLET AINA VALMIS:
TOINEN SYNTYVYYSVÄLITYS (kuten kondomi, vaahto tai sieni), jota voit käyttää vara-apuna, jos unohdat ottaa pillereitä.
EXTRA, TÄYSI PILLIPAKETTI.
MILLOIN ALOITTAA ENSIMMÄISEN PILLERIPAKETTI
Voit valita, minä päivänä aloitat ensimmäisen pilleripakkauksen ottamisen. Päätä lääkärisi tai terveydenhuollon tarjoajan kanssa, mikä päivä on sinulle paras. Valitse kellonaika, joka on helppo muistaa.
PÄIVÄ 1 ALOITUS
12. Valitse päivätarranauha, joka alkaa kuukautistenne ensimmäisestä päivästä (tämä on päivä, jolloin alkaa verenvuoto tai tiputtelu, vaikka vuodon alkaessa olisikin melkein keskiyö).
13. Aseta tämän päivän etikettiliuska syklin tablettien annostelijaan alueelle, johon on painettu viikonpäivät (sunnuntaista alkaen).
Huomautus: Jos kuukautistenne ensimmäinen päivä on sunnuntai, voit ohittaa vaiheet 1 ja 2.
14. Ota ensimmäinen "aktiivinen" [valkoinen] pilleri ensimmäisestä pakkauksesta kuukautistenne ensimmäisten 24 tunnin aikana.
15. Sinun ei tarvitse käyttää varaehkäisymenetelmää, koska aloitat pillereiden käytön kuukautistenne alussa.
SUNNUNTAI ALOITUS
16. Ota ensimmäinen "aktiivinen" [valkoinen] pilleri ensimmäisestä pakkauksesta kuukautisten alkamisen jälkeisenä sunnuntaina, vaikka verenvuoto jatkuisikin. Jos kuukautisesi alkavat sunnuntaina, aloita pakkaus samana päivänä.
17. Käytä toista ehkäisymenetelmää varamenetelmänä, jos harrastat seksiä milloin tahansa ensimmäisen pakkauksen aloittamisen sunnuntaista seuraavaan sunnuntaihin (7 päivää). Kondomit, vaahtomuovi tai sieni ovat hyviä varmistusmenetelmiä ehkäisyssä.
MITÄ TEHDÄ KUUKAUDEN AIKANA
18. OTA YKSI PILLE SAMALLA JOKA PÄIVÄ, kunnes PAKKAUS ON TYHJÄ.
Älä jätä pillereitä väliin, vaikka tiputtelut tai verenvuoto olisivat kuukautisten välillä tai vatsasi pahoinvointi (pahoinvointi).
Älä jätä pillereitä väliin, vaikka et harrastaisikaan seksiä kovin usein.
19. KUN LOPETAT PAKKAUKSEN TAI VAIHDAT PILLERIT:
21 pilleriä : Odota 7 päivää aloittaaksesi seuraavan paketin. Sinulla on luultavasti kuukautisesi tällä viikolla. Varmista, että 21 päivän pakkausten välillä ei ole yli 7 päivää.
28 pilleriä : Aloita seuraava pakkaus seuraavana päivänä viimeisen pillerin ottamisen jälkeen. Älä odota päivääkään pakkausten välillä.
MITÄ TEHDÄ, JOS VÄLITÄÄN PILLEERIT
Jos unohdat ottaa yhden "aktiivisen" [valkoisen] pillerin:
20. Ota se heti kun muistat. Ota seuraava pilleri normaaliin aikaan. Tämä tarkoittaa, että otat 2 pilleriä 1 päivässä.
21. Sinun ei tarvitse käyttää varaehkäisymenetelmää, jos harrastat seksiä. Jos unohdat 2 "aktiivista" [valkoista] pilleriä peräkkäin VIIKKOLLA 1 TAI VIIKOLLA 2 paketistasi:
22. Ota 2 pilleriä sinä päivänä, kun muistat, ja 2 pilleriä seuraavana päivänä.
23. Ota sitten 1 pilleri päivässä, kunnes pakkaus on valmis.
24. SAATAT tulla raskaaksi, jos harrastat seksiä 7 päivän kuluessa pillereiden väliin jäämisestä. Sinun TÄYTYY käyttää muuta ehkäisymenetelmää (kuten kondomia, vaahtoa tai sientä) varamenetelmänä näiden 7 päivän ajan.
Jos unohdat 2 "aktiivista" [valkoista] pilleriä peräkkäin viikolla 3:
25. Jos olet 1. päivän aloittaja:
HEITÄ POIS pilleripakkauksen loppuosa ja aloita uusi pakkaus samana päivänä.
Jos olet sunnuntain aloittaja:
Ota 1 pilleri joka päivä sunnuntaihin asti.
Sunnuntaina HEITÄ POIS loput pakkauksesta ja aloita uusi pilleripakkaus samana päivänä.
26. Sinulla ei ehkä ole kuukautisia tässä kuussa, mutta tämä on odotettavissa. Jos kuukautiset jäävät kuitenkin 2 kuukautta peräkkäin, soita lääkärillesi tai terveydenhuollon tarjoajalle, koska saatat olla raskaana.
27. SAATAT tulla raskaaksi, jos harrastat seksiä 7 päivän kuluessa pillereiden väliin jäämisestä. Sinun TÄYTYY käyttää muuta ehkäisymenetelmää (kuten kondomia, vaahtoa tai sientä) varamenetelmänä näiden 7 päivän ajan.
Jos sinä MISS 3 tai ENEMMÄN "aktiiviset" [valkoiset] pillerit peräkkäin (ensimmäisten 3 viikon aikana):
28. Jos olet 1. päivän aloittaja:
HEITÄ POIS pilleripakkauksen loppuosa ja aloita uusi pakkaus samana päivänä.
Jos olet sunnuntain aloittaja:
Ota 1 pilleri joka päivä sunnuntaihin asti.
Sunnuntaina HEITÄ POIS loput pakkauksesta ja aloita uusi pilleripakkaus samana päivänä.
29. Sinulla ei ehkä ole kuukautisia tässä kuussa, mutta tämä on odotettavissa. Jos kuukautiset jäävät kuitenkin 2 kuukautta peräkkäin, soita lääkärillesi tai terveydenhuollon tarjoajalle, koska saatat olla raskaana.
30. SAATAT tulla raskaaksi, jos harrastat seksiä 7 päivän kuluessa pillereiden väliin jäämisestä. Sinun TÄYTYY käyttää muuta ehkäisymenetelmää (kuten kondomia, vaahtoa tai sientä) varamenetelmänä näiden 7 päivän ajan.
MUISTUTUS 28 PÄIVÄN PAKKAUKSISSA
Jos unohdat ottaa yhden kahdesta [vaaleanvihreästä] tai viidestä [keltaisesta] pilleristä viikolla 4:
Heitä pois pillerit, jotka olet unohtanut.
Ota 1 pilleri joka päivä, kunnes pakkaus on tyhjä.
Varamenetelmää ei tarvita.
LOPPUUN, JOS ET OLE VIELÄ VARMA, MITÄ TEHDÄ PILLEILLE, JOITA OLET MYÖNTÄNE
Käytä VARMUUSMENETELMÄA aina, kun harrastat seksiä.
JATKA YKSI "AKTIIVINEN" [VALKOINEN] PILLE JOKA PÄIVÄ, kunnes tavoitat lääkärisi tai terveydenhuollon tarjoajan.
RASKAUS PILLEERIEN Epäonnistumisen vuoksi
Raskauteen johtavien pillereiden epäonnistumisen ilmaantuvuus on noin yksi prosentti (eli yksi raskaus 100 naista kohden vuodessa), jos niitä otetaan joka päivä ohjeiden mukaisesti, mutta tyypillisempi epäonnistumisprosentti on noin 5 %. Jos epäonnistuminen tapahtuu, riski sikiölle on minimaalinen.
RASKAUS Pillereiden LOPETTAMISEN JÄLKEEN
Raskaus saattaa viivästyä, kun lopetat ehkäisytablettien käytön, varsinkin jos kuukautiskiertosi oli epäsäännöllinen ennen ehkäisyvalmisteiden käyttöä. Saattaa olla suositeltavaa lykätä hedelmöitystä, kunnes kuukautiset alkavat säännöllisesti, kun olet lopettanut pillereiden käytön ja haluat raskautta.
Vastasyntyneiden synnynnäisten epämuodostumien määrä ei näytä lisääntyvän, kun raskaus tulee pian pillereiden lopettamisen jälkeen.
YLIANNOSTUS
Vakavia haittavaikutuksia ei ole raportoitu pienten lasten suurten oraalisten ehkäisyvalmisteiden nauttimisen jälkeen. Yliannostus voi aiheuttaa pahoinvointia ja vieroitusvuotoa naisilla. Yliannostustapauksissa ota yhteys lääkäriin, terveydenhuollon tarjoajaan tai apteekkiin.
MUITA TIETOJA
Lääkärisi tai terveydenhuollon tarjoaja kerää sairaus- ja sukuhistorian ennen ehkäisytablettien määräämistä ja tutkii sinut. Fyysinen tarkastus voidaan siirtää toiseen ajankohtaan, jos sitä pyydät ja lääkärisi tai terveydenhuollon tarjoaja katsoo, että sen lykkääminen on hyvä lääketieteellinen käytäntö. Sinun tulee käydä uudelleentarkastuksessa vähintään kerran vuodessa. Muista kertoa lääkärillesi tai terveydenhuollon tarjoajalle, jos suvussasi on jokin aiemmin tässä pakkausselosteessa luetelluista sairauksista. Muista pitää kaikki tapaamiset lääkärisi tai terveydenhuollon tarjoajan kanssa, koska tämä on aika selvittää, onko oraalisten ehkäisyvalmisteiden käytön sivuvaikutuksista varhaisia merkkejä.
Älä käytä lääkettä mihinkään muuhun sairauteen kuin siihen, johon se on määrätty. Tämä lääke on määrätty erityisesti sinulle; Älä anna sitä muille, jotka haluavat ehkäisypillereitä.
ORAALISISTA EHKÄISYOHJEET TERVEYSEDUT
Raskauden ehkäisyn lisäksi yhdistelmäehkäisyvalmisteiden käyttö voi tarjota tiettyjä etuja. He ovat:
- kuukautiskierto voi tulla säännöllisemmäksi.
- verenvirtaus kuukautisten aikana voi olla kevyempää ja vähemmän rautaa menetetään. Siksi raudan puutteesta johtuva anemia on vähemmän todennäköinen.
- kipua tai muita oireita kuukautisten aikana saattaa esiintyä harvemmin.
- Kohdunulkoinen raskaus voi esiintyä harvemmin.
- muita kuin syöpää aiheuttavia kystoja tai kyhmyjä rinnoissa saattaa esiintyä harvemmin.
- akuuttia lantion alueen tulehdussairautta voi esiintyä harvemmin.
- suun kautta otettavien ehkäisyvalmisteiden käyttö voi tarjota jonkin verran suojaa kahdelta syövän muodolta: munasarjasyövältä ja kohdun limakalvosyövältä.
Jos haluat lisätietoja ehkäisypillereistä, kysy lääkäriltäsi, terveydenhuollon tarjoajalta tai apteekista. Heillä on teknisempi esite nimeltä Reseptitiedot, jonka saatat haluta lukea.
