Dostinex 0.25mg, 0.5mg Cabergoline Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Dostinex 0,25 mg on ja miten sitä käytetään?
Dostinex (kabergoliini) on dopamiinireseptorin salpaaja, jota käytetään hormonien epätasapainon hoitoon, jossa veressä on liikaa prolaktiinia (kutsutaan myös hyperprolaktinemiaksi).
Mitä sivuvaikutuksia Dostinexilla on?
Dostinex 0,25 mg:n yleisiä sivuvaikutuksia ovat:
- pahoinvointi,
- oksentelua,
- vatsavaivat tai kipu,
- ruoansulatushäiriöt,
- ummetus,
- kaasu,
- huimaus,
- pyörivä tunne,
- huimaus,
- uneliaisuus,
- hermostuneisuus,
- väsymys,
- päänsärky,
- masentunut,
- kuumia aaltoja,
- tunnottomuus tai pistely tunne tai
- kuiva suu.
Kerro lääkärillesi, jos sinulla on harvinaisia mutta vakavia Dostinexin sivuvaikutuksia, mukaan lukien:
- hengenahdistus,
- jatkuva yskä,
- nilkkojen tai jalkojen turvotus,
- epätavallinen väsymys,
- henkiset/mielialan muutokset (kuten hermostuneisuus),
- epätavalliset voimakkaat halut (kuten lisääntynyt uhkapelaaminen, lisääntynyt seksuaalinen halu),
- näkö muuttuu,
- kipeät kuukautiset tai
- rintojen kipu.
KUVAUS
DOSTINEX-tabletit sisältävät kabergoliinia, dopamiinireseptoriagonistia. Kabergoliinin kemiallinen nimi on 1-[(6-allergolin-8β-yyli)karbonyyli]-1-[3-(dimetyyliamino)propyyli]-3-etyyliurea. Sen empiirinen kaava on C26H37N5O2 ja sen molekyylipaino on 451,62. Rakennekaava on seuraava:
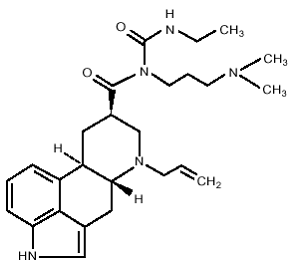
Kabergoliini on valkoinen jauhe, joka liukenee etyylialkoholiin, kloroformiin ja N,N-dimetyyliformamidiin (DMF); liukenee heikosti 0,1 N suolahappoon; liukenee hyvin heikosti n-heksaaniin; ja veteen liukenematon.
Suun kautta annettavat DOSTINEX 0,25 mg tabletit sisältävät 0,5 mg kabergoliinia. Inaktiiviset ainesosat koostuvat leusiinista, USP:stä ja laktoosista, NF.
INDIKAATIOT
DOSTINEX 0,5 mg tabletit on tarkoitettu joko idiopaattisten tai aivolisäkkeen adenoomien aiheuttamien hyperprolaktineemisten häiriöiden hoitoon.
ANNOSTELU JA HALLINNOINTI
Suositeltu DOSTINEX 0,25 mg -tablettien annos hoidon aloittamiseksi on 0,25 mg kahdesti viikossa. Annosta voidaan suurentaa 0,25 mg:lla kahdesti viikossa annokseen 1 mg kahdesti viikossa potilaan seerumin prolaktiinitason mukaan. Ennen hoidon aloittamista on suoritettava kardiovaskulaarinen arviointi ja harkittava kaikukardiografiaa läppäsairauden arvioimiseksi.
Annosta ei saa nostaa nopeammin kuin 4 viikon välein, jotta lääkäri voi arvioida potilaan vasteen jokaiselle annostasolle. Jos potilas ei reagoi riittävästi eikä lisähyötyä havaita suuremmilla annoksilla, tulee käyttää pienintä annosta, jolla saavutettiin maksimaalinen vaste, ja harkittava muita terapeuttisia lähestymistapoja. Pitkäaikaista DOSTINEX 0,25 mg -hoitoa saavien potilaiden sydämen tila tulee arvioida määräajoin ja kaikukardiografiaa tulee harkita.
Kun seerumin prolaktiinitaso on pysynyt normaalina 6 kuukauden ajan, DOSTINEX 0,5 mg -hoito voidaan lopettaa ja seerumin prolaktiinitasoa seurataan säännöllisesti sen määrittämiseksi, pitäisikö DOSTINEX-hoito aloittaa uudelleen. DOSTINEX-hoidon tehon kestoa yli 24 kuukautta ei ole osoitettu.
MITEN TOIMITETAAN
DOSTINEX-tabletit ovat valkoisia, jakouurteisia, kapselin muotoisia tabletteja, jotka sisältävät 0,5 mg kabergoliinia. Jokaisen tabletin toisella puolella on jakouurre ja jakoviivan molemmilla puolilla on kirjain P ja U. Tabletin toiselle puolelle on kaiverrettu numero 700.
DOSTINEX on saatavilla seuraavasti:
Pullossa 8 tablettia NDC 0013-7001-12
Varastointi
Säilytä kontrolloidussa huoneenlämmössä 20–25 °C (68–77 °F) [katso USP ].
Tämän tuotteen etiketti on saatettu päivittää. Katso nykyiset täydelliset reseptitiedot osoitteesta www.pfizer.com
Jakelija: Pharmacia & Upjohn Company Division of Pfizer Inc., NY, NY 10017. Tarkistettu: syyskuu 2014
SIVUVAIKUTUKSET
DOSTINEX 0,25 mg -tablettien turvallisuutta on arvioitu yli 900 potilaalla, joilla oli hyperprolaktiinisia häiriöitä. Useimmat haittatapahtumat olivat vakavuudeltaan lieviä tai kohtalaisia.
viikkoa kestäneessä kaksoissokkoutetussa lumekontrolloidussa tutkimuksessa hoito koostui lumelääkkeestä tai kabergoliinista kiinteillä annoksilla 0,125, 0,5, 0,75 tai 1,0 mg kahdesti viikossa. Ensimmäisen viikon aikana annokset puolitettiin. Koska mahdollinen annosriippuvainen vaikutus havaittiin vain pahoinvoinnin yhteydessä, neljä kabergoliinihoitoryhmää on yhdistetty. Yleisimpien haittavaikutusten ilmaantuvuus lumekontrolloidun tutkimuksen aikana on esitetty seuraavassa taulukossa.
Ilmoitettujen haittatapahtumien ilmaantuvuus 4 viikon, kaksoissokkoutetun, lumekontrolloidun kokeen aikana
Bromokriptiinia koskevan vertailututkimuksen 8 viikon kaksoissokkojaksossa DOSTINEX-hoito (annoksella 0,5 mg kahdesti viikossa) lopetettiin haittatapahtuman vuoksi 4 potilaalla 221:stä (2 %) bromokriptiinin (annoksella) 2,5 mg kahdesti vuorokaudessa) lopetettiin 14 potilaalla 231:stä (6 %). Yleisimmät syyt DOSTINEX-hoidon lopettamiseen olivat päänsärky, pahoinvointi ja oksentelu (3, 2 ja 2 potilasta). yleisimmät syyt bromokriptiinihoidon lopettamiseen olivat pahoinvointi, oksentelu, päänsärky ja huimaus tai huimaus (vastaavasti 10, 3, 3 ja 3 potilasta). Yleisimpien haittavaikutusten ilmaantuvuus bromokriptiinin vertailututkimuksen kaksoissokkoutetussa osassa on esitetty seuraavassa taulukossa.
Raportoitujen haittatapahtumien ilmaantuvuus bromokriptiinin vertailututkimuksen 8 viikon kaksoissokkojakson aikana
Muut haittatapahtumat, joiden ilmaantuvuus oli alle 1,0 % kliinisissä tutkimuksissa, seuraavat.
Keho kokonaisuutena: kasvojen turvotus, flunssan kaltaiset oireet, huonovointisuus
Sydän- ja verisuonijärjestelmä: hypotensio, pyörtyminen, sydämentykytys
Ruoansulatuselimistö: suun kuivuminen, ilmavaivat, ripuli, anoreksia
Aineenvaihdunta- ja ravitsemusjärjestelmä: laihtuminen, painonnousu
Hermosto: uneliaisuus, hermostuneisuus, parestesia, unettomuus, ahdistus
Hengitysjärjestelmä: nenän tukkoisuus, nenäverenvuoto
Iho ja lisäkkeet: akne, kutina
Erityiset aistit: epänormaali näkö
Urogenitaaljärjestelmä: dysmenorrea, lisääntynyt libido
Kabergoliinin turvallisuutta on arvioitu noin 1 200 Parkinsonin tautia sairastavalla potilaalla kontrolloiduissa ja kontrolloimattomissa tutkimuksissa annoksilla 11,5 mg/vrk, mikä ylittää suuresti kabergoliinin enimmäisannoksen, joka on suositeltu hyperprolaktineemisiin sairauksiin. Hyperprolaktiinisia sairauksia sairastavilla potilailla esiintyneiden haittatapahtumien lisäksi yleisimmät haittatapahtumat Parkinsonin tautia sairastavilla potilailla olivat dyskinesia, hallusinaatiot, sekavuus ja perifeerinen turvotus. Sydämen vajaatoimintaa, pleuraeffuusiota, keuhkofibroosia ja maha- tai pohjukaissuolihaavaa esiintyi harvoin. Yksi konstriktiivinen perikardiittitapaus on raportoitu.
Markkinoinnin jälkeiset seurantatiedot
Seuraavia tapahtumia on raportoitu DOSTINEXin käytön yhteydessä: sydämen läppäreaktiot ja ekstrakardiaaliset fibroottiset reaktiot, (ks. VAROITUKSET , Sydämen valvulopatia ja sydämenulkoiset fibroottiset reaktiot ).
Muita kabergoliiniin liittyviä tapahtumia on raportoitu: hyperseksuaalisuus, lisääntynyt libido ja patologinen pelihimo (ks. VAROTOIMENPITEET , Psykiatrinen ). Lisäksi DOSTINEXia käyttävillä potilailla on raportoitu hiustenlähtöä, aggressiota ja psykoottista häiriötä. Jotkut näistä raporteista ovat olleet potilailla, joilla on aiemmin ollut haittavaikutuksia dopamiiniagonistivalmisteista.
HUUMEIDEN VUOROVAIKUTUKSET
DOSTINEX 0,5 mg:aa ei tule antaa samanaikaisesti D-antagonistien, kuten fenotiatsiinien, butyrofenonien, tioksanteenien tai metoklopramidin, kanssa.
VAROITUKSET
Raskaus
Dopamiiniagonisteja ei yleensä tule käyttää potilailla, joilla on raskauden aiheuttama verenpainetauti, esimerkiksi preeklampsia, eklampsia ja synnytyksen jälkeinen hypertensio, ellei mahdollisen hyödyn katsota olevan mahdollista riskiä suurempi.
Fibroottiset komplikaatiot
Sydämen valvulopatia
Kaikille potilaille tulee tehdä kardiovaskulaarinen arviointi, mukaan lukien kaikukardiogrammi, jotta voidaan arvioida mahdollisen läppäsairauden esiintyminen. Jos läppäsairaus havaitaan, potilasta ei tule hoitaa DOSTINEX-valmisteella. (Katso VASTA-AIHEET ) Markkinoille tulon jälkeen DOSTINEXia saaneilla potilailla on raportoitu sydänläppävaurioita. Näitä tapauksia on yleensä esiintynyt Parkinsonin taudin hoidossa käytettäessä suuria DOSTINEX-annoksia (> 2 mg/vrk). Sydämen läppävauriotapauksia on raportoitu myös potilailla, jotka ovat saaneet pienempiä DOSTINEX-annoksia hyperprolaktineemisten häiriöiden hoitoon.
Yhdistyneessä kuningaskunnassa, Italiassa ja Alankomaissa suoritettiin usean maan kattava retrospektiivinen kohorttitutkimus, jossa käytettiin yleislääkärin kirjauksia ja tietueiden linkitysjärjestelmiä, jotta voidaan arvioida yhteyttä dopamiiniagonistien, mukaan lukien kabergoliinin (n = 27 812), uuden käytön välillä Parkinsonin taudin ja hyperprolaktinemian ja sydänsairauksien välillä. läppäreurgitaatio (CVR), muut fibroosit ja muut kardiopulmonaaliset tapahtumat enintään 12 vuoden seurannan aikana. Tässä tutkimuksessa kabergoliinin käyttö Parkinsonin tautia sairastavien henkilöiden keskuudessa liittyi kohonneeseen CVR-riskiin verrattuna muihin kuin torajyväperäisiin dopamiiniagonisteihin (DA) ja levodopaan [Insidence Rate (IR) per 10 000 henkilövuotta 68,1 (95) % luottamusväli (CI): 37,2–115,3 kabergoliinille vs. 10,0 (95 % CI: 5,2–19,4) ei-ergot-DA:lle ja 11,3 (95 % CI: 7,2–17,0) levodopalle]. Tutkimusanalyysissä, joka koski dopamiiniagonistihoitoa sairastavia hyperprolaktinemiaa (n=8 386), kabergoliinille altistuneilla ei ollut kohonnutta CVR:n riskiä verrattuna ei-käyttäjiin (n=15 147). Havainnot, jotka koskevat kabergoliinihoitoon liittyvää CVR-riskiä Parkinsonin tautia sairastaville (lisääntynyt riski) ja hyperprolaktinemiaa sairastaville (ei lisääntynyt riski), ovat yhdenmukaisia muiden julkaistujen tutkimusten havaintojen kanssa.
Lääkäreiden tulee käyttää pienintä tehokasta DOSTINEX-annosta hyperprolaktineemisten häiriöiden hoitoon ja arvioida säännöllisesti uudelleen DOSTINEX-hoidon jatkamisen tarvetta. Hoidon aloittamisen jälkeen tulee suorittaa kliininen ja diagnostinen seuranta (esimerkiksi rintakehän röntgenkuvaus, TT-skannaus ja sydämen kaikukuvaus) sydämen läppävaurion riskin arvioimiseksi. Suositeltu rutiininomaisen sydämen kaikukuvauksen taajuus on 6–12 kuukauden välein tai kliinisten oireiden mukaan, kuten turvotusta, uutta sydämen sivuääniä, hengenahdistusta tai sydämen vajaatoimintaa.
DOSTINEX-hoito tulee lopettaa, jos kaikukardiogrammi paljastaa uuden läppäreurgitaation, läppärajoituksen tai läppälehtien paksuuntumisen.
DOSTINEXia tulee käyttää varoen potilailla, jotka ovat altistuneet muille läppäläppäsairauksiin liittyville lääkkeille.

Ekstrakardiaaliset fibroottiset reaktiot
Markkinoille tulon jälkeen DOSTINEXin annon jälkeen on raportoitu keuhkopussin, perikardiaalisen ja retroperitoneaalisen fibroosin tapauksia. Jotkut raportit koskivat potilaita, joita on aiemmin hoidettu muilla ergotiinilla dopamiiniagonisteilla. DOSTINEXia ei tule käyttää potilaille, joilla on aiemmin ollut sydämen tai sydämen ulkopuolisia fibroottisia häiriöitä.
Fibroottiset sairaudet voivat alkaa salakavalasti, ja potilaita tulee tarkkailla etenevän fibroosin ilmentymien varalta. Siksi hoidon aikana on kiinnitettävä huomiota seuraaviin merkkeihin ja oireisiin:
- Pleuro-keuhkosairaus, kuten hengenahdistus, hengenahdistus, jatkuva yskä tai rintakipu.
- Munuaisten vajaatoiminta tai virtsanjohtimen/vatsan verisuonten tukkeuma, jota voi esiintyä lanteen/kylkeen ja alaraajojen turvotuksen kanssa, sekä mahdolliset vatsan massat tai arkuus, jotka voivat viitata retroperitoneaaliseen fibroosiin.
- Sydämen vajaatoiminta: Läppä- ja perikardiaalifibroositapaukset ovat usein ilmenneet sydämen vajaatoimintana. Siksi läppäfibroosi (ja supistava perikardiitti) tulee sulkea pois, jos tällaisia oireita ilmenee.
Kliinistä ja diagnostista seurantaa, kuten punasolujen sedimentaationopeutta, rintakehän röntgenkuvausta, seerumin kreatiniinimittauksia ja muita tutkimuksia tulee harkita lähtötilanteessa ja tarvittaessa potilaiden DOSTINEX-hoidon aikana.
Keuhkopussin effuusion tai keuhkofibroosin diagnoosin jälkeen DOSTINEX-hoidon lopettamisen on raportoitu parantavan merkkejä ja oireita.
VAROTOIMENPITEET
Kenraali
Yli 1,0 mg:n aloitusannokset voivat aiheuttaa ortostaattista hypotensiota. Varovaisuutta tulee noudattaa, kun DOSTINEXia annetaan muiden verenpainetta alentavan lääkkeiden kanssa.
Synnytyksen jälkeinen imetyksen estäminen tai tukahduttaminen
DOSTINEX 0,25 mg ei ole tarkoitettu fysiologisen laktaation estämiseen tai tukahduttamiseen. Bromokriptiinin, toisen dopamiiniagonistin, käyttö tähän tarkoitukseen on liitetty verenpainetautiin, aivohalvaukseen ja kohtauksiin.
Maksan vajaatoiminta
Koska kabergoliini metaboloituu laajalti maksassa, varovaisuutta ja huolellista seurantaa tulee noudattaa, kun DOSTINEX 0,5 mg -valmistetta annetaan potilaille, joilla on maksan vajaatoiminta.
Psykiatrinen
Patologista pelihimoa, lisääntynyttä libidoa ja hyperseksuaalisuutta on raportoitu potilailla, joita on hoidettu dopamiiniagonisteilla, mukaan lukien kabergoliinilla. Tämä on yleensä korjautunut, kun annosta pienennettiin tai hoito lopetettiin (ks Markkinoinnin jälkeiset seurantatiedot ).
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeenisuustutkimukset suoritettiin hiirillä ja rotilla kabergoliinilla annettiin letkulla annoksilla 0,98 mg/kg/vrk ja 0,32 mg/kg/vrk. Nämä annokset ovat 7-kertaisia ja 4-kertaisia ihmisille suositeltuihin enimmäisannoksiin verrattuna, jotka lasketaan kehon pinta-alan perusteella käyttämällä kokonaismg/m/viikko jyrsijöillä ja mg/m/viikko 50-kiloiselle ihmiselle.
Kohdunkaulan ja kohdun leiomyoomien ja kohdun leiomyosarkoomien ilmaantuvuus lisääntyi hieman hiirillä. Rotilla kohdunkaulan ja kohdun pahanlaatuisten kasvainten ja interstitiaalisten solujen adenoomien määrä lisääntyi hieman. Kasvaimien esiintyminen naarasjyrsijöillä saattaa liittyä prolaktiinin erityksen pitkäkestoiseen suppressioon, koska prolaktiinia tarvitaan jyrsijöillä keltarauhasen ylläpitämiseen. Prolaktiinin puuttuessa estrogeeni/progesteroni-suhde kasvaa, mikä lisää kohdun kasvainten riskiä. Urosjyrsijöillä seerumin prolaktiinipitoisuuden lasku liittyi seerumin luteinisoivan hormonin nousuun, jonka uskotaan olevan kompensoiva vaikutus kivesten steroidisynteesin ylläpitämiseksi. Koska näiden hormonaalisten mekanismien uskotaan olevan lajispesifisiä, näiden kasvainten merkitystä ihmisille ei tiedetä.
Kabergoliinin mutageeninen potentiaali arvioitiin ja todettiin negatiiviseksi useissa in vitro -testeissä. Näihin kokeisiin sisältyivät bakteerimutaatiotesti (Ames) Salmonella typhimuriumilla, geenimutaatiomääritys Schizosaccharomyces pombe P1- ja V79 kiinanhamsterin soluilla, DNA-vaurio ja korjaus Saccharomyces cerevisiae D4:ssä sekä kromosomipoikkeamat ihmisen lymfosyyteissä. Kabergoliini oli myös negatiivinen hiiren luuytimen mikrotumatestissä.
Naarasrotilla vuorokausiannos 0,003 mg/kg 2 viikon ajan ennen parittelua ja koko parittelujakson ajan esti hedelmöittymistä. Tämä annos on noin 1/28 ihmiselle suositellusta enimmäisannoksesta, joka lasketaan kehon pinta-alan perusteella käyttämällä rottien kokonaismäärää mg/m/viikko ja 50 kg painavalla ihmisellä mg/m/viikko.
Raskaus
Teratogeeniset vaikutukset – luokka B
Lisääntymistutkimuksia on tehty kabergoliinilla hiirillä, rotilla ja kaniineilla, jotka on annettu letkulla. (Tässä osiossa ihmisille suositellun enimmäisannoksen kerrannaiset lasketaan kehon pinta-alan perusteella käyttämällä eläimille kokonaismg/m/viikko ja 50 kg painaville ihmisille mg/m/viikko.)
Maternotoksisia vaikutuksia esiintyi, mutta ei teratogeenisia vaikutuksia hiirillä, joille annettiin kabergoliinia annoksilla 8 mg/kg/vrk asti (noin 55 kertaa ihmiselle suositeltu enimmäisannos) organogeneesin aikana.
Annos 0,012 mg/kg/vrk (noin 1/7 suurimmasta suositellusta ihmisannoksesta) rotilla organogeneesin aikana lisäsi implantaation jälkeisiä alkio- ja sikiötappioita. Nämä häviöt voivat johtua kabergoliinin prolaktiinia estävistä ominaisuuksista rotilla. Päivittäisillä annoksilla 0,5 mg/kg/vrk (noin 19 kertaa ihmiselle suositeltu enimmäisannos) kabergoliini aiheutti kanin organogeneesin aikana emolle toksisuutta, jolle oli tunnusomaista painon lasku ja ruoan kulutuksen väheneminen. Annokset 4 mg/kg/vrk (noin 150 kertaa ihmiselle suositeltuun enimmäisannos) kaniinin organogeneesin aikana lisäsivät erilaisten epämuodostumien esiintymistä. Toisessa kaniineilla tehdyssä tutkimuksessa ei kuitenkaan havaittu hoitoon liittyviä epämuodostumia tai alkiofetotoksisuutta annoksilla 8 mg/kg/vrk asti (noin 300 kertaa ihmiselle suositeltu enimmäisannos).
Rotilla annokset, jotka ylittivät 0,003 mg/kg/vrk (noin 1/28 ihmiselle suositellusta enimmäisannoksesta) 6 päivää ennen synnytystä ja koko laktaatiojakson ajan, estivät kasvua ja aiheuttivat jälkeläisten kuoleman maidonerityksen heikkenemisen vuoksi.
Ei kuitenkaan ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana olevilla naisilla. Koska eläinten lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, tätä lääkettä tulee käyttää raskauden aikana vain, jos se on selvästi tarpeen.
Imettävät äidit
Ei tiedetä, erittyykö tämä lääke äidinmaitoon. Koska monet lääkkeet erittyvät äidinmaitoon ja koska kabergoliini voi aiheuttaa vakavia haittavaikutuksia imeväisille, on päätettävä, lopetetaanko imetys vai lopetetaanko lääkkeen käyttö ottaen huomioon lääkkeen merkitys äidille. DOSTINEXin käyttöä fysiologisen imetyksen estämiseen tai tukahduttamiseen ei suositella (ks. VAROTOIMENPITEET jakso).
Kabergoliinin prolaktiinia alentava vaikutus viittaa siihen, että se häiritsee imetystä. Tämän imetyksen häiriintymisen vuoksi DOSTINEX 0,5 mg -valmistetta ei tule antaa synnytyksen jälkeen imettäville tai imetystä suunnitteleville naisille.
Käyttö lapsille
DOSTINEX 0,5 mg:n turvallisuutta ja tehokkuutta lapsipotilailla ei ole osoitettu.
Geriatrinen käyttö
DOSTINEX 0,5 mg:n kliinisissä tutkimuksissa ei ollut riittävästi 65-vuotiaita ja sitä vanhempia koehenkilöitä sen määrittämiseksi, reagoivatko he eri tavalla kuin nuoremmat potilaat. Muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa. Yleensä iäkkään potilaan annoksen valinnassa tulee olla varovainen, yleensä alkaen annosalueen alimmasta päästä, mikä heijastaa maksan, munuaisten tai sydämen toiminnan heikkenemisen sekä samanaikaisen sairauden tai muun lääkehoidon yleisyyttä.
YLIANNOSTUS
Yliannostus saattaa aiheuttaa nenän tukkoisuutta, pyörtymistä tai hallusinaatioita. Tarvittaessa on ryhdyttävä verenpainetta tukeviin toimenpiteisiin.
VASTA-AIHEET
DOSTINEX-tabletit ovat vasta-aiheisia potilaille, joilla on:
- Hallitsematon verenpainetauti tai tunnettu yliherkkyys torajyväjohdannaisille.
- Anamneesi sydämen läppähäiriöt, kuten anatomiset todisteet minkä tahansa läppäläppähäiriöstä viittaavat, määritettynä hoitoa edeltävällä arvioinnilla, mukaan lukien kaikukardiografinen näyttö läppälehtien paksuuntumisesta, läpän ahtaumasta tai sekaläpän ahtauma-stenoosista. (Katso VAROITUKSET )
- Aiempi keuhko-, sydänlihas- tai retroperitoneaalinen fibroottinen sairaus. (Katso VAROITUKSET )
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Prolaktiinin eritys aivolisäkkeen etuosassa on pääosin hypotalamuksen estokontrollin alaisena, mikä johtuu todennäköisesti tuberoinfundibulaaristen hermosolujen dopamiinin vapautumisesta. Kabergoliini on pitkävaikutteinen dopamiinireseptoriagonisti, jolla on korkea affiniteetti D2-reseptoreihin. In vitro -tutkimusten tulokset osoittavat, että kabergoliinilla on suora estävä vaikutus rotan aivolisäkkeen laktotrofien prolaktiinin erittymiseen. Kabergoliini alensi seerumin prolaktiinipitoisuutta reserpinoiduilla rotilla. Reseptoreihin sitoutumistutkimukset osoittavat, että kabergoliinilla on alhainen affiniteetti dopamiini D1-, α1- ja α2-adrenergisiin reseptoreihin sekä 5-HT1- ja 5-HT2-serotoniinireseptoreihin.
Kliiniset tutkimukset
DOSTINEX 0,25 mg:n prolaktiinia alentava teho osoitettiin hyperprolaktinemisillä naisilla kahdessa satunnaistetussa, kaksoissokkoutetussa, vertailututkimuksessa, joista toisessa käytettiin lumelääkettä ja toisessa bromokriptiiniä. Lumekontrolloidussa tutkimuksessa (plasebo n = 20; kabergoliini n = 168) DOSTINEX 0,5 mg aiheutti annoksesta riippuvan seerumin prolaktiinipitoisuuden laskun prolaktiinin normalisoituessa 4 viikon hoidon jälkeen 29 %:lla, 76 %:lla, 74 %:lla ja 95:llä. % potilaista, jotka saivat 0,125, 0,5, 0,75 ja 1,0 mg kahdesti viikossa.
Vertailevan bromokriptiinitutkimuksen 8 viikon kaksoissokkojaksossa (kabergoliini n = 223; bromokriptiini n = 236 hoitotarkoitusanalyysissä) prolaktiini normalisoitui 77 %:lla potilaista, joita hoidettiin DOSTINEXilla 0,5 mg:lla. kahdesti viikossa verrattuna 59 %:iin niistä, joita hoidettiin bromokriptiinillä annoksella 2,5 mg kahdesti vuorokaudessa. Kuukautiset palautuivat 77 %:lla DOSTINEX-hoitoa saaneista naisista, kun taas bromokriptiinihoitoa saaneista naisista 70 %:lla. Galaktorreapotilaista tämä oire hävisi 73 %:lla DOSTINEX-hoitoa saaneista ja 56 %:lla bromokriptiinihoitoa saaneista.
Farmakokinetiikka
Imeytyminen
Kun 12 terveelle aikuiselle vapaaehtoiselle annettiin kerta-annos 0,5–1,5 mg, kabergoliinin keskimääräiset huippupitoisuudet plasmassa, 30–70 pikogrammaa (pg)/ml, havaittiin 2–3 tunnin kuluessa. Annosalueella 0,5–7 mg kabergoliinin plasmatasot näyttivät olevan suhteessa annokseen 12 terveellä aikuisella vapaaehtoisella ja yhdeksällä aikuisella parkinsonipotilaalla. Toistuvan annoksen tutkimus 12 terveellä vapaaehtoisella viittaa siihen, että vakaan tilan pitoisuudet kerran viikossa annostellun jälkeen ovat kaksin-kolme kertaa suuremmat kuin kerta-annoksen jälkeen. Kabergoliinin absoluuttista biologista hyötyosuutta ei tunneta. Merkittävä osa annetusta annoksesta käy läpi ensikierron. Kabergoliinin eliminaation puoliintumisaika, joka arvioitiin 12 terveen koehenkilön virtsatiedoista, vaihteli 63-69 tunnin välillä. Kabergoliinin pitkittynyt prolaktiinia alentava vaikutus saattaa liittyä sen hitaaseen eliminoitumiseen ja pitkään puoliintumisaikaan.
Jakelu
Eläimillä kabergoliini (ja/tai sen metaboliitit) on osoittanut laajaa kudosten jakautumista kokonaisradioaktiivisuuden perusteella. Aivolisäkkeen radioaktiivisuus ylitti plasman radioaktiivisuuden > 100-kertaisesti ja eliminoitui noin 60 tunnin puoliintumisajalla. Tämä havainto on yhdenmukainen lääkkeen pitkäkestoisen prolaktiinia alentavan vaikutuksen kanssa. Raskaana olevilla rotilla tehdyt koko kehon autoradiografiatutkimukset eivät osoittaneet sikiön imeytymistä, mutta kohdun seinämässä oli suuria määriä. Imettävien rottien maidosta havaittu merkittävä radioaktiivisuus (emä ja metaboliitit) viittaa mahdolliseen altistumiseen imeväisille. Lääke leviää laajasti koko kehoon. Kabergoliini sitoutuu kohtalaisesti (40–42 %) ihmisen plasman proteiineihin pitoisuudesta riippumattomalla tavalla. Hyvin proteiineihin sitoutuneiden lääkkeiden samanaikainen annostelu ei todennäköisesti vaikuta sen jakautumiseen.
Aineenvaihdunta
Sekä eläimissä että ihmisissä kabergoliini metaboloituu laajalti, pääasiassa asyyliureasidoksen tai ureaosan hydrolyysin kautta. Sytokromi P-450 -välitteinen metabolia näyttää olevan minimaalista. Kabergoliini ei aiheuta entsyymien induktiota ja/tai estoa rotalla. Asyyliurea- tai urea-osan hydrolyysi poistaa kabergoliinin prolaktiinia alentavan vaikutuksen, ja tähän mennessä tunnistetut tärkeimmät metaboliitit eivät vaikuta terapeuttiseen vaikutukseen.
Erittyminen
Kun radioaktiivista kabergoliinia annettiin suun kautta viidelle terveelle vapaaehtoiselle, noin 22 % ja 60 % annoksesta erittyi 20 päivän kuluessa virtsaan ja 60 % ulosteeseen. Alle 4 % annoksesta erittyi muuttumattomana virtsaan. Kabergoliinin ei-renaalinen puhdistuma on noin 3,2 l/min ja munuaispuhdistuma 0,08 l/min. Virtsaan erittyminen hyperprolaktiinisilla potilailla oli samanlaista.
Erikoispopulaatiot
Munuaisten vajaatoiminta
Kabergoliinin farmakokinetiikka ei muuttunut 12 potilaalla, joilla oli keskivaikea tai vaikea munuaisten vajaatoiminta kreatiniinipuhdistuman perusteella.
Maksan vajaatoiminta
12 potilaalla, joilla oli lievä tai keskivaikea maksan vajaatoiminta (Child-Pugh-pistemäärä ≤ 10), ei havaittu vaikutusta kabergoliinin keskimääräiseen Cmax-arvoon tai plasman pitoisuuskäyrän alla olevaan pinta-alaan (AUC). Potilailla, joilla on vaikea vajaatoiminta (Child-Pugh-pistemäärä > 10), kabergoliinin keskimääräinen Cmax ja AUC ovat kuitenkin suurentuneet huomattavasti, ja siksi he vaativat varovaisuutta.
Vanhukset
Iän vaikutusta kabergoliinin farmakokinetiikkaan ei ole tutkittu.
Ruoan ja lääkkeen vuorovaikutus
12 terveellä aikuisella vapaaehtoisella ruoka ei muuttanut kabergoliinin kinetiikkaa.
Farmakodynamiikka
Annosvaste, johon liittyy plasman prolaktiinin esto, maksimaalisen vaikutuksen alkaminen ja vaikutuksen kesto, on dokumentoitu terveille vapaaehtoisille (0,05-1,5 mg) ja hyperprolaktineemisille potilaille (0,3-1 mg) annettujen kerta-annosten jälkeen. Vapaaehtoisilla prolaktiinin esto oli ilmeistä > 0,2 mg:n annoksilla, kun taas ≥ 0,5 mg:n annokset aiheuttivat suurimman suppression useimmissa koehenkilöissä. Suuremmat annokset aiheuttavat prolaktiinin suppressiota suuremmassa osassa potilaita, ja vaikutus alkaa aikaisemmin ja kestää kauemmin. 12 terveellä vapaaehtoisella 0,5 mg:n, 1,5 mg:n ja 1,5 mg:n annokset johtivat täydelliseen prolaktiinin estoon, ja maksimivaikutus saavutettiin 3 tunnin kuluessa 92–100 prosentilla koehenkilöistä 1 ja 1,5 mg:n annoksilla, kun taas 50 prosentilla koehenkilöistä 0,5 mg:n annoksilla. mg annos.
Hyperprolaktineemisilla potilailla (N=51) maksimaalinen prolaktiinin lasku 0,6 mg:n kabergoliinin kerta-annoksen jälkeen oli verrattavissa 2,5 mg:aan bromokriptiiniä; vaikutuksen kesto oli kuitenkin huomattavasti pidempi (14 päivää vs. 24 tuntia). Aika maksimaaliseen vaikutukseen oli lyhyempi bromokriptiinillä kuin kabergoliinilla (6 tuntia vs. 48 tuntia).
72 terveellä vapaaehtoisella kabergoliinin kerta-annokset tai useat annokset (2 mg:aan asti) johtivat selektiiviseen prolaktiinin estoon ilman näkyvää vaikutusta muihin aivolisäkkeen etuosan hormoneihin (GH, FSH, LH, ACTH ja TSH) tai kortisoliin.
POTILASTIEDOT
Potilaita tulee neuvoa ilmoittamaan lääkärilleen, jos he epäilevät olevansa raskaana, tulevat raskaaksi tai aikovat tulla raskaaksi hoidon aikana. Raskaustesti tulee tehdä, jos epäillään raskautta, ja hoidon jatkamisesta tulee keskustella lääkärin kanssa.
Potilaiden tulee ilmoittaa lääkärilleen, jos heillä on hengenahdistusta, jatkuvaa yskää, hengitysvaikeuksia makuulla tai raajojen turvotusta.
