Proscar 5mg Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mikä Proscar 5mg on ja miten sitä käytetään?
Proscar on reseptilääke, jota käytetään hyvänlaatuisen eturauhasen liikakasvun ja androgeenisen hiustenlähtöön liittyvien oireiden hoitoon. Tämä lääke on tarkoitettu vain miehille. Proscar 5mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Proscar kuuluu lääkeryhmään, jota kutsutaan 5-alfa-reduktaasin estäjiksi.
Ei tiedetä, onko Proscar 5 mg turvallinen ja tehokas lapsille.
Mitkä ovat Proscar 5mg:n mahdolliset sivuvaikutukset?
Proscar voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- vaikea tai jatkuva pahoinvointi,
- vaikeuksia hengittää,
- kasvojen, huulten, kielen tai kurkun turvotus,
- rintojen kyhmyt,
- rintojen kipu tai arkuus,
- nännivuoto, ja
- muut rintojen muutokset
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Proscarin yleisimpiä sivuvaikutuksia ovat:
- kiinnostuksen menetys seksiin,
- impotenssi,
- vaikeuksia saada orgasmi ja
- epänormaali siemensyöksy
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Proscarin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
PROSCAR (finasteridi), synteettinen 4-atsasteroidiyhdiste, on spesifinen steroidityypin II 5α-reduktaasin estäjä, solunsisäinen entsyymi, joka muuttaa androgeenitestosteronin 5α-dihydrotestosteroniksi (DHT).
Finasteridi on 4-atsaandrost-1-eeni-17-karboksamidi, N-(1,1-dimetyylietyyli)-3-okso-, (5a,17ß)-. Finasteridin empiirinen kaava on C23H36N2O2 ja sen molekyylipaino on 372,55. Sen rakennekaava on:
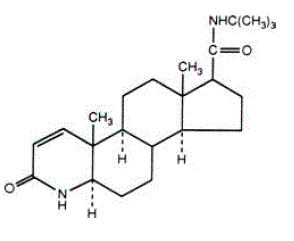
Finasteridi on valkoinen kiteinen jauhe, jonka sulamispiste on lähellä 250 °C. Se liukenee vapaasti kloroformiin ja alempien alkoholien liuottimiin, mutta on käytännössä liukenematon veteen.
Suun kautta annettavat PROSCAR (finasteridi) tabletit ovat kalvopäällysteisiä tabletteja, jotka sisältävät 5 mg finasteridia ja seuraavia inaktiivisia aineosia: vesipitoinen laktoosi, mikrokiteinen selluloosa, esigelatinoitu tärkkelys, natriumtärkkelysglykolaatti, hydroksipropyyliselluloosa LF, hydroksipropyylimetyylimagnesiumselluloosa, titataaniselluloosa, . , talkki, dokusaattinatrium, FD&C Blue 2 -alumiinilakka ja keltainen rautaoksidi.
INDIKAATIOT
Monoterapia
PROSCAR® on tarkoitettu oireisen hyvänlaatuisen eturauhasen liikakasvun (BPH) hoitoon miehillä, joilla on suurentunut eturauhanen:
- Parantaa oireita
- Vähennä akuutin virtsan pidättymisen riskiä
- Vähennä leikkaustarpeen riskiä, mukaan lukien eturauhasen transuretraalinen resektio (TURP) ja eturauhasen poisto.
Yhdistelmä alfa-salpaajan kanssa
PROSCAR 5 mg:n annostelu yhdessä alfasalpaajan doksatsosiinin kanssa on tarkoitettu vähentämään BPH:n oireenmukaisen etenemisen riskiä (vahvistettu ≥4 pisteen nousu American Urological Associationin (AUA) oirepisteissä).
Käyttörajoitukset
PROSCARia ei ole hyväksytty eturauhassyövän ehkäisyyn.
ANNOSTELU JA HALLINNOINTI
PROSCAR voidaan antaa aterian yhteydessä tai ilman.
Monoterapia
Suositeltu PROSCAR-annos on yksi tabletti (5 mg), joka otetaan kerran päivässä [katso Kliiniset tutkimukset ].
Yhdistelmä alfa-salpaajan kanssa
Suositeltu PROSCAR-annos on yksi tabletti (5 mg) kerran päivässä yhdessä alfasalpaajan doksatsosiinin kanssa [ks. Kliiniset tutkimukset ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
5 mg:n sininen, muunneltu omenan muotoinen, kalvopäällysteinen tabletti, jonka toisella puolella on koodi MSD 72 ja toisella puolella PROSCAR 5 mg.
Varastointi ja käsittely
Nro 3094 - PROSCAR-tabletit 5 mg ovat sinisiä, muunneltuja omenan muotoisia, kalvopäällysteisiä tabletteja, joiden toisella puolella on koodi MSD 72 ja toisella puolella PROSCAR. Ne toimitetaan seuraavasti:
NDC 0006-0072-31 käyttöyksikköä 30 kpl pulloja NDC 0006-0072-58 käyttöyksikkö 100 pulloa.
Varastointi ja käsittely
Säilytä huoneenlämmössä alle 30°C (86°F). Suojaa valolta ja pidä säiliö tiiviisti suljettuna.
Naiset eivät saa käsitellä murskattuja tai rikkoutuneita PROSCAR 5 mg tabletteja ollessaan raskaana tai saattavat olla raskaana, koska finasteridi voi imeytyä ja aiheuttaa mahdollisen riskin miessikiölle [ks. VAROITUKSET JA VAROTOIMET  ja  Käyttö tietyissä populaatioissa ].
Jakelija: Merck Sharp & Dohme Corp., MERCK & CO.,INC:n tytäryhtiö, Whitehouse Station, NJ 08889, USA. Tarkistettu: kesäkuuta 2021
SIVUVAIKUTUKSET
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida verrata suoraan toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta kliinisissä käytännöissä havaittuja nopeuksia.
4-vuotinen lumekontrolloitu tutkimus (PLESS)
PLESS-tutkimuksessa 1524 PROSCAR-hoitoa saaneen potilaan ja 1516 lumelääkettä saaneen potilaan turvallisuutta arvioitiin neljän vuoden ajan. Yleisimmin raportoidut haittavaikutukset liittyivät seksuaaliseen toimintaan. 3,7 % (57 potilasta) PROSCAR 5 mg:lla ja 2,1 % (32 potilasta) lumelääkettä keskeytti hoidon seksuaaliseen toimintaan liittyvien haittavaikutusten vuoksi, jotka ovat yleisimmin raportoituja haittavaikutuksia.
Taulukossa 1 esitetään ainoat kliiniset haittavaikutukset, joita tutkija pitää mahdollisesti, todennäköisesti tai varmasti lääkkeeseen liittyvinä ja joiden esiintyvyys PROSCAR 5 mg:lla oli ≥ 1 % ja suurempi kuin lumelääke 4 vuoden aikana. Tutkimuksen vuosina 2–4 ei ollut merkittävää eroa hoitoryhmien välillä impotenssin, heikentyneen libido- ja siemensyöksyhäiriöiden ilmaantuvuuksissa.
Vaiheen III tutkimukset ja 5 vuoden pidennykset
Haittavaikutusten profiili 1 vuoden lumekontrolloiduissa faasin III tutkimuksissa, 5 vuoden avoimissa jatkotutkimuksissa ja PLESS:ssä olivat samanlaiset.
Eturauhasen oireiden lääketieteellinen hoito (MTOPS) -tutkimus
MTOPS-tutkimuksessa 3047 miestä, joilla oli oireinen BPH, satunnaistettiin saamaan PROSCARia 5 mg/vrk (n=768), doksatsosiinia 4 tai 8 mg/vrk (n=756), PROSCARin 5 mg/vrk ja doksatsosiinin 4 tai yhdistelmää. 8 mg/vrk (n=786) tai lumelääke (n=737) 4–6 vuoden ajan. [Katso Kliiniset tutkimukset .]
Taulukossa 2 on lueteltu lääkkeisiin liittyvien haittavaikutusten ilmaantuvuus, jonka ilmoitti ≥2 % potilaista missä tahansa hoitoryhmässä MTOPS-tutkimuksessa.
Yksittäiset haittavaikutukset, joita esiintyi useammin yhdistelmäryhmässä kuin kummallakaan lääkkeellä yksinään, olivat: voimattomuus, posturaalinen hypotensio, perifeerinen turvotus, huimaus, heikentynyt libido, nuha, epänormaali siemensyöksy, impotenssi ja epänormaali seksuaalinen toiminta (katso taulukko 2). Näistä epänormaalin siemensyöksyn ilmaantuvuus potilailla, jotka saivat yhdistelmähoitoa, oli verrattavissa näiden kahden monoterapian yhteydessä raportoitujen haittavaikutusten ilmaantuvuuden summaan.
Finasteridin ja doksatsosiinin yhdistelmähoitoon ei liittynyt uusia kliinisiä haittavaikutuksia.
Neljä MTOPS-potilasta ilmoitti haitallisesta rintasyövästä. Kolme näistä potilaista sai vain finasteridia ja yksi yhdistelmähoitoa. [Katso Pitkän aikavälin tiedot .]
MTOPS-tutkimusta ei erityisesti suunniteltu tekemään tilastollisia vertailuja ryhmien välillä raportoitujen haittavaikutusten osalta. Lisäksi suorat turvallisuustietojen vertailut MTOPS-tutkimuksen ja aiempien yksittäisten aineiden tutkimusten välillä eivät välttämättä ole tarkoituksenmukaisia potilaspopulaatiossa, annostuksessa tai annostusohjelmassa ja muissa menettely- ja tutkimuksen suunnitteluelementeissä olevien erojen perusteella.
Pitkän aikavälin tiedot
Korkea-asteen eturauhassyöpä
PCPT-tutkimus oli 7 vuotta kestänyt satunnaistettu, kaksoissokkoutettu, lumekontrolloitu tutkimus, johon osallistui 18 882 ≥55-vuotiasta miestä, joilla oli normaali digitaalinen peräsuolen tutkimus ja PSA ≤3,0 ng/ml. Miehet saivat joko PROSCARia (finasteridi 5 mg) tai lumelääkettä päivittäin. Potilaat arvioitiin vuosittain PSA- ja digitaalisilla peräsuolen tutkimuksilla. Biopsiat otettiin kohonneen PSA:n, epänormaalin digitaalisen peräsuolentutkimuksen tai tutkimuksen päättymisen vuoksi. Gleason-pistemäärän 8-10 eturauhassyövän ilmaantuvuus oli korkeampi finasteridilla hoidetuilla miehillä (1,8 %) kuin lumelääkettä saaneilla (1,1 %) [ks. INDIKAATIOT  ja  VAROITUKSET JA VAROTOIMET ]. Neljä vuotta kestäneessä lumekontrolloidussa kliinisessä tutkimuksessa toisella 5α-reduktaasin estäjällä (dutasteridi, AVODART) havaittiin samanlaisia tuloksia Gleason-pistemäärän 8–10 eturauhassyövän osalta (1 % dutasteridi vs. 0,5 % lumelääke).
Kliinistä hyötyä ei ole osoitettu PROSCARilla hoidetuilla potilailla, joilla on eturauhassyöpä.
Rintasyöpä
4–6 vuotta kestäneen lumelääke- ja vertailulääkekontrolloidun MTOPS-tutkimuksen aikana, johon osallistui 3047 miestä, 4 rintasyöpätapausta todettiin finasteridilla hoidetuilla miehillä, mutta ei yhtään tapausta miehillä, joita ei hoidettu finasteridilla. Neljä vuotta kestäneen lumekontrolloidun PLESS-tutkimuksen aikana, johon osallistui 3040 miestä, lumelääkettä saaneilla miehillä todettiin 2 rintasyöpätapausta, mutta ei yhtään tapausta finasteridilla hoidetuilla miehillä. Seitsemän vuoden plasebokontrolloidussa eturauhassyövän ehkäisytutkimuksessa (PCPT), johon osallistui 18 882 miestä, todettiin yksi rintasyöpätapaus finasteridilla hoidetuilla miehillä ja yksi rintasyöpätapaus lumelääkettä saaneilla miehillä. Finasteridin pitkäaikaisen käytön ja miesten rintojen neoplasian välistä yhteyttä ei tällä hetkellä tunneta.
Seksuaalinen toiminta
Ei ole näyttöä seksuaalisten haittavaikutusten lisääntymisestä PROSCAR-hoidon keston pidentyessä. Uudet raportit huumeisiin liittyvistä seksuaalisista haitallisista kokemuksista vähenivät hoidon keston myötä.
Markkinoinnin jälkeinen kokemus
Seuraavia muita haittatapahtumia on raportoitu PROSCARin markkinoille tulon jälkeen. Koska nämä tapahtumat on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeille altistumiseen:
- yliherkkyysreaktiot, kuten kutina, urtikaria ja angioedeema (mukaan lukien huulten, kielen, kurkun ja kasvojen turvotus)
- kivesten kipu
- hematospermia
- seksuaalinen toimintahäiriö, joka jatkui hoidon lopettamisen jälkeen, mukaan lukien erektiohäiriöt, libidon heikkeneminen ja siemensyöksyhäiriöt (esim. vähentynyt siemensyöksytilavuus). Näitä tapahtumia raportoitiin harvoin miehillä, jotka käyttivät PROSCARia BPH:n hoitoon. Suurin osa miehistä oli vanhempia ja käytti samanaikaisesti lääkkeitä ja/tai heillä oli muita sairauksia. PROSCAR 5 mg:n riippumatonta roolia näissä tapahtumissa ei tunneta.
- miesten hedelmättömyyttä ja/tai huonoa siemenlaatua raportoitiin harvoin miehillä, jotka käyttivät PROSCAR 5 mg BPH:n hoitoon. Siementen huonon laadun normalisoitumista tai paranemista on raportoitu finasteridihoidon lopettamisen jälkeen. PROSCARin riippumatonta roolia näissä tapahtumissa ei tunneta.
- masennus
- miehen rintasyöpä.
Seuraavat seksuaaliseen toimintahäiriöön liittyvät lisähaittatapahtumat, jotka jatkuivat hoidon lopettamisen jälkeen, on raportoitu markkinoille tulon jälkeen, kun finasteridia on käytetty pienempinä annoksina miesten kaljuuntuman hoitoon. Koska tapahtuma on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei aina ole mahdollista luotettavasti arvioida sen esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeille altistumiseen:
- orgasmihäiriöt
HUUMEIDEN VUOROVAIKUTUKSET
Sytokromi P450:een kytketty lääkeaineenvaihduntaentsyymijärjestelmä
Kliinisesti merkittäviä lääkkeiden yhteisvaikutuksia ei ole tunnistettu. Finasteridi ei näytä vaikuttavan sytokromi P450:een liittyvään lääkettä metaboloivaan entsyymijärjestelmään. Ihmisillä testattuja yhdisteitä ovat olleet antipyriini, digoksiini, propranololi, teofylliini ja varfariini, eikä kliinisesti merkittäviä yhteisvaikutuksia havaittu.
Muu samanaikainen hoito
Vaikka erityisiä yhteisvaikutustutkimuksia ei ole tehty, PROSCAR 5 mg:aa käytettiin samanaikaisesti kliinisissä tutkimuksissa asetaminofeenin, asetyylisalisyylihapon, alfa-salpaajien, angiotensiinikonvertaasientsyymin (ACE) estäjien, kipulääkkeiden, kouristuslääkkeiden, beetasalpaajien, diureettien ja kalsiumin kanssa. kanavasalpaajat, sydämen nitraatit, HMG-CoA-reduktaasin estäjät, ei-steroidiset tulehduskipulääkkeet (NSAID), bentsodiatsepiinit, H2Â-antagonistit ja kinolonien tulehduskipulääkkeet ilman näyttöä kliinisesti merkittävistä haitallisista yhteisvaikutuksista.
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Vaikutukset eturauhasspesifiseen antigeeniin (PSA) ja PSA:n käyttöön eturauhassyövän havaitsemisessa
Kliinisissä tutkimuksissa PROSCAR alensi seerumin PSA-pitoisuutta noin 50 % kuuden kuukauden kuluessa hoidon aloittamisesta. Tämä lasku on ennustettavissa koko PSA-arvojen alueella potilailla, joilla on oireinen BPH, vaikka se voi vaihdella yksilöillä.
PROSCAR-hoitoa käyttävien miesten PSA:n sarja-arvojen tulkitsemiseksi uusi PSA-lähtötaso on määritettävä vähintään kuuden kuukauden kuluttua hoidon aloittamisesta ja PSA-arvoa on seurattava säännöllisesti sen jälkeen. Kaikki vahvistettu nousu alimmasta PSA-arvosta PROSCAR 5 mg:n käytön aikana voi olla merkki eturauhassyövän esiintymisestä, ja se on arvioitava, vaikka PSA-tasot olisivat edelleen normaalin alueen sisällä miehillä, jotka eivät käytä 5α-reduktaasin estäjää. PROSCAR-hoidon noudattamatta jättäminen voi myös vaikuttaa PSA-testin tuloksiin. Eristetyn PSA-arvon tulkitsemiseksi potilailla, joita on hoidettu PROSCAR 5 mg:lla vähintään kuuden kuukauden ajan, PSA-arvot tulee kaksinkertaistaa, jotta niitä voidaan verrata hoitamattomien miesten normaaleihin vaihteluväliin. Nämä säädöt säilyttävät PSA:n hyödyn eturauhassyövän havaitsemisessa PROSCAR-hoitoa saavilla miehillä.
PROSCAR voi myös aiheuttaa seerumin PSA:n laskua eturauhassyövän yhteydessä.
Vapaan PSA:n suhde kokonais-PSA:han (vapaan PSA:n prosenttiosuus) pysyy vakiona jopa PROSCARin vaikutuksen alaisena. Jos lääkärit päättävät käyttää vapaan PSA:n prosenttiosuutta apuna eturauhassyövän havaitsemisessa miehillä, jotka saavat finasteridihoitoa, sen arvon muuttaminen ei näytä tarpeelliselta.
Lisääntynyt korkea-asteen eturauhassyövän riski
55-vuotiailla ja sitä vanhemmilla miehillä, joilla oli normaali digitaalinen peräsuolen tutkimus ja PSA ≤3,0 ng/ml lähtötilanteessa ja jotka ottivat finasteridia 5 mg/vrk 7-vuotiaassa eturauhassyövän ehkäisytutkimuksessa (PCPT), Gleasonin eturauhassyövän riski oli 8-10. (finasteridi 1,8 % vs. lumelääke 1,1 %). [Katso INDIKAATIOT  ja  HAITTAVAIKUTUKSET .] Samanlaisia tuloksia havaittiin 4 vuotta kestäneessä lumekontrolloidussa kliinisessä tutkimuksessa toisella 5α-reduktaasin estäjän (dutasteridi, AVODART) kanssa (1 % dutasteridi vs. 0,5 % lumelääke). 5α-reduktaasin estäjät voivat lisätä korkea-asteisen eturauhassyövän riskiä. Ei ole osoitettu, vaikuttiko 5a-reduktaasin estäjien vaikutus eturauhasen tilavuutta vähentäviin tekijöihin tai tutkimukseen liittyviin tekijöihin näiden tutkimusten tuloksiin.
Naisten altistuminen
Riski miessikiölle
PROSCAR on vasta-aiheinen raskaana oleville naisille ja naisille, jotka voivat olla raskaana, eikä sitä ole tarkoitettu käytettäväksi naisilla. Eläinkokeiden ja vaikutusmekanismin perusteella PROSCAR 5 mg voi aiheuttaa poikkeavaa ulkoisten sukupuolielinten kehitystä miessikiössä, jos sitä annetaan raskaana olevalle naiselle. Raskaana olevat tai mahdollisesti raskaana olevat naiset eivät saa käsitellä murskattuja tai rikkoutuneita PROSCAR 5 mg tabletteja. PROSCAR 5 mg tabletit ovat päällystettyjä ja estävät kosketuksen vaikuttavan aineen kanssa normaalin käsittelyn aikana, mikäli tabletteja ei ole rikottu tai murskattu. Jos raskaana oleva nainen joutuu kosketuksiin murskattujen tai rikkoutuneiden PROSCAR 5 mg -tablettien kanssa, kosketusalue on pestävä välittömästi saippualla ja vedellä. [Katso VASTA-AIHEET , Käyttö tietyissä populaatioissa , KLIININEN FARMAKOLOGIA , ja  MITEN TOIMITETAAN .]
Lapsipotilaat ja naiset
PROSCAR ei ole tarkoitettu käytettäväksi lapsipotilailla [katso Käyttö tietyissä populaatioissa  ja  KLIININEN FARMAKOLOGIA ] tai naaraat [katso myös VAROITUKSET JA VAROTOIMET , Käyttö tietyissä populaatioissa , KLIININEN FARMAKOLOGIA , ja  MITEN TOIMITETAAN ].
Vaikutus siemennesteen ominaisuuksiin
PROSCAR-hoito 24 viikon ajan siemennesteen parametrien arvioimiseksi terveillä vapaaehtoisilla miehillä ei paljastanut kliinisesti merkittäviä vaikutuksia siittiöiden pitoisuuteen, liikkuvuuteen, morfologiaan tai pH:hon. Havaittiin 0,6 ml:n (22,1 %) keskimääräinen ejakulaatin tilavuuden väheneminen ja samanaikaisesti siittiöiden kokonaismäärän väheneminen siemensyöksyä kohti. Nämä parametrit pysyivät normaalialueella ja palautuivat hoidon lopettamisen jälkeen. Keskimääräinen aika palautua lähtötasolle oli 84 viikkoa.
Muiden urologisten sairauksien huomioon ottaminen
Ennen PROSCAR 5 mg -hoidon aloittamista on otettava huomioon muut urologiset sairaudet, jotka voivat aiheuttaa samanlaisia oireita. Lisäksi eturauhassyöpä ja BPH voivat esiintyä rinnakkain.
Potilaita, joilla on suuri jäännösvirtsamäärä ja/tai virtsan virtaus on voimakkaasti heikentynyt, on seurattava huolellisesti obstruktiivisen uropatian varalta. Nämä potilaat eivät välttämättä ole ehdokkaita finasteridihoitoon.
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( POTILASTIEDOT ).
Lisääntynyt korkea-asteen eturauhassyövän riski
Potilaille tulee kertoa, että korkea-asteinen eturauhassyöpä lisääntyi miehillä, joita hoidettiin BPH-hoitoon tarkoitetuilla 5α-reduktaasin estäjillä, mukaan lukien PROSCAR 5 mg, verrattuna lumelääkettä saaneisiin tutkimuksiin, joissa tarkasteltiin näiden lääkkeiden käyttöä eturauhasen ehkäisyssä. syöpä [katso INDIKAATIOT , VAROITUKSET JA VAROTOIMET , ja  HAITTAVAIKUTUKSET ].
Naisten altistuminen – riski miessikiölle
Lääkäreiden tulee kertoa potilaille, että raskaana olevat tai mahdollisesti raskaana olevat naiset eivät saa käsitellä murskattuja tai rikkoutuneita PROSCAR-tabletteja, koska finasteridi voi imeytyä ja aiheuttaa mahdollisia riskejä miessikiölle. PROSCAR-tabletit on päällystetty ja ne estävät kosketuksen vaikuttavan aineen kanssa normaalin käsittelyn aikana, mikäli tabletteja ei ole rikottu tai murskattu. Jos nainen, joka on raskaana tai voi olla raskaana, joutuu kosketuksiin murskattujen tai rikkoutuneiden PROSCAR-tablettien kanssa, kosketusalue on pestävä välittömästi saippualla ja vedellä [ks. VASTA-AIHEET , VAROITUKSET JA VAROTOIMET , Käyttö tietyissä populaatioissa  ja  MITEN TOIMITETAAN ].
Lisäohjeet
Lääkäreiden tulee kertoa potilaille, että ejakulaatin tilavuus saattaa pienentyä joillakin potilailla PROSCAR-hoidon aikana. Tämä lasku ei näytä häiritsevän normaalia seksuaalista toimintaa. Impotenssia ja heikentynyttä libidoa voi kuitenkin esiintyä PROSCAR-hoitoa saavilla potilailla [katso HAITTAVAIKUTUKSET ].
Lääkäreiden tulee neuvoa potilaitaan ilmoittamaan viipymättä kaikista rintojen muutoksista, kuten kyhmyistä, kivusta tai nännistä. Rintojen muutoksia, mukaan lukien rintojen suureneminen, arkuus ja kasvain, on raportoitu [ks HAITTAVAIKUTUKSET ].
Lääkäreiden tulee neuvoa potilaitaan lukemaan potilaspakkausseloste ennen PROSCAR 5 mg -hoidon aloittamista ja lukemaan se uudelleen aina, kun resepti uusitaan, jotta he ovat perillä potilaille ajankohtaisista PROSCAR-hoitoa koskevista tiedoista.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeneesi
Mitään todisteita kasvaimia aiheuttavasta vaikutuksesta ei havaittu 24 kuukauden tutkimuksessa Sprague-Dawley-rotilla, jotka saivat finasteridia enintään 160 mg/kg/vrk uroksilla ja 320 mg/kg/vrk naarailla. Nämä annokset aiheuttivat vastaavan systeemisen altistuksen rotilla 111 ja 274 kertaa verrattuna ihmisiin, jotka saivat ihmisille suositeltua 5 mg/vrk-annosta. Kaikki altistuslaskelmat perustuivat laskettuun AUC-arvoon (0-24 h) eläimillä ja keskimääräiseen AUC-arvoon (0-24 h) ihmisellä (0,4 μg•hr/ml).
19 kuukautta kestäneessä karsinogeenisuustutkimuksessa CD-1-hiirillä havaittiin tilastollisesti merkitsevä (p≤0,05) lisääntyminen kivesten Leydig-soluadenoomien ilmaantuvuudessa 228-kertaisella altistuksella ihmiselle (250 mg/kg/vrk). Leydig-solujen liikakasvun ilmaantuvuus lisääntyi hiirillä, kun altistus oli 23-kertainen ihmisen altistukseen verrattuna (25 mg/kg/vrk) ja rotilla 39-kertaisella altistuksella ihmiselle (40 mg/kg/vrk). Positiivinen korrelaatio Leydig-solujen proliferatiivisten muutosten ja seerumin LH-tasojen nousun välillä (2–3-kertainen kontrolliin verrattuna) on osoitettu molemmissa jyrsijälajeissa, joita on hoidettu suurilla annoksilla finasteridia. Lääkkeisiin liittyviä Leydig-solumuutoksia ei havaittu rotilla tai koirilla, joita hoidettiin finasteridilla 1 vuoden ajan 30 ja 350 kertaa (20 mg/kg/vrk ja 45 mg/kg/vrk, vastaavasti) eikä hiirillä, joita hoidettiin 19 kuukauden ajan 2,3 kertaa ihmisen altistuminen, arvioitu (2,5 mg/kg/vrk).
Mutageneesi
Mutageenisuutta ei havaittu in vitro -bakteerimutageneesimäärityksessä, nisäkässolujen mutageneesimäärityksessä tai in vitro -emäksisessä eluutiomäärityksessä. In vitro kromosomipoikkeavuusmäärityksessä, jossa käytettiin kiinanhamsterin munasarjasoluja, kromosomipoikkeamat lisääntyivät hieman. Nämä pitoisuudet vastaavat 4000-5000 kertaa plasman huippupitoisuuksia ihmisellä 5 mg:n kokonaisannoksella. In vivo -kromosomipoikkeavuusmäärityksessä hiirillä ei havaittu hoitoon liittyvää kromosomipoikkeavuuden lisääntymistä finasteridin suurimmalla siedetyllä annoksella 250 mg/kg/vrk (228 kertaa ihmisen altistus), joka määritettiin karsinogeenisuustutkimuksissa.
Hedelmällisyyden heikkeneminen
Sukukypsillä urospuolisilla kaneilla, joita hoidettiin finasteridilla 543-kertaisella altistuksella ihmiselle (80 mg/kg/vrk) enintään 12 viikon ajan, ei havaittu vaikutusta hedelmällisyyteen, siittiöiden määrään tai siemensyöksymäärään. Sukukypsillä urosrotilla, joita hoidettiin 61-kertaisella altistuksella ihmiselle (80 mg/kg/vrk), ei havaittu merkitseviä vaikutuksia hedelmällisyyteen 6 tai 12 viikon hoidon jälkeen. kuitenkin, kun hoitoa jatkettiin 24 tai 30 viikkoon asti, havaittiin ilmeistä hedelmällisyyden, hedelmällisyyden laskua ja siihen liittyvää merkittävää siemenrakkuloiden ja eturauhasen painon laskua. Kaikki nämä vaikutukset korjaantuivat 6 viikon kuluessa hoidon lopettamisesta. Rotilla tai kaniineilla ei ole havaittu lääkkeeseen liittyvää vaikutusta kiveksiin tai parittelukykyyn. Tämä finasteridilla käsiteltyjen rottien hedelmällisyyden heikkeneminen on toissijaista sen vaikutuksesta lisäsukupuolielimiin (eturauhaseen ja siemenrakkuloihin), mikä johtaa siementulpan muodostumisen epäonnistumiseen. Siementulppa on välttämätön rottien normaalille hedelmällisyydelle, eikä sillä ole merkitystä ihmisellä.
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
PROSCAR on vasta-aiheinen raskaana oleville naisille, eikä sitä ole tarkoitettu käytettäväksi naisilla. Eläinkokeiden ja vaikutusmekanismin perusteella PROSCAR 5mg voi aiheuttaa poikkeavaa ulkoisten sukupuolielinten kehitystä miessikiössä, jos sitä annetaan raskaana olevalle naiselle [ks. VAROITUKSET JA VAROTOIMET  ja  KLIININEN FARMAKOLOGIA ].
Rotilla tehdyssä alkion ja sikiön kehitystutkimuksessa havaittiin annoksesta riippuvaa hypospadioiden lisääntymistä, jota esiintyi 3,6–100 %:lla tiineenä olevien rottien urospuolisista jälkeläisistä, joille annettiin suun kautta finasteridia suuren organogeneesin aikana annoksina, jotka olivat noin 0,1–86 kertaa suurimmat. suositeltu ihmisannos (MRHD) 5 mg/vrk (perustuen AUC-arvoon eläinannoksilla 0,1-100 mg/kg/vrk).
Eturauhasen ja siemenrakkuloiden painon laskua, esinahkaan irtoamisen viivästymistä ja ohimenevää nännin kehittymistä havaittiin myös urospuolisilla jälkeläisillä, kun äidin suun kautta annettiin suun kautta annettavia annoksia, jotka olivat noin 0,03 kertaa MRHD:tä (perustuen AUC-arvoon eläinannoksella 0,03 mg/kg/vrk), sekä vähentynyt anogenitaalinen etäisyys. urospuolisilla jälkeläisillä äidin suun kautta annetuilla annoksilla, jotka olivat noin 0,003 kertaa MRHD (perustuen AUC-arvoon eläinannoksella 0,003 mg/kg/vrk).
PROSCAR on tyypin II 5α-reduktaasin estäjä, joka estää testosteronin muuttumisen 5α-dihydrotestosteroniksi (DHT), hormoniksi, joka on välttämätön miesten sukupuolielinten normaalille kehitykselle. Jos tätä lääkettä käytetään raskauden aikana tai jos potilas tulee raskaaksi tämän lääkkeen käytön aikana, potilasta on informoitava mahdollisesta vaarasta miessikiölle.
Miesten sukuelinten epänormaali kehitys on odotettu seuraus, kun 5a-reduktaasin estäjät estävät testosteronin muuttumisen 5α-dihydrotestosteroniksi (DHT). Nämä tulokset ovat samanlaisia kuin ne, jotka on raportoitu miespuolisilla imeväisikäisillä, joilla on geneettinen 5α-reduktaasin puutos. Naiset voivat altistua finasteridille joutuessaan kosketuksiin murskattujen tai rikkoutuneiden PROSCAR-tablettien tai PROSCARia käyttävän mieskumppanin siemennesteen kanssa. Mitä tulee finasteridialtistukseen ihon kautta, PROSCAR 5 mg tabletit on päällystetty ja ne estävät ihokosketuksen finasteridin kanssa normaalin käsittelyn aikana, jos tabletteja ei ole murskattu tai rikottu. Raskaana olevat tai mahdollisesti raskaana olevat naiset eivät saa käsitellä murskattuja tai rikkoutuneita PROSCAR 5 mg tabletteja, koska ne voivat altistua miespuoliselle sikiölle. Mitä tulee mahdolliseen finasteridialtistukseen siemennesteen kautta, on suoritettu kolme tutkimusta, joissa mitattiin finasteridipitoisuudet siemennesteessä miehillä, jotka saivat PROSCARia 5 mg/vrk. Näissä tutkimuksissa siemennesteen suurimman finasteridin määrän arvioitiin olevan 50-100 kertaa pienempi kuin finasteridin annos (5 μg), jolla ei ollut vaikutusta verenkierron DHT-tasoihin miehillä [ks. Data  ja  KLIININEN FARMAKOLOGIA ].
Data
Ihmistiedot
Kahdessa tutkimuksessa terveillä koehenkilöillä (n = 69), jotka saivat PROSCARia 5 mg/vrk 6-24 viikon ajan, finasteridipitoisuudet siemennesteessä vaihtelivat havaitsemattomista ( KLIININEN FARMAKOLOGIA ].
Eläinten tiedot
Alkion ja sikiön kehitystutkimuksessa raskaana olevat rotat saivat finasteridia suuren organogeneesin aikana (raskauspäivät 6-17). Äidillä suun kautta otettavalla finasteridiannoksella, joka oli noin 0,1–86 kertaa suurin suositeltu ihmisannos (MRHD) 5 mg/vrk (perustuen AUC-arvoon eläinannoksilla 0,1–100 mg/kg/vrk), hypospadiat lisääntyivät annoksesta riippuen. joita esiintyi 3,6-100 %:lla urospuolisista jälkeläisistä. Altistumiskertoimet arvioitiin käyttämällä tietoja ei-raskaana olevilta rotilta. Tiineyspäivät 16–17 ovat kriittistä aikaa urossikiörotilla ulkoisten sukuelinten erilaistumisen kannalta. Suun kautta annetuilla äidin annoksilla, jotka olivat noin 0,03 kertaa MRHD (perustuen AUC-arvoon eläinannoksella 0,03 mg/kg/vrk), urospuolisilla jälkeläisillä eturauhasen ja siemenrakkuloiden painot, esinahan irtoaminen viivästyivät ja nännin ohimenevä kehitys. Anogenitaalisen etäisyyden lyhenemistä esiintyi tiineinä rottien urospuolisilla jälkeläisillä, jotka saivat noin 0,003 kertaa MRHD:n (perustuen AUC-arvoon eläinannoksella 0,003 mg/kg/vrk). Naaraspuolisilla jälkeläisillä ei havaittu poikkeavuuksia millään äidin finasteridiannoksella.
Kehityspoikkeavuuksia ei havaittu sellaisten hoitamattomien naaraiden jälkeläisissä, jotka parittelivat finasteridilla hoidetuilla urosrotilla, jotka saivat noin 61-kertaisen MRHD:n (perustuen AUC-arvoon eläinannoksella 80 mg/kg/vrk). Urospuolisilla jälkeläisillä havaittiin hieman heikentynyttä hedelmällisyyttä sen jälkeen, kun naarasrotille annettiin noin 3-kertainen MRHD (AUC:n perusteella 3 mg/kg/vrk) naarasrotille myöhään tiineyden ja laktaation aikana. Näissä olosuhteissa naaraspuolisilla jälkeläisillä ei havaittu vaikutuksia hedelmällisyyteen.
Mitään todisteita urospuolisten ulkoisten sukupuolielinten epämuodostuksista tai muista poikkeavuuksista ei havaittu kanin sikiöillä, jotka altistettiin finasteridille suuren organogeneesin aikana (raskauspäivät 6-18) äidin suun kautta annetuilla annoksilla 100 mg/kg/vrk asti (finasteridialtistustasot eivät olleet mitattuna kaneista). Tämä tutkimus ei kuitenkaan ehkä sisältänyt kriittistä ajanjaksoa finasteridin vaikutuksille kaniinin urospuolisten ulkoisten sukupuolielinten kehitykseen.
Emon finasteridialtistuksen sikiövaikutuksia alkion ja sikiön kehityksen aikana arvioitiin reesusapinoilla (tiineyspäivät 20-100), lajilla ja kehitysjaksolla, joka ennakoi ihmisen spesifisiä vaikutuksia paremmin kuin rotilla ja kaniineilla tehdyt tutkimukset. Finasteridin suonensisäinen antaminen raskaana oleville apinoille jopa 800 ng/vrk annoksina (arvioitu maksimipitoisuus veressä 1,86 ng/ml eli noin 143 kertaa raskaana olevien naisten korkein arvioitu altistuminen finasteridille 5 mg/vrk ottaneiden miesten siemennesteestä) johti. ei poikkeavuuksia miessikiöissä. Vahvistaakseen reesusmallin merkityksen ihmisen sikiön kehitykselle suun kautta annos finasteridia (2 mg/kg/vrk tai noin 18 000 kertaa korkeimmat arvioidut finasteridipitoisuudet veressä 5 mg/vrk ottaneiden miesten siemennesteestä) raskaana olevat apinat johtivat ulkoisten sukuelinten poikkeavuuksiin urossikiöissä. Mitään muita poikkeavuuksia ei havaittu miessikiöillä eikä finasteridiin liittyviä poikkeavuuksia naisten sikiöillä millään annoksilla.
Imetys
Riskien yhteenveto
PROSCAR ei ole tarkoitettu käytettäväksi naisilla.
Naaraat ja urokset, joilla on lisääntymispotentiaali
Hedelmättömyys
Naaraat
PROSCAR ei ole tarkoitettu käytettäväksi naisilla.
Miehet
PROSCAR-hoito 24 viikon ajan siemennesteen parametrien arvioimiseksi terveillä vapaaehtoisilla miehillä ei paljastanut kliinisesti merkittäviä vaikutuksia siittiöiden pitoisuuteen, liikkuvuuteen, morfologiaan tai pH:hon. Havaittiin 0,6 ml:n (22,1 %) keskimääräinen ejakulaatin tilavuuden väheneminen ja samanaikaisesti siittiöiden kokonaismäärän väheneminen siemensyöksyä kohti. Nämä parametrit pysyivät normaalilla alueella ja palautuivat hoidon lopettamisen jälkeen, jolloin keskimääräinen aika palata lähtötasolle oli 84 viikkoa [ks. VAROITUKSET JA VAROTOIMET ].
Markkinoille tulon jälkeen on raportoitu miesten hedelmättömyydestä ja/tai huonosta siemennesteen laadusta; siemennesteen laadun normalisoitumista tai paranemista on raportoitu finasteridihoidon lopettamisen jälkeen [ks. HAITTAVAIKUTUKSET ].
Käyttö lapsille
PROSCAR 5 mg ei ole tarkoitettu käytettäväksi lapsipotilailla.
Turvallisuutta ja tehokkuutta lapsipotilailla ei ole osoitettu.
Geriatrinen käyttö
PLESS-tutkimukseen sisältyneiden koehenkilöiden kokonaismäärästä 1480 ja 105 henkilöä olivat 65-vuotiaita ja sitä vanhempia ja 75-vuotiaita ja sitä vanhempia. Näiden ja nuorempien koehenkilöiden välillä ei havaittu yleisiä eroja turvallisuudessa tai tehokkuudessa, ja muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa. Annoksen muuttaminen ei ole tarpeen vanhuksilla [katso KLIININEN FARMAKOLOGIA  ja  Kliiniset tutkimukset ].
Maksan vajaatoiminta
Varovaisuutta on noudatettava annettaessa PROSCARia potilaille, joilla on maksan toimintahäiriöitä, koska finasteridi metaboloituu laajalti maksassa [ks. KLIININEN FARMAKOLOGIA ].
Munuaisten vajaatoiminta
Annoksen muuttaminen ei ole tarpeen potilailla, joilla on munuaisten vajaatoiminta (ks KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
Potilaat ovat saaneet kerta-annoksia PROSCARia 5 mg enintään 400 mg ja useita annoksia PROSCAR 5 mg enintään 80 mg päivässä kolmen kuukauden ajan ilman haittavaikutuksia. Ennen kuin lisäkokemusta on saatu, PROSCAR-yliannostukseen ei voida suositella erityistä hoitoa.
Merkittävää kuolleisuutta havaittiin uros- ja naarashiirillä kerta-annoksilla 1500 mg/m2 (500 mg/kg) ja naaras- ja urosrotilla suun kautta annetuilla kerta-annoksilla 2360 mg/m2 (400 mg/kg) ja 5900 mg/m2. (1000 mg/kg), vastaavasti.
VASTA-AIHEET
PROSCAR on vasta-aiheinen seuraavissa tapauksissa:
- Yliherkkyys jollekin tämän lääkkeen komponentille.
- Raskaus. Finasteridin käyttö on vasta-aiheista naisille, jos he ovat tai voivat olla raskaana. Koska tyypin II 5α-reduktaasin estäjät pystyvät estämään testosteronin muuttumisen 5α-dihydrotestosteroniksi (DHT), finasteridi voi aiheuttaa poikkeavuuksia finasteridia saavan raskaana olevan naisen miessikiön ulkoisissa sukupuolielimissä. Jos tätä lääkettä käytetään raskauden aikana tai jos raskaus tapahtuu tämän lääkkeen käytön aikana, raskaana olevalle naiselle tulee olla tietoinen mahdollisesta vaarasta miessikiölle. [Katso myös VAROITUKSET JA VAROTOIMET , Käyttö tietyissä populaatioissa , ja  MITEN TOIMITETAAN .] Naarasrotilla raskauden aikana annetut pienet finasteridiannokset ovat aiheuttaneet poikkeavuuksia urospuolisten jälkeläisten ulkoisissa sukupuolielimissä.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Eturauhasen kehittyminen ja laajentuminen on riippuvainen voimakkaasta androgeenista, 5α-dihydrotestosteronista (DHT). Tyypin II 5α-reduktaasi metaboloi testosteronin DHT:ksi eturauhasessa, maksassa ja ihossa. DHT indusoi androgeenisiä vaikutuksia sitoutumalla androgeenireseptoreihin näiden elinten soluytimissä.
Finasteridi on kilpaileva ja spesifinen tyypin II 5α-reduktaasin estäjä, jonka kanssa se muodostaa hitaasti vakaan entsyymikompleksin. Tämän kokonaisuuden liikevaihto on erittäin hidasta (t½ ¼ ¼ 30 päivää). Tämä on osoitettu sekä in vivo että in vitro. Finasteridilla ei ole affiniteettia androgeenireseptoriin. Ihmisellä 5α-pelkistettyjen steroidimetaboliittien määrä veressä ja virtsassa vähenee finasteridin annon jälkeen.
Farmakodynamiikka
Ihmisellä yksi 5 mg:n PROSCAR-annos suun kautta alentaa seerumin DHT-pitoisuutta nopeasti, ja suurin vaikutus havaitaan 8 tuntia ensimmäisen annoksen jälkeen. DHT-suppressio säilyy koko 24 tunnin annosteluvälin ajan ja hoidon jatkuessa. Päivittäisen PROSCAR-annoksen 5 mg/vrk enintään 4 vuoden ajan on osoitettu vähentävän seerumin DHT-pitoisuutta noin 70 %. Veren testosteronin mediaanitaso nousi noin 10-20 %, mutta pysyi fysiologisella alueella. Erillisessä tutkimuksessa terveillä miehillä, joita hoidettiin finasteridilla 1 mg päivässä (n=82) tai lumelääkettä (n=69), keskimääräiset verenkierrossa olevat testosteronin ja estradiolin tasot nousivat noin 15 % lähtötasoon verrattuna, mutta ne pysyivät fysiologinen alue.
Potilailla, jotka saivat PROSCARia 5 mg/vrk, luteinisoivan hormonin (LH) ja follikkelia stimuloivan hormonin (FSH) pitoisuudet nousivat noin 10 %, mutta tasot pysyivät normaaleissa rajoissa. Terveillä vapaaehtoisilla PROSCAR 5 mg -hoito ei muuttanut LH:n ja FSH:n vastetta gonadotropiinia vapauttavalle hormonille, mikä osoitti, että hypotalamus-aivolisäke-kives-akselilla ei ollut vaikutusta.
BPH-potilailla PROSCAR ei vaikuta verenkierrossa oleviin kortisolin, prolaktiinin, kilpirauhasta stimuloivan hormonin tai tyroksiinin tasoihin. Kliinisesti merkittävää vaikutusta plasman lipidiprofiiliin (eli kokonaiskolesteroliin, matalatiheyksisiin lipoproteiiniin, korkeatiheyksisiin lipoproteiiniin ja triglyserideihin) tai luun mineraalitiheyteen ei havaittu.
Aikuisilla miehillä, joilla on geneettisesti perinnöllinen tyypin II 5α-reduktaasin puutos, on myös alentunut DHT-taso. Näillä henkilöillä ei ole havaittu muita tyypin II 5α-reduktaasin puutteeseen liittyviä kliinisiä poikkeavuuksia lukuun ottamatta syntymässä esiintyviä urogenitaalisia vaurioita. Näillä henkilöillä on pieni eturauhanen koko elämänsä ajan, eivätkä he kehitä BPH:ta.
BPH-potilailla, joita hoidettiin finasteridilla (1-100 mg/vrk) 7-10 päivää ennen eturauhasen poistoa, mitattiin noin 80 % pienempi DHT-pitoisuus leikkauksessa poistetusta eturauhaskudoksesta verrattuna lumelääkkeeseen. Testosteronikudoksen pitoisuus nousi jopa 10-kertaiseksi hoitoa edeltävään tasoon verrattuna lumelääkkeeseen. Myös intraprostaattinen PSA-pitoisuus pieneni.
Terveillä vapaaehtoisilla miehillä, joita hoidettiin PROSCAR 5 mg:lla 14 päivän ajan, hoidon lopettaminen johti DHT-tasojen palautumiseen hoitoa edeltäneelle tasolle noin 2 viikossa. Kolmen kuukauden ajan hoidetuilla potilailla eturauhasen tilavuus, joka pieneni noin 20 %, palasi lähelle lähtötasoa noin kolmen kuukauden hoidon lopettamisen jälkeen.
Farmakokinetiikka
Imeytyminen
Tutkimuksessa, johon osallistui 15 tervettä nuorta henkilöä, 5 mg:n finasteriditablettien keskimääräinen biologinen hyötyosuus oli 63 % (vaihteluväli 34-108 %) perustuen käyrän alla olevan pinta-alan (AUC) suhteeseen suonensisäiseen (IV) vertailuannokseen. . Finasteridin maksimipitoisuus plasmassa oli keskimäärin 37 ng/ml (vaihteluväli 27-49 ng/ml), ja se saavutettiin 1-2 tuntia annoksen ottamisen jälkeen. Ruoka ei vaikuttanut finasteridin biologiseen hyötyosuuteen.
Jakelu
Keskimääräinen vakaan tilan jakautumistilavuus oli 76 litraa (vaihteluväli 44-96 litraa). Noin 90 % verenkierrossa olevasta finasteridista sitoutuu plasman proteiineihin. Finasteridilla on hidas kertymisvaihe toistuvan annostelun jälkeen. Kun finasteridia annettiin 5 mg/vrk 17 päivän ajan, plasman finasteridipitoisuudet olivat 47 ja 54 % korkeammat kuin ensimmäisen annoksen jälkeen 45–60-vuotiailla (n=12) ja ≥70-vuotiailla (n=12) miehillä. , vastaavasti. Keskimääräiset minimipitoisuudet 17 päivän annostelun jälkeen olivat 6,2 ng/ml (vaihteluväli 2,49,8 ng/ml) ja 8,1 ng/ml (vaihteluväli 1,8-19,7 ng/ml) kahdessa ikäryhmässä. Vaikka vakaata tilaa ei saavutettu tässä tutkimuksessa, keskimääräinen alin plasmapitoisuus toisessa tutkimuksessa BPH-potilailla (keski-ikä, 65 vuotta), jotka saivat 5 mg/vrk, oli 9,4 ng/ml (vaihteluväli 7,1-13,3 ng/ml; n= 22) yli vuoden annostelun jälkeen.
Finasteridin on osoitettu läpäisevän veri-aivoesteen, mutta se ei näytä jakautuvan ensisijaisesti aivo-selkäydinnesteeseen.
Kahdessa tutkimuksessa terveillä koehenkilöillä (n = 69), jotka saivat PROSCARia 5 mg/vrk 6-24 viikon ajan, finasteridipitoisuudet siemennesteessä vaihtelivat havaitsemattomista ( Käyttö tietyissä populaatioissa ].
Aineenvaihdunta
Finasteridi metaboloituu laajalti maksassa, pääasiassa sytokromi P450 3A4 -entsyymialaperheen kautta. Kaksi metaboliittia, t-butyylisivuketjun monohydroksyloitunut ja monokarboksyylihappometaboliitit, on tunnistettu, joilla on enintään 20 % finasteridin 5α-reduktaasia estävästä vaikutuksesta.
Erittyminen
Terveillä nuorilla koehenkilöillä (n=15) finasteridin keskimääräinen plasmapuhdistuma oli 165 ml/min (vaihteluväli 70 279 ml/min) ja keskimääräinen eliminaation puoliintumisaika plasmassa oli 6 tuntia (vaihteluväli 3-16 tuntia). Suun kautta annetun 14C-finasteridiannoksen jälkeen ihmisellä (n=6) keskimäärin 39 % (vaihteluväli 32-46 %) annoksesta erittyi virtsaan metaboliittien muodossa; 57 % (vaihteluväli 51-64 %) erittyi ulosteeseen.
Finasteridin keskimääräinen terminaalinen puoliintumisaika ≥70-vuotiailla koehenkilöillä oli noin 8 tuntia (vaihteluväli 6-15 tuntia; n=12) verrattuna 6 tuntiin (vaihteluväli 4-12 tuntia; n=12). 45-60 vuoden iässä. Tämän seurauksena keskimääräinen AUC(0-24 h) 17 päivän annostelun jälkeen oli 15 % korkeampi ≥70-vuotiailla kuin 45-60-vuotiailla (p=0,02).
Pediatriset
Finasteridin farmakokinetiikkaa ei ole tutkittu alle 18-vuotiailla potilailla.
Finasteridia ei ole tarkoitettu käytettäväksi lapsipotilailla [katso VAROITUKSET JA VAROTOIMET , Käyttö tietyissä populaatioissa ].
Sukupuoli
Finasteridi ei ole tarkoitettu käytettäväksi naisilla [katso VASTA-AIHEET , VAROITUKSET JA VAROTOIMET , Käyttö tietyissä populaatioissa , ja  MITEN TOIMITETAAN ].
Geriatric
Annosta ei tarvitse muuttaa vanhuksilla. Vaikka finasteridin eliminaationopeus on hidastunut vanhuksilla, näillä löydöksillä ei ole kliinistä merkitystä. [Katso Farmakokinetiikka  ja  Käyttö tietyissä populaatioissa .]
Rotu
Rodun vaikutusta finasteridin farmakokinetiikkaan ei ole tutkittu.
Maksan vajaatoiminta
Maksan vajaatoiminnan vaikutusta finasteridin farmakokinetiikkaan ei ole tutkittu. Varovaisuutta tulee noudattaa annettaessa PROSCAR 5 mg potilaille, joilla on maksan toimintahäiriöitä, koska finasteridi metaboloituu laajalti maksassa. Munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa potilailla, joilla on munuaisten vajaatoiminta. Kroonista munuaisten vajaatoimintaa sairastavilla potilailla, joiden kreatiniinipuhdistumat vaihtelivat välillä 9,0-55 ml/min, AUC, maksimipitoisuus plasmassa, puoliintumisaika ja sitoutuminen proteiineihin olivat samanlaiset kuin terveillä vapaaehtoisilla saadut arvot. Metaboliittien erittyminen virtsaan väheni potilailla, joilla oli munuaisten vajaatoiminta. Tämä väheneminen liittyi metaboliittien ulosteen erittymisen lisääntymiseen. Plasman metaboliittien pitoisuudet olivat merkittävästi korkeammat munuaisten vajaatoimintaa sairastavilla potilailla (perustuu 60 %:n nousuun kokonaisradioaktiivisuuden AUC:ssa). Finasteridi on kuitenkin ollut hyvin siedetty BPH-potilailla, joilla on normaali munuaisten toiminta ja jotka ovat saaneet enintään 80 mg/vrk 12 viikon ajan, jolloin näiden potilaiden altistuminen metaboliiteille olisi oletettavasti paljon suurempi.
Kliiniset tutkimukset
Monoterapia
PROSCAR 5 mg/vrk arvioitiin alun perin potilailla, joilla oli BPH-oireita ja suurentunut eturauhanen digitaalisella peräsuolen tutkimuksella kahdessa yhden vuoden lumekontrolloidussa, satunnaistetussa kaksoissokkotutkimuksessa ja niiden 5 vuoden avoimessa jatkotutkimuksessa.
PROSCAR 5 mg arvioitiin edelleen PROSCAR Long-Term Efficacy and Safety Study (PLESS) -tutkimuksessa, joka on kaksoissokkoutettu, satunnaistettu, lumekontrolloitu, 4 vuotta kestänyt monikeskustutkimus. Tutkimukseen satunnaistettiin 3040 iältään 45–78-vuotiasta potilasta, joilla oli kohtalaisia tai vaikeita BPH-oireita ja suurentunut eturauhanen digitaalisessa peräsuolen tutkimuksessa (1524 finasteridiin, 1516 lumelääkkeeseen), ja 3016 potilasta arvioitiin tehon suhteen. 1883 potilasta suoritti 4 vuoden tutkimuksen (1000 finasteridiryhmässä, 883 lumeryhmässä).
Vaikutus oirepisteisiin
Oireet kvantifioitiin käyttämällä American Urological Associationin oirepistemäärää, joka arvioi sekä obstruktiivisia oireita (virran koon ja voiman heikkeneminen, epätäydellisen virtsarakon tyhjenemisen tunne, viivästynyt tai keskeytynyt virtsaaminen) että ärsytysoireita (nokturia, tiheys päiväsaikaan, tarve). virtsan virtauksen rasittaminen tai työntäminen) arvioimalla asteikolla 0-5 kuudelle oireelle ja asteikolla 0-4 yhdelle oireelle, jolloin mahdollinen kokonaispistemäärä on 34.
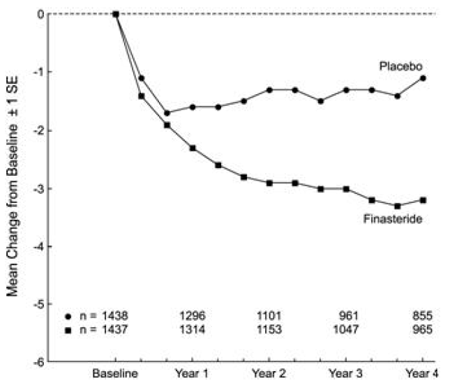
PLESS-potilailla oli alkuvaiheessa kohtalaisia tai vaikeita oireita (keskiarvo noin 15 pistettä 0-34 pisteen asteikolla). Proscariin satunnaistetuilla potilailla, jotka saivat hoitoa 4 vuotta, oirepistemäärä laski keskimäärin (± 1 SD) 3,3 (± 5,8) pisteellä verrattuna 1,3 (± 5,6) pisteeseen lumeryhmässä. (Katso kuva 1.) Tilastollisesti merkitsevä paraneminen oirepisteissä havaittiin vuoden kuluttua PROSCAR-hoitoa saaneilla potilailla verrattuna lumelääkkeeseen (-2,3 vs. 1,6), ja tämä paraneminen jatkui vuoden 4 ajan.
Kuva 1 Oirepisteet PLESS:ssä
Aiemmissa tutkimuksissa nähdyt tulokset olivat verrattavissa PLESS-tutkimuksen tuloksiin. Vaikka joillakin potilailla virtsatieoireet paranivat varhaisessa vaiheessa, vähintään 6 kuukauden terapeuttinen tutkimus oli yleensä tarpeen sen arvioimiseksi, oliko oireiden lievityksessä saavutettu hyödyllinen vaste. BPH-oireiden paraneminen havaittiin ensimmäisen vuoden aikana ja säilyi avoimissa jatkotutkimuksissa 5 vuoden ajan.
Vaikutus akuuttiin virtsan kertymiseen ja leikkauksen tarpeeseen
PLESS-tutkimuksessa tehoa arvioitiin myös arvioimalla hoidon epäonnistumisia. Hoidon epäonnistuminen määriteltiin prospektiivisesti BPH:hen liittyvinä urologisina tapahtumina tai kliinisen tilanteen heikkenemisenä, parantumisen puutteena ja/tai vaihtoehtoisen hoidon tarpeena. BPH:hen liittyvät urologiset tapahtumat määriteltiin urologiseksi kirurgiseksi toimenpiteeksi ja katetrointia vaativiksi akuutiksi virtsanpidätykseksi. Täydelliset tapahtumatiedot olivat saatavilla 92 %:lla potilaista. Seuraavassa taulukossa (taulukko 5) on yhteenveto tuloksista.
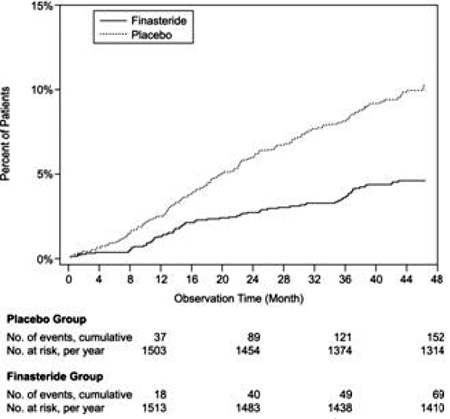
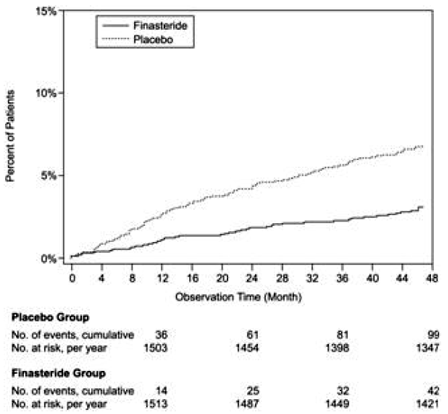
Plaseboon verrattuna PROSCAR liittyi merkittävästi pienempään akuutin virtsan pidättymisen riskiin tai BPH:hen liittyvän leikkauksen tarpeeseen [13,2 % lumelääkeryhmässä vs. 6,6 % PROSCAR-ryhmässä; 51 % riskin lasku, 95 % CI: (34 - 63 %)]. Verrattuna lumelääkkeeseen PROSCAR 5 mg:n annokseen liittyi merkittävästi pienempi leikkausriski [10,1 % lumelääkettä saaneilla vs 4,6 % PROSCARilla; 55 %:n riskin pieneneminen, 95 %:n luottamusväli: (37-68 %)] ja merkittävästi pienempi akuutin virtsan pidättymisen riski [6,6 % lumelääkettä saaneilla vs 2,8 % PROSCAR-ryhmällä; 57 % riskin lasku, 95 % CI: (34 - 72 %)]; katso kuvat 2 ja 3.
Kuva 2 Prosenttiosuus potilaista, joille on leikattu BPH, mukaan lukien TURP
Kuva 3 Prosenttiosuus potilaista, joille kehittyy akuutti virtsanpidätys (spontaani ja saostunut)
Vaikutus maksimivirtsan virtausnopeuteen
PLESS-potilailla, jotka olivat saaneet hoitoa tutkimuksen ajan ja joilla oli arvioitavissa olevat virtsan virtaustiedot, PROSCAR 5 mg lisäsi maksimivirtsan virtausnopeutta 1,9 ml/s verrattuna plaseboryhmän 0,2 ml/s.
Hoitoryhmien välillä oli selvä ero virtsan maksimivirtausnopeudessa PROSCAR 5 mg:n hyväksi neljänteen kuukauteen mennessä (1,0 vs 0,3 ml/s), joka säilyi koko tutkimuksen ajan. Aikaisemmissa 1 vuoden tutkimuksissa maksimivirtsan virtausnopeuden nousu oli verrattavissa PLESS:ään, ja se säilyi ensimmäisen vuoden ajan ja koko 5 vuoden ajan avoimissa jatkotutkimuksissa.
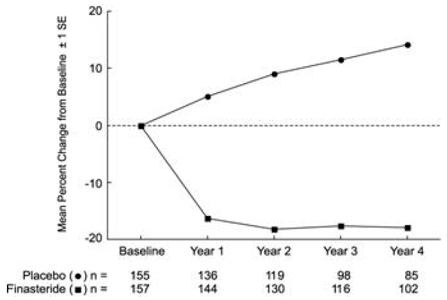
Vaikutus eturauhasen volyymiin
PLESS-tutkimuksessa eturauhasen tilavuus arvioitiin vuosittain magneettikuvauksella (MRI) potilaiden alaryhmässä. Proscar 5 mg:lla hoidetuilla potilailla, jotka jatkoivat hoitoa, eturauhasen tilavuus pieneni sekä lähtötasoon että lumelääkkeeseen verrattuna koko 4-vuotisen tutkimuksen ajan. PROSCAR vähensi eturauhasen tilavuutta 17,9 % (55,9 cc:stä lähtötilanteessa 45,8 cc:iin 4 vuoden kohdalla) verrattuna 14,1 %:n kasvuun (51,3 cc:stä 58,5 cc:iin) lumeryhmässä (p
Aiemmissa tutkimuksissa nähdyt tulokset olivat verrattavissa PLESS-tutkimuksen tuloksiin. Keskimääräinen eturauhasen tilavuus oli lähtötilanteessa 40-50 cm3. Eturauhasen tilavuuden väheneminen havaittiin ensimmäisen vuoden aikana, ja se säilyi viiden lisävuoden ajan avoimissa jatkotutkimuksissa.
Kuva 4 Eturauhasen tilavuus PLESSissä
Eturauhasen volyymi terapeuttisen vasteen ennustajana
Meta-analyysi, jossa yhdistettiin 1 vuoden tiedot seitsemästä kaksoissokkoutetusta lumekontrolloidusta tutkimuksesta, joissa oli samankaltainen rakenne, mukaan lukien 4491 oireista BPH-potilasta, osoitti, että PROSCAR-hoitoa saaneiden potilaiden oirevasteen suuruus ja paranemisaste maksimiarvossa virtsan virtausnopeus oli suurempi potilailla, joilla oli suurentunut eturauhanen lähtötilanteessa.
Yhdistelmä alfasalpaajahoidon kanssa
Eturauhasen oireiden lääketieteellinen hoito (MTOPS) oli kaksoissokkoutettu, satunnaistettu, lumekontrolloitu, monikeskustutkimus, joka kesti 4–6 vuotta (keskimäärin 5 vuotta) 3047 miehellä, joilla oli oireinen BPH ja jotka satunnaistettiin saamaan PROSCAR 5:tä. mg/vrk (n=768), doksatsosiini 4 tai 8 mg/vrk (n=756), PROSCARin 5 mg/vrk ja doksatsosiinin yhdistelmä 4 tai 8 mg/vrk (n=786) tai lumelääke (n=737) ). Kaikille osallistujille doksatsosiinia (tai sen lumelääkettä) titrattiin viikoittain 1 - 2 - 4 - 8 mg/vrk. Vain 4 tai 8 mg:n annostason sietäneet saivat doksatsosiinia (tai sen lumelääkettä) tutkimuksessa. Osallistujan lopullinen siedetty annos (joko 4 mg tai 8 mg) annettiin viikon 4 lopusta alkaen. Lopullinen doksatsosiiniannos annettiin kerran päivässä nukkumaan mennessä.
Potilaan keski-ikä satunnaistettaessa oli 62,6 vuotta (±7,3 vuotta). Potilaat olivat valkoihoisia (82 %), afroamerikkalaisia (9 %), latinalaisamerikkalaisia (7 %), aasialaisia (1 %) tai intialaisia (
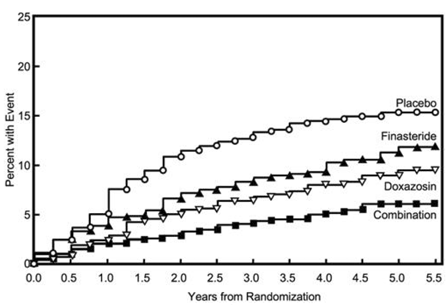
Ensisijainen päätetapahtuma oli minkä tahansa seuraavan viiden tuloksen ensimmäisen esiintymisen yhdistelmämitta: ≥4 pisteen vahvistettu nousu oirepisteiden lähtötasosta, akuutti virtsanpidätys, BPH:hen liittyvä munuaisten vajaatoiminta (kreatiniinin nousu), toistuvat virtsatieinfektiot tai urosepsis tai inkontinenssi. Plaseboon verrattuna hoito PROSCAR 5 mg:lla, doksatsosiinilla tai yhdistelmähoidolla pienensi riskiä kokea jokin näistä viidestä lopputapahtumasta 34 % (p=0,002), 39 % (p
Suurin osa tapahtumista (274/351; 78 %) oli vahvistettu ≥ 4 pisteen nousu oirepisteissä, jota kutsutaan oirepisteiden etenemiseksi. Oirepisteiden etenemisen riski pieneni 30 % (p=0,016), 46 % (p
Kuva 5 AUA:n oirepisteiden 4 pisteen nousun kumulatiivinen ilmaantuvuus hoitoryhmittäin
Hoito PROSCAR 5 mg:lla, doksatsosiinilla tai PROSCAR:n ja doksatsosiinin yhdistelmällä alensi oireiden keskimääräistä pistemäärää lähtötasosta vuonna 4. Taulukossa 7 esitetään keskimääräinen muutos lähtötasosta AUA-oireiden pisteytykseen hoitoryhmittäin potilailla, jotka olivat saaneet hoitoa neljä vuotta.
MTOPS-tulokset ovat yhdenmukaisia 4-vuotisen lumekontrolloidun PLESS-tutkimuksen tulosten kanssa [ks. Monoterapia ], koska PROSCAR-hoito vähentää akuutin virtsan pidättymisen riskiä ja BPH:hen liittyvän leikkauksen tarvetta. MTOPS-tutkimuksessa akuutin virtsan kertymisen riski pieneni 67 % PROSCAR-hoitoa saaneilla potilailla verrattuna lumelääkettä saaneisiin potilaisiin (0,8 % PROSCAR ja 2,4 % lumelääke). Lisäksi riski BPH:hen liittyvän invasiivisen hoidon vaatimisesta pieneni 64 % PROSCAR-hoitoa saaneilla potilailla verrattuna lumelääkettä saaneisiin potilaisiin (2,0 % PROSCAR 5 mg:n ja 5,4 % lumelääkettä saaneilla potilailla).
Yhteenveto kliinisistä tutkimuksista
Näistä tutkimuksista saadut tiedot, jotka osoittavat BPH-oireiden paranemisen, hoidon epäonnistumisen vähenemisen (BPH:hen liittyvät urologiset tapahtumat), lisääntyneen virtsan maksimimäärän ja eturauhasen tilavuuden pienenemisen, viittaavat siihen, että PROSCAR pysäyttää BPH-tautiprosessin miehillä, joilla on laajentunut eturauhanen.
POTILASTIEDOT
Tietoja ei ole annettu. Katso VAROITUKSET JA VAROTOIMET osio.
