Propecia 1mg, 5mg Finasteride Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mikä Propecia 1mg on ja miten sitä käytetään?
Propecia on reseptilääke, jota käytetään hyvänlaatuisen eturauhasen liikakasvun (BPH), miesten hiustenlähtöön (androgeeninen hiustenlähtö) oireiden hoitoon. Propeciaa voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Propecia 1mg kuuluu lääkeluokkaan, jota kutsutaan 5-alfa-reduktaasin estäjiksi.
Ei tiedetä, onko Propecia 1mg turvallinen ja tehokas lapsille.
Mitkä ovat Propecia 5mg:n mahdolliset sivuvaikutukset?
Propecia 1mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- rintojen kyhmyt,
- rintojen kipu tai arkuus,
- nännivuoto, ja
- muut rintojen muutokset
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Propecia 5mg:n yleisimmät sivuvaikutukset ovat:
- kiinnostuksen menetys seksiin,
- impotenssi,
- vaikeuksia saada orgasmi ja
- epänormaali siemensyöksy
Kerro lääkärillesi, jos sinulla on jokin haittavaikutus, joka häiritsee sinua tai joka ei häviä.
Nämä eivät ole kaikkia Propecian mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
PROPECIA (finasteridi) -tabletit sisältävät vaikuttavana aineena finasteridia. Finasteridi, synteettinen 4-atsasteroidiyhdiste, on spesifinen steroidityypin II 5α-reduktaasin estäjä, solunsisäinen entsyymi, joka muuttaa androgeenitestosteronin 5α-dihydrotestosteroniksi (DHT).
Finasteridin kemiallinen nimi on N-tert-butyyli-3-okso-4-atsa-5a-androst-1-eeni-17p-karboksamidi. Finasteridin empiirinen kaava on C23H36N2O2 ja sen molekyylipaino on 372,55. Sen rakennekaava on:
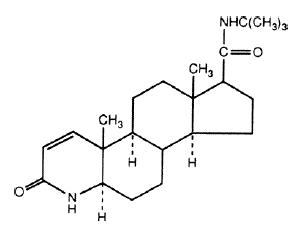
Finasteridi on valkoinen kiteinen jauhe, jonka sulamispiste on lähellä 250 °C. Se liukenee vapaasti kloroformiin ja alempien alkoholien liuottimiin, mutta on käytännössä liukenematon veteen.
PROPECIA (finasteridi) -tabletit ovat kalvopäällysteisiä tabletteja suun kautta annettavaksi. Yksi tabletti sisältää 1 mg finasteridia ja seuraavia inaktiivisia aineita: laktoosimonohydraatti, mikrokiteinen selluloosa, esigelatinoitu tärkkelys, natriumtärkkelysglykolaatti, hydroksipropyylimetyyliselluloosa, hydroksipropyyliselluloosa, titaanidioksidi, magnesiumstearaatti, talkki, keltainen rautahappo ja natriumdokusaatti. oksidi.
INDIKAATIOT
PROPECIA® on tarkoitettu miesten hiustenlähtöön (androgeneettinen hiustenlähtö) VAIN MIESTEN.
Tehoa bitemporaalisen laman hoidossa ei ole osoitettu.
PROPECIAa ei ole tarkoitettu käytettäväksi naisilla.
ANNOSTELU JA HALLINNOINTI
PROPECIA voidaan antaa aterian yhteydessä tai ilman.
Suositeltu PROPECIA-annos on yksi tabletti (1 mg) kerran vuorokaudessa.
Yleensä vähintään kolmen kuukauden päivittäinen käyttö on välttämätöntä, ennen kuin hyödyt havaitaan. Jatkuvaa käyttöä suositellaan hyödyn säilyttämiseksi, mikä tulee arvioida uudelleen säännöllisesti. Hoidon keskeyttäminen johtaa vaikutuksen kääntymiseen 12 kuukauden kuluessa.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
PROPECIA 5 mg tabletit (1 mg) ovat kullanruskeita, kahdeksankulmaisia, kalvopäällysteisiä kuperia tabletteja, joiden toisella puolella on tyylitelty P-logo ja toisella puolella PROPECIA 5 mg.
PROPECIA 1 mg tabletit ovat kullanruskeita, kahdeksankulmaisia, kalvopäällysteisiä kuperia tabletteja, joiden toisella puolella on "tyylitelty P"-logo ja toisella puolella PROPECIA. Ne toimitetaan seuraavasti:
NDC 78206-152-01 30 pulloa (kuivausaineella) NDC 78206-152-02 PROPAK-pullot 90 ® (kuivausaineella).
Varastointi ja käsittely
Säilytä huoneenlämmössä, 15-30°C (59-86°F). Pidä säiliö suljettuna ja suojaa kosteudelta.
Naiset eivät saa käsitellä murskattuja tai rikkoutuneita PROPECIA-tabletteja ollessaan raskaana tai mahdollisesti raskaana, koska finasteridi voi imeytyä ja aiheuttaa mahdollisen riskin miessikiölle. PROPECIA 5 mg tabletit on päällystetty ja ne estävät kosketuksen vaikuttavan aineen kanssa normaalin käsittelyn aikana edellyttäen, että tabletit eivät ole rikki tai murskattu [ks. VAROITUKSET JA VAROTOIMET , Käyttö tietyissä populaatioissa ja Potilasneuvontatiedot ].
Piir. kirjoittaja: Organon LLC, ORGANON & Co.:n tytäryhtiö, Jersey City, NJ 07302, USA. Tarkistettu: kesäkuuta 2021
SIVUVAIKUTUKSET
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida verrata suoraan toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta kliinisissä käytännöissä havaittuja nopeuksia.
Kliiniset tutkimukset PROPECIAlle (finasteridi 1 mg) miesten hiustenlähdön hoidossa
Kolmessa kontrolloidussa 12 kuukauden PROPECIA 5 mg:n kliinisessä tutkimuksessa 1,4 % PROPECIAa saaneista potilaista (n=945) keskeytettiin haittavaikutusten vuoksi, joiden katsottiin liittyvän mahdollisesti, todennäköisesti tai varmasti lääkkeeseen (1,6 % lumelääkkeestä; n = 934).
Taulukossa 1 on esitetty kliiniset haittavaikutukset, jotka ilmoitettiin mahdollisesti, todennäköisesti tai varmasti lääkkeisiin liittyviksi ≥ 1 %:lla PROPECIA- tai lumelääkehoitoa saaneista potilaista.
TAULUKKO 1: Lääkkeisiin liittyvät haitalliset kokemukset PROPECIAsta (finasteridi 1 mg) vuonna 1 (%) MIESKUVIOLINEN HIUSTEN LOITTO
Kliinisten haittavaikutusten integroitu analyysi osoitti, että PROPECIA-hoidon aikana 1 mg:lla 36 (3,8 %) miehestä 945:stä oli ilmoittanut yhden tai useamman näistä haittavaikutuksista verrattuna 20:een (2,1 %) lumelääkettä saaneesta 934 miehestä (p = 0,04). . Ratkaisu tapahtui miehillä, jotka lopettivat PROPECIA-hoidon näiden sivuvaikutusten vuoksi, ja useimmilla hoitoa jatkaneilla. Jokaisen yllä mainitun haittavaikutuksen ilmaantuvuus laski ≤ 0,3 %:iin viidentenä PROPECIA-hoidon vuotena mennessä.
Terveillä miehillä tehdyssä tutkimuksessa, jossa finasteridia annettiin 1 mg päivässä, ejakulaatin tilavuuden mediaani pieneni 0,3 ml:lla (-11 %) verrattuna lumelääkkeen 0,2 ml:aan (-8 %) 48 viikon hoidon jälkeen. Kaksi muuta tutkimusta osoittivat, että finasteridi 5-kertaisella PROPECIA-annoksella (5 mg vuorokaudessa) sai aikaan merkittävän, noin 0,5 ml:n (-25 %) keskimääräisen pienenemisen ejakulaatin tilavuudessa lumelääkkeeseen verrattuna, mutta tämä korjaantui hoidon lopettamisen jälkeen.
PROPECIA-valmisteella tehdyissä kliinisissä tutkimuksissa rintojen arkuuden ja suurenemisen, yliherkkyysreaktioiden ja kivesten kivun ilmaantuvuus finasteridihoitoa saaneilla potilailla ei eronnut lumelääkettä saaneista potilaista.
Kontrolloidut kliiniset tutkimukset ja pitkäaikaiset avoimet jatkotutkimukset PROSCAR®:lle (finasteridi 5 mg) ja AVODARTille (dutasteridi) eturauhasen hyvänlaatuisen liikakasvun hoidossa
PROSCAR Long-Term Efficacy and Safety Study (PLESS) -tutkimuksessa, 4 vuotta kestäneessä kontrolloidussa kliinisessä tutkimuksessa, 3040 iältään 45–78-vuotiasta potilasta, joilla oli oireinen BPH ja laajentunut eturauhanen, arvioitiin turvallisuuden suhteen 4 vuoden ajan (1524). PROSCAR 5 mg/vrk ja 1516 lumelääkettä). 3,7 % (57 potilasta) PROSCAR 5 mg:lla ja 2,1 % (32 potilasta) lumelääkettä keskeytti hoidon seksuaaliseen toimintaan liittyvien haittavaikutusten vuoksi, jotka ovat yleisimmin raportoituja haittavaikutuksia.
Taulukossa 2 on esitetty ainoat kliiniset haittavaikutukset, joita tutkija pitää mahdollisesti, todennäköisesti tai ehdottomasti lääkkeeseen liittyvinä ja joiden esiintyvyys PROSCAR-hoidossa oli ≥ 1 % ja suurempi kuin lumelääke tutkimuksen 4 vuoden aikana. Tutkimuksen vuosina 2–4 ei ollut merkittävää eroa hoitoryhmien välillä impotenssin, heikentyneen libido- ja siemensyöksyhäiriöiden ilmaantuvuuksissa.
TAULUKKO 2: Lääkkeisiin liittyvät haitalliset kokemukset PROSCAR:n (finasteridi 5 mg) hyvänlaatuisesta eturauhasen liikakasvusta
Haittavaikutusten profiilit yhden vuoden, lumekontrolloiduissa, faasin III BPH-tutkimuksissa ja 5 vuoden avoimissa jatkotutkimuksissa PROSCAR 5 mg:lla ja PLESS:llä olivat samanlaiset.
Ei ole näyttöä seksuaalisten haittavaikutusten lisääntymisestä, kun PROSCAR 5 mg -hoidon kesto on pidentynyt. Uudet raportit huumeisiin liittyvistä seksuaalisista haitallisista kokemuksista vähenivät hoidon keston myötä.
4–6 vuotta kestäneen lumelääke- ja vertailulääkekontrolloidun eturauhasoireiden lääketieteellisen hoidon (MTOPS) aikana, johon osallistui 3047 miestä, PROSCAR-hoitoa saaneilla miehillä todettiin 4 rintasyöpätapausta, mutta ei yhtään tapausta miehillä, joita ei hoidettu PROSCARilla. Neljä vuotta kestäneen lumekontrolloidun PLESS-tutkimuksen aikana, johon osallistui 3040 miestä, lumelääkettä saaneilla miehillä todettiin kaksi rintasyöpätapausta, mutta yhtään tapausta ei raportoitu PROSCAR-hoitoa saaneilla miehillä.
Seitsemän vuotta kestäneen lumekontrolloidun eturauhassyövän ehkäisytutkimuksen (PCPT) aikana, johon osallistui 18 882 miestä, PROSCAR-hoitoa saaneilla miehillä todettiin yksi rintasyöpätapaus ja lumelääkettä saaneilla miehillä yksi rintasyöpätapaus. Finasteridin pitkäaikaisen käytön ja miehen rintaneoplasian välistä yhteyttä ei tällä hetkellä tunneta.
PCPT-tutkimus oli 7 vuotta kestänyt satunnaistettu, kaksoissokkoutettu, lumekontrolloitu tutkimus, johon osallistui 18 882 tervettä ≥55-vuotiasta miestä, joilla oli normaali digitaalinen peräsuolen tutkimus ja PSA ≤3,0 ng/ml. Miehet saivat joko PROSCARia (finasteridi 5 mg) tai lumelääkettä päivittäin. Potilaat arvioitiin vuosittain PSA- ja digitaalisilla peräsuolen tutkimuksilla. Biopsiat otettiin kohonneen PSA:n, epänormaalin digitaalisen peräsuolentutkimuksen tai tutkimuksen päättymisen vuoksi. Gleason-pistemäärän 8–10 eturauhassyövän ilmaantuvuus oli suurempi finasteridilla hoidetuilla miehillä (1,8 %) kuin lumelääkettä saaneilla (1,1 %). Neljä vuotta kestäneessä lumekontrolloidussa kliinisessä tutkimuksessa toisella 5α-reduktaasin estäjällä [AVODART (dutasteridi)] havaittiin samanlaisia tuloksia Gleason-pistemäärän 8–10 eturauhassyövän osalta (1 % dutasteridi vs 0,5 % lumelääke). Näiden löydösten kliinistä merkitystä miesten PROPECIA-hoidon suhteen ei tunneta.
Kliinistä hyötyä ei ole osoitettu PROSCARilla hoidetuilla potilailla, joilla on eturauhassyöpä. PROSCARia ei ole hyväksytty vähentämään eturauhassyövän kehittymisriskiä.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu PROPECIA:n hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoiselta populaatiolta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeille altistumiseen:
Yliherkkyysreaktio: yliherkkyysreaktiot, kuten ihottuma, kutina, urtikaria ja angioedeema (mukaan lukien huulten, kielen, kurkun ja kasvojen turvotus);
Lisääntymisjärjestelmä: seksuaalinen toimintahäiriö, joka jatkui hoidon lopettamisen jälkeen, mukaan lukien erektiohäiriöt, libidohäiriöt, siemensyöksyhäiriöt ja orgasmihäiriöt; miehen hedelmättömyys ja/tai huono siemennesteen laatu (siemenen laadun normalisoitumista tai paranemista on raportoitu finasteridihoidon lopettamisen jälkeen); kivesten kipu; hematospermia.
Kasvaimet: miehen rintasyöpä;
Rintojen häiriöt: rintojen arkuus ja suureneminen;
Hermosto/psykiatriset: masennus
HUUMEIDEN VUOROVAIKUTUKSET
Sytokromi P450:een kytketty lääkeaineenvaihduntaentsyymijärjestelmä
Kliinisesti merkittäviä lääkkeiden yhteisvaikutuksia ei ole tunnistettu. Finasteridi ei näytä vaikuttavan sytokromi P450:een liittyvään lääkettä metaboloivaan entsyymijärjestelmään. Ihmisillä testattuja yhdisteitä ovat antipyriini, digoksiini, propranololi, teofylliini ja varfariini, eikä kliinisesti merkittäviä yhteisvaikutuksia havaittu.
Muu samanaikainen hoito
Vaikka erityisiä yhteisvaikutustutkimuksia ei tehty, finasteridia 1 mg:n tai suurempia annoksia käytettiin samanaikaisesti kliinisissä tutkimuksissa asetaminofeenin, asetyylisalisyylihapon, alfa-salpaajien, kipulääkkeiden, angiotensiinia konvertoivan entsyymin (ACE) estäjien, kouristuslääkkeiden, bentsodiatsepiinien, beetasalpaajien ja kalsiumin kanssa. -kanavasalpaajat, sydämen nitraatit, diureetit, H2-antagonistit, HMG-CoA-reduktaasin estäjät, prostaglandiinin syntetaasin estäjät (kutsutaan myös tulehduskipulääkkeiksi) ja kinolonien tulehduskipulääkkeet ilman näyttöä kliinisesti merkittävistä haitallisista yhteisvaikutuksista.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Naisten altistuminen – riski miessikiölle
PROPECIAa ei ole tarkoitettu käytettäväksi naisilla. Naiset eivät saa käsitellä murskattuja tai rikkoutuneita PROPECIA-tabletteja ollessaan raskaana tai mahdollisesti raskaana, koska finasteridi voi imeytyä ja aiheuttaa mahdollisen riskin miessikiölle. PROPECIA-tabletit on päällystetty ja ne estävät kosketuksen vaikuttavan aineen kanssa normaalin käsittelyn aikana, mikäli tabletteja ei ole rikottu tai murskattu. [Katso KÄYTTÖAIHEET JA KÄYTTÖ , VASTA-AIHEET , Käyttö tietyissä populaatioissa , MITEN TOIMITETAAN / Varastointi ja käsittely ja Potilasneuvontatiedot ]
Vaikutukset eturauhasspesifiseen antigeeniin (PSA)
Kliinisissä PROPECIA-tutkimuksissa (finasteridi, 1 mg) 18–41-vuotiailla miehillä seerumin eturauhasspesifisen antigeenin (PSA) keskiarvo laski lähtötilanteen arvosta 0,7 ng/ml arvoon 0,5 ng/ml 12. kuukaudessa. Kliinisissä tutkimuksissa PROSCARilla (finasteridi, 5 mg), kun sitä käytettiin iäkkäillä miehillä, joilla on hyvänlaatuinen eturauhasen liikakasvu (BPH), PSA-tasot laskevat noin 50 %. Muut PROSCAR-tutkimukset osoittivat, että se voi myös aiheuttaa seerumin PSA:n laskua eturauhassyövän yhteydessä. Nämä löydökset tulee ottaa huomioon seerumin PSA:n oikean tulkinnan kannalta arvioitaessa finasteridilla hoidettuja miehiä. Kaikki vahvistettu nousu alimmasta PSA-arvosta PROPECIA-hoidon aikana voi olla merkki eturauhassyövän esiintymisestä, ja se on arvioitava, vaikka PSA-tasot olisivat edelleen normaalin alueen sisällä miehillä, jotka eivät käytä 5α-reduktaasin estäjää. Myös PROPECIA 5 mg:n hoidon noudattamatta jättäminen voi vaikuttaa PSA-testin tuloksiin.
Lisääntynyt korkea-asteisen eturauhassyövän riski 5α-reduktaasin estäjillä
55-vuotiailla ja sitä vanhemmilla miehillä, joilla oli normaali digitaalinen peräsuolen tutkimus ja PSA ≤ 3,0 ng/ml lähtötilanteessa ja jotka ottivat finasteridia 5 mg/vrk (5 kertaa PROPECIA-annos) 7-vuotisessa eturauhassyövän ehkäisytutkimuksessa (PCPT), riski lisääntyi. Gleasonin pisteet 8–10 eturauhassyöpää (finasteridi 1,8 % vs. lumelääke 1,1 %). [Katso HAITTAVAIKUTUKSET ] Samanlaisia tuloksia havaittiin 4 vuotta kestäneessä lumekontrolloidussa kliinisessä tutkimuksessa toisella 5α-reduktaasin estäjän (dutasteridi, AVODART) kanssa (1 % dutasteridi vs. 0,5 % lumelääke). 5α-reduktaasin estäjät voivat lisätä korkea-asteisen eturauhassyövän riskiä. Ei ole varmistettu, vaikuttivatko 5α-reduktaasin estäjien eturauhasen tilavuutta vähentävä vaikutus tai tutkimukseen liittyvät tekijät näiden tutkimusten tuloksiin.
Pediatriset potilaat
PROPECIAa ei ole tarkoitettu käytettäväksi lapsipotilailla [katso Käyttö tietyissä populaatioissa ].
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( POTILASTIEDOT ).
Naisten altistuminen – riski miessikiölle
Lääkäreiden tulee kertoa potilaille, että naiset, jotka ovat raskaana tai saattavat olla raskaana, eivät saa käsitellä murskattuja tai rikkoutuneita PROPECIA-tabletteja, koska finasteridi voi imeytyä ja aiheuttaa mahdollisen riskin miessikiölle. PROPECIA 5 mg tabletit on päällystetty ja ne estävät kosketuksen vaikuttavan aineen kanssa normaalin käsittelyn aikana, mikäli tabletteja ei ole rikottu tai murskattu. Jos raskaana oleva tai mahdollisesti raskaana oleva nainen joutuu kosketuksiin murskattujen tai rikkoutuneiden PROPECIA 1 mg -tablettien kanssa, kosketusalue on pestävä välittömästi saippualla ja vedellä [ks. VASTA-AIHEET , VAROITUKSET JA VAROTOIMET , Käyttö tietyissä populaatioissa  ja MITEN TOIMITETAAN / Varastointi ja käsittely ].
Lisääntynyt korkea-asteen eturauhassyövän riski
Potilaille tulee kertoa, että korkea-asteinen eturauhassyöpä lisääntyi miehillä, joita hoidettiin BPH-hoitoon tarkoitetuilla 5α-reduktaasin estäjillä verrattuna lumelääkettä saaneisiin tutkimuksiin, joissa tarkasteltiin näiden lääkkeiden käyttöä eturauhassyövän ehkäisyssä [ks. VAROITUKSET JA VAROTOIMET ja HAITTAVAIKUTUKSET ].
Lisäohjeet
Lääkäreiden tulee neuvoa potilaitaan ilmoittamaan viipymättä kaikista rintojen muutoksista, kuten kyhmyistä, kivusta tai nännistä. Rintojen muutoksia, mukaan lukien rintojen suureneminen, arkuus ja kasvain, on raportoitu [katso HAITTAVAIKUTUKSET ].
Lääkäreiden tulee neuvoa potilaitaan lukemaan potilaspakkausseloste ennen PROPECIA-hoidon aloittamista ja lukemaan se uudelleen aina, kun resepti uusitaan, jotta he ovat perillä potilaille ajankohtaisista PROPECIA-valmisteista.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Tuumorigeenisestä vaikutuksesta ei havaittu näyttöä 24 kuukauden tutkimuksessa Sprague-Dawley-rotilla, jotka saivat finasteridia enintään 160 mg/kg/vrk uroksilla ja 320 mg/kg/vrk naarailla. Nämä annokset aiheuttivat 888- ja 2192-kertaisen systeemisen altistuksen rotilla verrattuna ihmisiin, jotka saivat ihmisille suositeltua 1 mg/vrk-annosta. Kaikki altistuslaskelmat perustuivat laskettuun AUC(0-24h) eläimillä ja keskimääräiseen AUC(0-24h) ihmisellä (0,05 μg•hr/ml).
19 kuukautta kestäneessä karsinogeenisuustutkimuksessa CD-1-hiirillä havaittiin tilastollisesti merkitsevä (p≤0,05) lisääntyminen kivesten Leydig-soluadenoomien ilmaantuvuudessa 1824-kertaisella altistuksella ihmiselle (250 mg/kg/vrk). Hiirillä 184-kertainen ihmisen altistus (25 mg/kg/vrk) ja rotilla 312-kertainen ihmisen altistus (≥40 mg/kg/vrk) havaittiin Leydig-solujen liikakasvun ilmaantuvuuden lisääntymistä. Positiivinen korrelaatio Leydig-solujen proliferatiivisten muutosten ja seerumin LH-tason nousun välillä (2–3-kertainen kontrolliin verrattuna) on osoitettu molemmilla jyrsijälajilla, joita on hoidettu suurilla annoksilla finasteridia. Lääkkeisiin liittyviä Leydig-solumuutoksia ei havaittu rotilla tai koirilla, joita hoidettiin finasteridilla 1 vuoden ajan 240 ja 2800 kertaa (20 mg/kg/vrk ja 45 mg/kg/vrk, vastaavasti) eikä hiirillä, joita hoidettiin 19 kuukauden ajan. 18,4 kertaa ihmisen altistuminen, arvioitu (2,5 mg/kg/vrk).
Mutageenisuutta ei havaittu in vitro -bakteerimutageneesimäärityksessä, nisäkässolumutageneesimäärityksessä tai in vitro -emäksisessä eluutiomäärityksessä. In vitro kromosomipoikkeavuusmäärityksessä, jossa käytettiin kiinanhamsterin munasarjasoluja, kromosomipoikkeavuuksien määrä lisääntyi hieman. In vivo -kromosomipoikkeavuuskokeessa hiirillä ei havaittu hoitoon liittyvää kromosomipoikkeavuuden lisääntymistä finasteridin suurimmalla siedetyllä annoksella 250 mg/kg/vrk (1824 kertaa ihmisen altistus), joka määritettiin karsinogeenisuustutkimuksissa.
Sukukypsillä urospuolisilla kaneilla, joita hoidettiin finasteridilla 4 344-kertaisella altistuksella ihmiselle (80 mg/kg/vrk) enintään 12 viikon ajan, ei havaittu vaikutusta hedelmällisyyteen, siittiöiden määrään tai siemensyöksymäärään. Sukukypsillä urosrotilla, joita hoidettiin 488-kertaisella altistuksella ihmiselle (80 mg/kg/vrk), ei havaittu merkitseviä vaikutuksia hedelmällisyyteen 6 tai 12 viikon hoidon jälkeen. kuitenkin, kun hoitoa jatkettiin 24 tai 30 viikkoa, havaittiin ilmeistä hedelmällisyyden, hedelmällisyyden laskua ja siihen liittyvää merkittävää siemenrakkuloiden ja eturauhasen painon laskua. Kaikki nämä vaikutukset korjaantuivat 6 viikon kuluessa hoidon lopettamisesta. Rotilla tai kaniineilla ei ole havaittu lääkkeeseen liittyvää vaikutusta kiveksiin tai parittelukykyyn. Tämä finasteridilla käsiteltyjen rottien hedelmällisyyden heikkeneminen on toissijaista sen vaikutuksesta lisäsukupuolielimiin (eturauhaseen ja siemenrakkuloihin), mikä johtaa siementulpan muodostumisen epäonnistumiseen. Siementulppa on välttämätön rottien normaalille hedelmällisyydelle, mutta sillä ei ole merkitystä ihmisellä.
Käyttö tietyissä populaatioissa
Raskaus
Raskausluokka X [katso VASTA-AIHEET ]. PROPECIA 5 mg on vasta-aiheinen naisille, jotka ovat tai voivat tulla raskaaksi. PROPECIA 5mg on tyypin II 5α-reduktaasin estäjä, joka estää testosteronin muuttumisen 5α-dihydrotestosteroniksi (DHT), hormoniksi, joka on välttämätön miesten sukupuolielinten normaalille kehitykselle. Eläinkokeissa finasteridi aiheutti ulkoisten sukupuolielinten epänormaalia kehitystä miessikiöillä. Jos tätä lääkettä käytetään raskauden aikana tai jos potilas tulee raskaaksi tämän lääkkeen käytön aikana, potilasta on informoitava mahdollisesta vaarasta miessikiölle.
Miesten sukuelinten epänormaali kehitys on odotettu seuraus, kun 5a-reduktaasin estäjät estävät testosteronin muuttumisen 5α-dihydrotestosteroniksi (DHT). Nämä tulokset ovat samanlaisia kuin ne, jotka on raportoitu miespuolisilla imeväisikäisillä, joilla on geneettinen 5α-reduktaasin puutos. Naiset voivat altistua finasteridille joutuessaan kosketuksiin murskattujen tai rikottujen PROPECIA 5 mg -tablettien tai PROPECIAa käyttävän mieskumppanin siemennesteen kanssa. Mitä tulee finasteridialtistukseen ihon läpi, PROPECIA-tabletit on päällystetty ja ne estävät ihokosketuksen finasteridin kanssa normaalin käsittelyn aikana, jos tabletteja ei ole murskattu tai rikottu. Naiset, jotka ovat raskaana tai saattavat tulla raskaaksi, eivät saa käsitellä murskattuja tai rikkoutuneita PROPECIA 5 mg -tabletteja, koska ne voivat altistua miespuoliselle sikiölle. Jos raskaana oleva nainen joutuu kosketuksiin murskattujen tai rikkoutuneiden PROPECIA 1 mg -tablettien kanssa, kosketusalue on pestävä välittömästi saippualla ja vedellä. Mitä tulee mahdolliseen finasteridialtistukseen siemennesteen kautta, miehillä, jotka saivat PROPECIAa 1 mg/vrk, on tehty tutkimus, jossa mitattiin finasteridipitoisuudet siemennesteessä [ks. KLIININEN FARMAKOLOGIA ].
Alkion ja sikiön kehitystutkimuksessa raskaana olevat rotat saivat finasteridia suuren organogeneesin aikana (raskauspäivät 6-17). Äidillä suun kautta annetuilla finasteridin annoksilla, jotka olivat noin 1–684 kertaa suositeltu ihmisannos (RHD) 1 mg/vrk (perustuen AUC-arvoon eläinannoksilla 0,1–100 mg/kg/vrk), havaittiin annoksesta riippuvaa hypospadioiden lisääntymistä. 3,6-100 % urospuolisista jälkeläisistä. Altistumiskertoimet arvioitiin käyttämällä tietoja ei-raskaana olevilta rotilta. Tiineyspäivät 16–17 ovat kriittistä aikaa urossikiörotilla ulkoisten sukuelinten erilaistumisen kannalta. Kun emon suun kautta annettiin suun kautta annettavia annoksia, jotka olivat noin 0,2 kertaa RHD:tä suuremmat (perustuen AUC:hen eläinannoksella 0,03 mg/kg/vrk), urospuolisten jälkeläisten eturauhasen ja siemenrakkuloiden painot, esinahan irtoaminen viivästyivät ja nännin ohimenevä kehitys. Anogenitaalinen etäisyys pieneni sellaisten raskaana olevien rottien urospuolisilla jälkeläisillä, jotka saivat noin 0,02 kertaa RHD:tä (perustuen AUC-arvoon eläinannoksella 0,003 mg/kg/vrk). Mitään poikkeavuuksia ei havaittu naaraspuolisilla jälkeläisillä, jotka olivat altistuneet millekään finasteridiannokselle kohdussa.
Kehityspoikkeavuuksia ei havaittu sellaisten hoitamattomien naarasrottien jälkeläisillä, jotka parittelivat finasteridilla hoidettujen urosrottien kanssa, jotka saivat noin 488-kertaisen RHD:n (perustuen AUC-arvoon eläinannoksella 80 mg/kg/vrk). Urospuolisilla jälkeläisillä havaittiin hieman heikentynyttä hedelmällisyyttä sen jälkeen, kun naarasrotille annettiin noin 20 kertaa RHD (AUC:n perusteella annoksella 3 mg/kg/vrk) naarasrotille myöhään tiineyden ja laktaation aikana. Näissä olosuhteissa naaraspuolisilla jälkeläisillä ei havaittu vaikutuksia hedelmällisyyteen.
Mitään merkkejä urospuolisten ulkoisten sukupuolielinten epämuodostuksista tai muista poikkeavuuksista ei havaittu kanin sikiöillä, jotka altistettiin finasteridille suuren organogeneesin aikana (raskauspäivät 6-18) emon annoksilla 100 mg/kg/vrk asti (finasteridialtistustasoja ei mitattu kanit). Tämä tutkimus ei kuitenkaan ehkä sisältänyt kriittistä ajanjaksoa finasteridin vaikutuksille kaniinin urospuolisten ulkoisten sukupuolielinten kehitykseen.
Emon finasteridialtistuksen sikiövaikutuksia alkion ja sikiön kehityksen aikana arvioitiin reesusapinoilla (tiineyspäivät 20-100), lajilla ja kehitysjaksolla, joka ennakoi ihmisen spesifisiä vaikutuksia paremmin kuin rotilla ja kaniineilla tehdyt tutkimukset. Finasteridin suonensisäinen antaminen raskaana oleville apinoille jopa 800 ng/vrk annoksina (arvioitu enimmäispitoisuus veressä on 1,86 ng/ml eli noin 930 kertaa suurempi kuin raskaana olevien naisten suurin arvioitu finasteridialtistus 1 mg/vrk ottaneiden miesten siemennesteestä) johti. ei poikkeavuuksia miessikiöissä. Vahvistaakseen reesusmallin merkityksen ihmisen sikiön kehitykselle suun kautta annos finasteridia (2 mg/kg/vrk tai noin 120 000 kertaa korkeimmat arvioidut finasteridipitoisuudet 1 mg/vrk ottaneiden miesten siemennesteestä) raskaana olevat apinat johtivat ulkoisten sukuelinten poikkeavuuksiin urossikiöissä. Mitään muita poikkeavuuksia ei havaittu miessikiöillä eikä finasteridiin liittyviä poikkeavuuksia naisten sikiöillä millään annoksilla.
Imettävät äidit
PROPECIAa ei ole tarkoitettu käytettäväksi naisilla.
Ei tiedetä, erittyykö finasteridi äidinmaitoon.
Käyttö lapsille
PROPECIA 1 mg ei ole tarkoitettu käytettäväksi lapsipotilailla.

Turvallisuutta ja tehokkuutta lapsipotilailla ei ole osoitettu.
Geriatrinen käyttö
PROPECIAlla tehdyissä kliinisissä tehotutkimuksissa ei ollut mukana 65-vuotiaita ja sitä vanhempia. Finasteridin 5 mg:n farmakokinetiikkaan perustuen PROPECIA-annoksen muuttaminen ei ole tarpeen vanhuksilla [ks. KLIININEN FARMAKOLOGIA ]. PROPECIA 1 mg:n tehoa vanhuksilla ei kuitenkaan ole osoitettu.
Maksan vajaatoiminta
Varovaisuutta on noudatettava annettaessa PROPECIA 5 mg potilaille, joilla on maksan toimintahäiriöitä, koska finasteridi metaboloituu laajalti maksassa [ks. KLIININEN FARMAKOLOGIA ].
Munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa potilailla, joilla on munuaisten vajaatoiminta [katso KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
Kliinisissä tutkimuksissa enintään 400 mg:n finasteridin kerta-annokset ja enintään 80 mg:n finasteridin useat annokset vuorokaudessa kolmen kuukauden ajan eivät aiheuttaneet haittavaikutuksia. Ennen kuin kokemusta on saatu, finasteridin yliannostukseen ei voida suositella erityistä hoitoa.
Merkittävää kuolleisuutta havaittiin uros- ja naaraspuolisilla hiirillä kerta-annoksilla 1500 mg/m² (500 mg/kg) ja naaras- ja urosrotilla oraalisilla kerta-annoksilla 2360 mg/m² (400 mg/kg) ja 5900 mg/m². (1000 mg/kg), vastaavasti.
VASTA-AIHEET
PROPECIA 5mg on vasta-aiheinen seuraavissa tapauksissa:
- Raskaus. Finasteridin käyttö on vasta-aiheista naisille, jotka ovat tai voivat olla raskaana. Koska tyypin II 5α-reduktaasin estäjät pystyvät estämään testosteronin muuttumisen 5α-dihydrotestosteroniksi (DHT), finasteridi voi aiheuttaa poikkeavuuksia finasteridia saavan raskaana olevan naisen miessikiön ulkoisissa sukupuolielimissä. Jos tätä lääkettä käytetään raskauden aikana tai jos raskaus tapahtuu tämän lääkkeen käytön aikana, raskaana olevalle naiselle on kerrottava mahdollisesta vaarasta miessikiölle. [Katso VAROITUKSET JA VAROTOIMET , Käyttö tietyissä populaatioissa , MITEN TOIMITETAAN / Varastointi ja käsittely ja Potilasneuvontatiedot Naarasrotilla raskauden aikana annetut pienet finasteridiannokset ovat aiheuttaneet poikkeavuuksia urospuolisten jälkeläisten ulkoisissa sukupuolielimissä.
- Yliherkkyys jollekin tämän lääkkeen komponentille.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Finasteridi on kilpaileva ja spesifinen tyypin II 5α-reduktaasin estäjä, solunsisäinen entsyymi, joka muuttaa androgeenin testosteronin DHT:ksi. Hiiristä, rotista, apinoista ja ihmisistä löytyy kaksi erillistä isotsyymiä: tyyppi I ja II. Jokainen näistä isoentsyymeistä ilmentyy eri tavalla kudoksissa ja kehitysvaiheissa. Ihmisillä tyypin I 5α-reduktaasi on vallitseva useimpien ihon alueiden talirauhasissa, mukaan lukien päänahka ja maksa. Tyypin I 5α-reduktaasi vastaa noin kolmanneksesta kiertävästä DHT:sta. Tyypin II 5a-reduktaasi-isotsyymi esiintyy ensisijaisesti eturauhasessa, siemenrakkuloissa, lisäkivesaineissa ja karvatuppeissa sekä maksassa, ja se vastaa kahdesta kolmasosasta kiertävästä DHT:sta.
Ihmisillä finasteridin vaikutusmekanismi perustuu sen ensisijaiseen tyypin II isotsyymin estoon. Natiivikudoksia (päänahkaa ja eturauhasta) käyttäen tehdyt in vitro -sitoutumistutkimukset, joissa tutkittiin finasteridin potentiaalia inhiboida jompaakumpaa isotsyymiä, paljastivat 100-kertaisen selektiivisyyden ihmisen tyypin II 5α-reduktaasin suhteen tyypin I isotsyymiin (IC50 = 500 ja 4,2 nM tyypin I isotsyymiin) ja II). Molemmilla isotsyymeillä finasteridin estoon liittyy inhibiittorin pelkistyminen dihydrofinasteridiksi ja additioliitoksen muodostuminen NADP+:n kanssa. Entsyymikompleksin vaihtuvuus on hidasta (t½ noin 30 päivää tyypin II entsyymikompleksilla ja 14 päivää tyypin I kompleksilla). Tyypin II 5a-reduktaasin esto estää testosteronin perifeerisen konversion DHT:ksi, mikä johtaa seerumin ja kudoksen DHT-pitoisuuksien merkittävään laskuun.
Miehillä, joilla on miestyyppistä hiustenlähtöä (androgeneettinen hiustenlähtö), kaljuuntuva päänaha sisältää pienennettyjä hiusrakkuloita ja suurempia määriä DHT:ta verrattuna karvaiseen päänahkaan. Finasteridin anto alentaa päänahan ja seerumin DHT-pitoisuutta näillä miehillä. Näiden vähennysten suhteellista vaikutusta finasteridin hoitovaikutukseen ei ole määritelty. Tämän mekanismin ansiosta finasteridi näyttää keskeyttävän androgeenisen hiustenlähtöön avaintekijän niillä potilailla, joilla on geneettinen taipumus.
Farmakodynamiikka
Finasteridi alentaa nopeasti seerumin DHT-pitoisuutta ja saavuttaa 65 %:n suppression 24 tunnin kuluessa 1 mg:n tabletin oraalisesta annostelusta. Testosteronin ja estradiolin keskimääräiset verenkierron tasot nousivat noin 15 % lähtötasoon verrattuna, mutta ne pysyivät fysiologisilla rajoilla.
Finasteridilla ei ole affiniteettia androgeenireseptoriin, eikä sillä ole androgeenisiä, antiandrogeenisia, estrogeenisiä, antiestrogeenisiä tai progestaatiovaikutuksia. Finasteridilla tehdyissä tutkimuksissa ei havaittu kliinisesti merkittäviä muutoksia luteinisoivassa hormonissa (LH), follikkelia stimuloivassa hormonissa (FSH) tai prolaktiinissa. Terveillä vapaaehtoisilla finasteridihoito ei muuttanut LH:n ja FSH:n vastetta gonadotropiinia vapauttavalle hormonille, mikä osoitti, että hypotalamus-aivolisäke-kives-akselilla ei ollut vaikutusta.
Finasteridilla ei ollut vaikutusta verenkierrossa olevaan kortisolin, kilpirauhasta stimuloivan hormonin tai tyroksiinin tasoihin, eikä se vaikuttanut plasman lipidiprofiiliin (esim. kokonaiskolesteroli, matalatiheyksiset lipoproteiinit, korkeatiheyksiset lipoproteiinit ja triglyseridit) tai luun mineraalitiheyteen.
Farmakokinetiikka
Imeytyminen
Tutkimuksessa, johon osallistui 15 tervettä nuorta miespuolista koehenkilöä, 1 mg:n finasteriditablettien keskimääräinen hyötyosuus oli 65 % (vaihteluväli 26-170 %) perustuen käyrän alla olevan pinta-alan (AUC) suhteeseen suonensisäiseen (IV) referenssiin. annos. Vakaassa tilassa 1 mg/vrk annostuksen jälkeen (n=12) finasteridin maksimipitoisuus plasmassa oli keskimäärin 9,2 ng/ml (vaihteluväli 4,9-13,7 ng/ml) ja saavutettiin 1-2 tunnin kuluttua annoksesta; AUC oli 53 ng•hr/ml (alue, 20-154 ng•hr/ml). Ruoka ei vaikuttanut finasteridin biologiseen hyötyosuuteen.
Jakelu
Keskimääräinen vakaan tilan jakautumistilavuus oli 76 litraa (vaihteluväli 44-96 litraa; n=15). Noin 90 % verenkierrossa olevasta finasteridista sitoutuu plasman proteiineihin. Finasteridilla on hidas kertymisvaihe toistuvan annostelun jälkeen.
Finasteridin on todettu ylittävän veri-aivoesteen.
Siemennesteen tasot on mitattu 35 mieheltä, jotka ottivat finasteridia 1 mg/vrk 6 viikon ajan. 60 %:ssa (21/35) näytteistä finasteridipitoisuudet eivät olleet havaittavissa ( Käyttö tietyissä populaatioissa ]
Aineenvaihdunta
Finasteridi metaboloituu laajalti maksassa, pääasiassa sytokromi P450 3A4 -entsyymialaperheen kautta. Kaksi metaboliittia, t-butyylisivuketjun monohydroksyloitunut ja monokarboksyylihappometaboliitit, on tunnistettu, joilla on enintään 20 % finasteridin 5α-reduktaasia estävästä vaikutuksesta.
Erittyminen
Suonensisäisen infuusion jälkeen terveillä nuorilla koehenkilöillä (n=15) finasteridin keskimääräinen plasmapuhdistuma oli 165 ml/min (vaihteluväli 70-279 ml/min). Keskimääräinen terminaalinen puoliintumisaika plasmassa oli 4,5 tuntia (vaihteluväli 3,3-13,4 tuntia; n = 12). Suun kautta annetun 14C-finasteridiannoksen jälkeen ihmisellä (n=6) keskimäärin 39 % (vaihteluväli 32-46 %) annoksesta erittyi virtsaan metaboliittien muodossa; 57 % (vaihteluväli 51-64 %) erittyi ulosteeseen.
Keskimääräinen terminaalinen puoliintumisaika on noin 5-6 tuntia 18-60-vuotiailla miehillä ja 8 tuntia yli 70-vuotiailla miehillä.
TAULUKKO 3: Keskimääräiset (SD) farmakokineettiset parametrit terveillä miehillä (18–26-vuotiaat)
TAULUKKO 4: Keskimääräiset (SD) ei-osastolliset farmakokineettiset parametrit useiden 1 mg/vrk annosten jälkeen terveillä miehillä (19–42-vuotiaat)
Munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa potilailla, joilla on munuaisten vajaatoiminta. Kroonista munuaisten vajaatoimintaa sairastavilla potilailla, joiden kreatiniinipuhdistumat vaihtelivat välillä 9,0-55 ml/min, AUC, maksimipitoisuus plasmassa, puoliintumisaika ja sitoutuminen proteiineihin olivat samanlaiset kuin terveillä vapaaehtoisilla. Metaboliittien erittyminen virtsaan väheni potilailla, joilla oli munuaisten vajaatoiminta. Tämä väheneminen liittyi metaboliittien ulosteen erittymisen lisääntymiseen. Plasman metaboliittien pitoisuudet olivat merkittävästi korkeammat munuaisten vajaatoimintaa sairastavilla potilailla (perustuu 60 %:n nousuun kokonaisradioaktiivisuuden AUC:ssa). Finasteridi on kuitenkin siedetty miehillä, joilla on normaali munuaisten toiminta ja jotka ovat saaneet enintään 80 mg/vrk 12 viikon ajan, jolloin näiden potilaiden altistuminen metaboliiteille olisi oletettavasti paljon suurempi.
Maksan vajaatoiminta
Maksan vajaatoiminnan vaikutusta finasteridin farmakokinetiikkaan ei ole tutkittu. Varovaisuutta tulee noudattaa annettaessa PROPECIA 1 mg potilaille, joilla on maksan toimintahäiriöitä, koska finasteridi metaboloituu laajalti maksassa.
Kliiniset tutkimukset
Tutkimukset miehillä
PROPECIA 1 mg:n teho osoitettiin miehillä (88 % valkoihoisia), joilla oli lievä tai kohtalainen androgeneettinen hiustenlähtö (miestyyppinen hiustenlähtö) 18–41-vuotiailla. Seborrooisen ihottuman estämiseksi, joka saattaa sekoittaa karvankasvun arviointia näissä tutkimuksissa, kaikkia miehiä, olivatpa he sitten finasteridilla tai lumelääkettä hoidettuja, ohjeistettiin käyttämään tiettyä, lääkepitoista, tervapohjaista shampoota (Neutrogena T/Gel® Shampoo) opintojen ensimmäiset 2 vuotta.
Oli kolme kaksoissokkoutettua, satunnaistettua, lumekontrolloitua tutkimusta, jotka kestivät 12 kuukautta. Kaksi ensisijaista päätetapahtumaa olivat hiusten määrä ja potilaan itsearviointi; kaksi toissijaista päätetapahtumaa olivat tutkijan arviointi ja valokuvien luokitukset. Lisäksi kerättiin tietoa seksuaalisesta toiminnasta (itsetäytettyyn kyselyyn perustuen) ja ei-päänahan vartalon karvojen kasvusta. Nämä kolme tutkimusta suoritettiin 1879 miehellä, joilla oli lievä tai kohtalainen, mutta ei täydellinen hiustenlähtö. Kahteen tutkimukseen osallistui miehiä, joilla oli pääosin lievää tai kohtalaista vertex-hiustenlähtöä (n=1553). Kolmannen mukaan miehillä oli lievää tai kohtalaista hiustenlähtöä hiuspohjan etummaisen puolivälin alueella, jossa oli tai ei ole kärkikaljuutta (n = 326).
Tutkimukset miehillä, joilla on Vertex-kaljuuntuminen
Miehistä, jotka suorittivat ensimmäiset 12 kuukautta kahdesta huippukaljuuntumistutkimuksesta, 1215 päätti jatkaa kaksoissokkoutetussa lumekontrolloidussa 12 kuukauden jatkotutkimuksessa. 547 miestä sai PROPECIA 5 mg sekä alkututkimuksen että ensimmäisten jatkojaksojen aikana (enintään 2 vuotta) ja 60 miestä sai lumelääkettä samana ajanjaksona. Jatkotutkimuksia jatkettiin vielä 3 vuotta, jolloin 323 miestä, jotka saivat PROPECIA 5 mg:n ja 23 lumelääkettä, aloitti tutkimuksen viidennen vuoden.
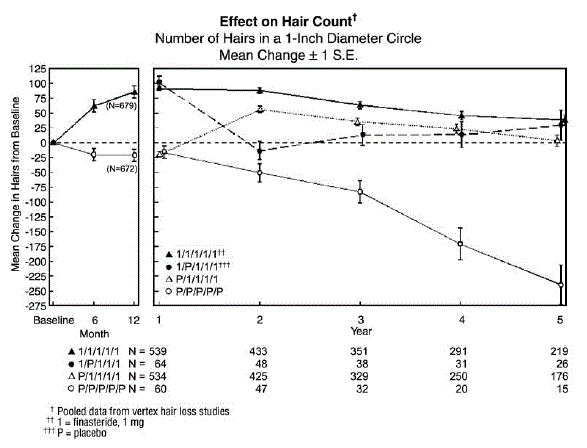
Hoidon lopettamisen vaikutuksen arvioimiseksi 65 miestä sai PROPECIAa 5 mg ensimmäisten 12 kuukauden ajan ja sitten lumelääkettä ensimmäisen 12 kuukauden jatkojakson aikana. Jotkut näistä miehistä jatkoivat lisätutkimuksissa, ja heidät siirrettiin takaisin PROPECIA 5 mg -hoitoon, ja 32 miestä aloitti tutkimuksen viidennen vuoden. Lopuksi 543 miestä sai lumelääkettä ensimmäisten 12 kuukauden ajan, minkä jälkeen PROPECIAa ensimmäisen 12 kuukauden jatkojakson aikana. Jotkut näistä miehistä jatkoivat lisätutkimuksissa, jotka saivat PROPECIAa 5 mg, jolloin 290 miestä aloitti tutkimuksen viidennen vuoden (ks. kuva 1 alla).
Hiusten määrä arvioitiin valokuvaussuurennuksilla aktiivisen hiustenlähtöön kuuluvalla alueella. Näissä kahdessa tutkimuksessa miehillä, joilla oli huippukaljuuntuminen, havaittiin merkittävää hiusten määrän lisääntymistä 6 ja 12 kuukauden kohdalla PROPECIA 5 mg:lla hoidetuilla miehillä, kun taas lumelääkettä saaneilla havaittiin merkittävää hiustenlähtöä lähtötasosta. 12 kuukauden kohdalla havaittiin 107 hiuksen ero lumelääkkeeseen (p
Potilailla, jotka vaihtoivat lumelääkkeestä PROPECIA-hoitoon (n = 425), hiusten määrä väheni ensimmäisen 12 kuukauden lumelääkejakson lopussa, mitä seurasi hiusten määrän lisääntyminen yhden vuoden PROPECIA-hoidon jälkeen. Tämä hiusten määrän lisääntyminen oli vähemmän (56 hiusta alkuperäisen lähtötason yläpuolella) kuin lisääntyminen (91 hiusta alkuperäisen lähtötason yläpuolella) vuoden hoidon jälkeen miehillä, jotka alun perin satunnaistettiin PROPECIA-ryhmään. Vaikka hiusten määrän kasvu suhteessa hoidon aloitushetkeen oli vertailukelpoinen näiden kahden ryhmän välillä, suurempi absoluuttinen hiusten määrä saavutettiin potilailla, jotka aloittivat PROPECIA-hoidon alkuperäisessä tutkimuksessa. Tämä etu säilyi tutkimusten jäljellä olevien kolmen vuoden ajan. Hoidon vaihtaminen PROPECIA 5 mg:sta lumelääkkeeseen (n=48) ensimmäisten 12 kuukauden lopussa johti hiusten määrän kasvun kääntymiseen 12 kuukautta myöhemmin, 24 kuukauden kohdalla (katso kuva 1 alla).
12 kuukauden kohdalla lumelääkeryhmän miehistä 58 %:lla hiustenlähtöä esiintyi edelleen (määriteltynä hiusten määrän vähenemisenä lähtötasosta) verrattuna 14 %:iin PROPECIA-hoitoa saaneista miehistä. Enintään 2 vuotta hoidetuista miehistä 72 %:lla lumeryhmän miehistä todettiin hiustenlähtöä verrattuna 17 %:iin PROPECIA-hoitoa saaneista miehistä. Viiden vuoden kuluttua 100 % lumeryhmässä miehistä osoitti hiustenlähtöä verrattuna 35 %:iin PROPECIAlla hoidetuista miehistä.
Kuvio 1
Potilaan itsearviointi saatiin jokaisella klinikkakäynnillä itsetehdyllä kyselylomakkeella, joka sisälsi kysymyksiä heidän käsityksestään hiusten kasvusta, hiustenlähtöstä ja ulkonäöstä. Tämä itsearviointi osoitti, että PROPECIA-hoitoa saaneiden miesten hiusten määrä lisääntyi, hiustenlähtö väheni ja ulkonäkö paranee. Yleinen parannus lumelääkkeeseen verrattuna havaittiin jo 3 kuukauden kuluttua (p
Tutkijan arvio perustui 7-pisteen asteikkoon, jossa arvioitiin päänahan karvojen lisääntymistä tai vähenemistä jokaisella potilaskäynnillä. Tämä arvio osoitti merkittävästi enemmän hiusten kasvua PROPECIA-hoitoa saaneilla miehillä verrattuna lumelääkkeeseen jo kolmen kuukauden kuluttua (p
Riippumaton paneeli arvioi standardoidut valokuvat päästä sokeutetulla tavalla päänahan hiusten kasvun tai vähenemisen perusteella käyttäen samaa 7 pisteen asteikkoa kuin tutkijan arvio. 12 kuukauden kohdalla 48 %:lla PROPECIA-hoitoa saaneista miehistä lisääntyi verrattuna 7 %:iin lumelääkettä saaneista miehistä. Kahden vuoden kohdalla hiusten kasvun lisääntyminen todettiin 66 %:lla miehistä, joita hoidettiin PROPECIA 5 mg:lla, verrattuna 7 %:iin lumelääkettä saaneista miehistä. 5 vuoden kohdalla 48 %:lla PROPECIA 5 mg:lla hoidetuista miehistä havaittiin hiusten kasvun lisääntymistä, 42 %:lla ei havaittu muutosta (ei näkyvää hiustenlähtöön liittyvää etenemistä lähtötasosta) ja 10 %:lla arvioitiin menettäneen hiuksiaan verrattuna perusviiva. Vertailun vuoksi, 6 % lumelääkkeellä hoidetuista miehistä osoitti hiusten kasvun kiihtymistä, 19 %:lla ei tapahtunut muutosta ja 75 %:lla arvioitiin menettäneen hiuksiaan verrattuna lähtötasoon.
48 viikkoa kestäneeseen lumekontrolloituun tutkimukseen, jonka tarkoituksena oli arvioida fototrichogrammin avulla PROPECIA:n vaikutusta päänahan kokonaishiuksiin ja aktiivisesti kasvaviin (anageenisiin) hiuksiin vertex-kaljuuntumisen yhteydessä, otettiin mukaan 212 androgeneettistä hiustenlähtöä sairastavaa miestä. Lähtötilanteessa ja 48 viikon kohdalla mitattiin hiusten kokonais- ja anageenimäärät 1 cm²:n päänahan kohdealueelta. PROPECIAlla hoidetuilla miehillä oli 7 hiuksen ja 18 hiuksen lisäystä lähtötilanteesta, kun taas lumelääkettä saaneiden miesten määrä väheni 10 hiuksella ja 9 hiuksella. Nämä muutokset hiusten määrässä johtivat ryhmien väliseen eroon, joka oli 17 hiuksen kokonaismäärässä (p
Muita tuloksia Vertex-kaljuuntumistutkimuksissa
Potilaat, jotka osallistuivat kahteen huippukaljuuntumistutkimukseen, antoivat itse seksuaalisen toiminnan kyselylomakkeen havaitakseen hienovaraisempia muutoksia seksuaalisessa toiminnassa. Kuukauden 12 kohdalla tilastollisesti merkitseviä eroja lumelääkkeen hyväksi havaittiin kolmella alueella neljästä (seksuaalinen kiinnostus, erektio ja seksuaalisten ongelmien käsitys). Kuitenkaan ei havaittu merkittävää eroa kysymyksessä yleisestä tyytyväisyydestä seksielämään.
Yhdessä kahdesta huippukaljuuntumistutkimuksesta potilaita kysyttiin muun kuin päänahan vartalon karvojen kasvusta. PROPECIA ei näyttänyt vaikuttavan muihin kuin päänahan hiuksiin.
Tutki miehiä, joilla on hiustenlähtöä etummaisen päänahan alueella
12 kuukautta kestänyt tutkimus, jonka tarkoituksena oli arvioida PROPECIA 5 mg:n tehoa miehillä, joilla oli hiustenlähtöä päänahan etummaisen keskiosan alueella, osoitti myös hiusten määrän merkittävää lisääntymistä lumelääkkeeseen verrattuna. Hiusten määrän kasvuun liittyi parannuksia potilaiden itsearvioinnissa, tutkijan arvioinnissa ja standardoituihin valokuviin perustuvissa arvioissa. Hiusmäärät saatiin päänahan etummaisen keskiosan alueelta, eivätkä ne sisältäneet bitemporaalisen taantuman aluetta tai etummaista hiusrajaa.
Yhteenveto miehillä tehdyistä kliinisistä tutkimuksista
Kliiniset tutkimukset suoritettiin 18–41-vuotiailla miehillä, joilla oli lievä tai kohtalainen androgeneettinen hiustenlähtö. Kaikki miehet, joita hoidettiin PROPECIA 5 mg:lla tai lumelääkevalmisteella, saivat tervapohjaista shampoota (Neutrogena T/Gel® Shampoo) tutkimusten kahden ensimmäisen vuoden aikana. Kliininen paraneminen havaittiin jo 3 kuukauden kuluttua PROPECIA 5 mg:lla hoidetuilla potilailla, mikä johti päänahan hiusten määrän lisääntymiseen ja hiusten uudelleenkasvuun. Kliinisissä tutkimuksissa jopa 5 vuotta PROPECIA 5 mg:lla hidasti plaseboryhmässä havaittua hiustenlähtöä. Yleensä ero hoitoryhmien välillä jatkoi kasvuaan tutkimusten viiden vuoden ajan.
Miesten kliinisten tietojen etninen analyysi
Kahden huippukaljuutta koskevan tutkimuksen yhdistetyssä analyysissä keskimääräiset hiusten määrän muutokset lähtötasosta olivat 91 vs. -19 hiusta (PROPECIA 5 mg vs. lumelääke) valkoihoisilla (n = 1185) ja 49 vs -27 hiuksia mustilla (n = 84). , 53 vs -38 hiuksia aasialaisilla (n = 17), 67 vs 5 hiuksia latinalaisamerikkalaisilla (n = 45) ja 67 vs -15 hiuksia muilla etnisillä ryhmillä (n = 20). Potilaan itsearviointi osoitti parannusta roduryhmissä PROPECIA-hoidolla, lukuun ottamatta tyytyväisyyttä otsahiusrajaan ja kärkeen mustilla miehillä, jotka olivat kaiken kaikkiaan tyytyväisiä.
Tutkimus naisista
Tutkimuksessa, johon osallistui 137 postmenopausaalista naista, joilla oli androgeneettinen hiustenlähtö ja joita hoidettiin PROPECIAlla (n=67) tai lumelääke (n=70) 12 kuukauden ajan, tehoa ei voitu osoittaa. Propecialla hoidetuilla naisilla ei havaittu parannusta hiusten määrässä, potilaan itsearvioinnissa, tutkijan arvioinnissa tai standardoitujen valokuvien arvioissa verrattuna lumeryhmään [ks. KÄYTTÖAIHEET JA KÄYTTÖ ].
POTILASTIEDOT
PROPECIA (Pro-pee-sha) (finasteridi) Tabletit
PROPECIA® on tarkoitettu VAIN MIESTEN käyttöön, eikä naisten tai lasten tule käyttää sitä.
Lue nämä potilastiedot ennen kuin aloitat PROPECIA 5 mg:n käytön ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Nämä tiedot eivät korvaa terveydenhuollon tarjoajan kanssa puhumista terveydentilastasi tai hoidostasi.
Mikä on PROPECIA 5mg?
PROPECIA 5mg on reseptilääke, jota käytetään miesten hiustenlähtöön (androgeneettisen hiustenlähtöön).
Ei tiedetä, toimiiko PROPECIA 5mg hiusrajan taantumiseen otsasi molemmilla puolilla ja sen yläpuolella (temporaalinen alue).
PROPECIA 5 mg ei ole tarkoitettu naisten ja lasten käyttöön.
Kuka ei saa ottaa PROPECIA 5 mg:aa?
Älä ota PROPECIA 1 mg:aa, jos:
- ovat raskaana tai saattavat tulla raskaaksi. PROPECIA voi vahingoittaa sikiötäsi.
- PROPECIA 1 mg tabletit on päällystetty ja ne estävät kosketuksen lääkkeen kanssa käsittelyn aikana niin kauan kuin tabletit eivät ole rikki tai murskattu. Naiset, jotka ovat raskaana tai voivat tulla raskaaksi, eivät saa joutua kosketuksiin rikkoutuneiden tai murskattujen PROPECIA-tablettien kanssa. Jos raskaana oleva nainen joutuu kosketuksiin murskattujen tai rikkoutuneiden PROPECIA 5 mg tablettien kanssa, pese kosketusalue välittömästi saippualla ja vedellä. Jos raskaana oleva nainen joutuu kosketuksiin PROPECIA 5 mg:n vaikuttavan aineen kanssa, on otettava yhteyttä terveydenhuollon ammattilaiseen.
- Jos nainen, joka on raskaana urospuolisen vauvan kanssa, nielee tai joutuu kosketuksiin PROPECIA-valmisteen kanssa, urospuolisella vauvalla voi syntyä epänormaalia sukupuolielimiä.
- olet allerginen jollekin PROPECIA-valmisteen aineosalle. Katso tämän pakkausselosteen lopusta täydellinen luettelo PROPECIA-valmisteen ainesosista.
Mitä minun pitäisi kertoa terveydenhuollon tarjoajalleni ennen PROPECIA 5 mg:n ottamista?
Ennen kuin otat PROPECIA 5 mg:n, kerro terveydenhuollon tarjoajallesi, jos:
- sinulla on muita sairauksia, mukaan lukien eturauhasen tai maksan toimintahäiriöt
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien reseptilääkkeet ja ilman reseptiä saatavat lääkkeet, vitamiinit ja yrttilisät.
Tunne käyttämäsi lääkkeet. Pidä niistä luetteloa näyttääksesi terveydenhuollon tarjoajalle ja apteekkihenkilökunnalle, kun saat uuden lääkkeen.
Miten minun pitäisi ottaa PROPECIA 5 mg?
- Ota PROPECIA 5 mg juuri sen verran kuin terveydenhuollon tarjoajasi on määrännyt.
- Voit ottaa PROPECIA 5 mg:n ruoan kanssa tai ilman.
- Jos unohdat ottaa PROPECIA 1 mg:n, älä ota ylimääräistä tablettia. Ota seuraava tabletti tavalliseen tapaan.
PROPECIA ei tehoa nopeammin tai paremmin, jos otat sen useammin kuin kerran päivässä.
Mitkä ovat PROPECIA:n mahdolliset sivuvaikutukset?
- veren eturauhasspesifisen antigeenin (PSA) tason lasku. PROPECIA voi vaikuttaa verikokeeseen, jota kutsutaan PSA:ksi (eturauhasspesifinen antigeeni) eturauhassyövän seulomiseksi. Jos sinulle tehdään PSA-testi, kerro terveydenhuollon tarjoajalle, että käytät PROPECIAa, koska PROPECIA 1mg alentaa PSA-tasoja. PSA-tasojen muutokset on arvioitava terveydenhuollon tarjoajan toimesta. Mikä tahansa seuranta-PSA-tason nousu alimmasta pisteestä voi olla merkki eturauhassyövän olemassaolosta, ja se on arvioitava, vaikka testitulokset olisivat edelleen normaalin alueen sisällä miehillä, jotka eivät käytä PROPECIAa. Kerro myös terveydenhuollon tarjoajalle, jos et ole käyttänyt PROPECIA 1 mg:aa ohjeiden mukaan, koska tämä voi vaikuttaa PSA-testin tuloksiin. Lisätietoja saat terveydenhuollon tarjoajaltasi.
- Eturauhassyövän vakavamman muodon riski voi olla lisääntynyt miehillä, jotka käyttävät finasteridia viisinkertaisesti PROPECIA-annokseen verrattuna.
PROPECIA:n yleisimmät sivuvaikutukset ovat:
- seksihalun väheneminen
- ongelmia erektion saamisessa tai säilyttämisessä
- siemennesteen määrän väheneminen
Seuraavia on raportoitu yleisessä käytössä PROPECIA:n kanssa:
- rintojen arkuus ja suureneminen. Kerro terveydenhuollon tarjoajallesi kaikista rinnoissasi tapahtuvista muutoksista, kuten kyhmyistä, kivusta tai nännistä.
- masennus;
- sukupuolihalun väheneminen, joka jatkui lääkityksen lopettamisen jälkeen;
- allergiset reaktiot, mukaan lukien ihottuma, kutina, nokkosihottuma ja huulten, kielen, kurkun ja kasvojen turvotus;
- siemensyöksyongelmat, jotka jatkuivat lääkityksen lopettamisen jälkeen;
- kivesten kipu;
- veri siemennesteessä;
- vaikeudet saavuttaa erektio, joka jatkui lääkityksen lopettamisen jälkeen;
- miehen hedelmättömyys ja/tai siemennesteen huono laatu.
- harvoissa tapauksissa miehen rintasyöpä.
Kerro terveydenhuollon tarjoajallesi, jos sinulla on jokin haittavaikutus, joka häiritsee sinua tai joka ei katoa.
Nämä eivät ole kaikkia PROPECIAN mahdollisia sivuvaikutuksia. Lisätietoja saat terveydenhuollon tarjoajalta tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Miten PROPECIA 1mg pitäisi säilyttää?
- Säilytä PROPECIA 5 mg huoneenlämmössä 59 °F - 86 °F (15 °C - 30 °C).
- Säilytä PROPECIA suljetussa astiassa ja pidä PROPECIA 5 mg tabletit kuivina (suojaa kosteudelta).
Pidä PROPECIA ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä PROPECIA:n turvallisesta ja tehokkaasta käytöstä.
Lääkkeitä määrätään joskus muihin kuin tässä potilasohjeessa lueteltuihin tarkoituksiin. Älä käytä PROPECIA 5 mg:aa sairauteen, johon sitä ei ole määrätty. Älä anna PROPECIAa muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Tämä potilastietolehtinen sisältää yhteenvedon tärkeimmistä PROPECIA-tiedoista. Jos haluat lisätietoja, keskustele terveydenhuollon tarjoajasi kanssa. Voit kysyä apteekista tai terveydenhuollon tarjoajalta tietoja PROPECIAsta, joka on kirjoitettu terveydenhuollon ammattilaisille. Lisätietoja saat soittamalla numeroon 1-844-674-3200.
Mitä ainesosia PROPECIA 1mg sisältää?
Vaikuttava aine: finasteridi.
Ei-aktiiviset aineet: laktoosimonohydraatti, mikrokiteinen selluloosa, esigelatinoitu tärkkelys, natriumtärkkelysglykolaatti, hydroksipropyylimetyyliselluloosa, hydroksipropyyliselluloosa, titaanidioksidi, magnesiumstearaatti, talkki, dokusaattinatrium, keltainen rautaoksidi ja punainen rautaoksidi.
Yhdysvaltain elintarvike- ja lääkevirasto on hyväksynyt nämä potilastiedot.
