Hiusten hoito: Avodart 0.5mg Dutasteride Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Avodart 0,5 mg on ja miten sitä käytetään?
Avodart 0,5 mg on reseptilääke, jota käytetään suurentuneen eturauhasen (benign Prostatic Hyperplasia) oireiden hoitoon. Avodartia voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Avodart 0,5 mg kuuluu lääkeryhmään, jota kutsutaan 5-alfa-reduktaasin estäjiksi.
Ei tiedetä, onko Avodart 0,5 mg turvallinen ja tehokas lapsille.
Mitkä ovat Avodartin sivuvaikutukset?
Avodart 0,5 mg:n sivuvaikutuksia ovat:
- nokkosihottuma,
- vaikeuksia hengittää,
- turvotus kasvoissasi tai kurkussasi,
- kuume,
- kipeä kurkku,
- palavat silmät,
- ihokipu ja
- punainen tai violetti ihottuma, johon liittyy rakkuloita ja hilseilyä
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Avodart 0,5 mg:n yleisimpiä sivuvaikutuksia ovat:
- alentunut libido (seksuaalihalu),
- vähentynyt seksin aikana vapautuva siemennestemäärä,
- impotenssi (erektion saaminen tai säilyttäminen) ja
- rintojen arkuus tai suureneminen
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Avodartin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
AVODART 0,5 mg on synteettinen 4-atsasteroidiyhdiste, joka on steroidi-5-alfa-reduktaasin, solunsisäisen entsyymin, joka muuttaa testosteronin DHT:ksi, sekä tyypin 1 että tyypin 2 isoformien selektiivinen estäjä.
Dutasteridi on kemiallisesti nimetty (5a,17p)-N-{2,5-bis(trifluorimetyyli)fenyyli}-3-okso-4-atsaandrost-1-eeni-17-karboksamidiksi. Dutasteridin empiirinen kaava on C27H30F6N2O2, joka edustaa molekyylipainoa 528,5 seuraavalla rakennekaavalla:
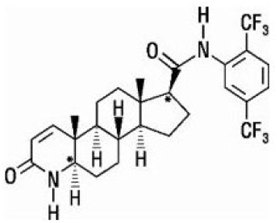
Dutasteridi on valkoisesta vaaleankeltaiseen jauheeseen, jonka sulamispiste on 242–250 °C. Se liukenee etanoliin (44 mg/ml), metanoliin (64 mg/ml) ja polyetyleeniglykoli 400:aan (3 mg/ml), mutta se on veteen liukenematon.
Jokainen AVODART 0,5 mg pehmeä gelatiinikapseli suun kautta annettuna sisältää 0,5 mg dutasteridia liuotettuna kapryyli/kapriinihapon ja butyloidun hydroksitolueenin mono-diglyseridien seokseen. Kapselin kuoren inaktiiviset apuaineet ovat rautaoksidi (keltainen), gelatiini (sertifioiduista BSE-vapaista naudan lähteistä), glyseriini ja titaanidioksidi. Pehmeät gelatiinikapselit on painettu syötävällä punaisella musteella.
INDIKAATIOT
Monoterapia
AVODART (dutasteridi) pehmeät gelatiinikapselit on tarkoitettu oireisen hyvänlaatuisen eturauhasen liikakasvun (BPH) hoitoon miehillä, joilla on suurentunut eturauhanen:
- parantaa oireita,
- vähentää akuutin virtsan pidättymisen (AUR) riskiä ja
- vähentää BPH:hen liittyvän leikkauksen tarpeen riskiä.
Yhdistelmä alfa-adrenergisen antagonistin kanssa
AVODART yhdessä alfa-adrenergisen antagonistin tamsulosiinin kanssa on tarkoitettu oireisen BPH:n hoitoon miehillä, joilla on suurentunut eturauhanen.
Käyttörajoitukset
AVODART 0,5 mg ei ole hyväksytty eturauhassyövän ehkäisyyn.
ANNOSTELU JA HALLINNOINTI
Kapselit tulee niellä kokonaisina, eikä niitä saa pureskella tai avata, koska kosketus kapselin sisällön kanssa voi aiheuttaa suunielun limakalvon ärsytystä. AVODART voidaan antaa ruoan kanssa tai ilman ruokaa.
Monoterapia
Suositeltu AVODART-annos on 1 kapseli (0,5 mg) kerran vuorokaudessa.
Yhdistelmä alfa-adrenergisen antagonistin kanssa
Suositeltu AVODART 0,5 mg -annos on 1 kapseli (0,5 mg) kerran vuorokaudessa ja tamsulosiini 0,4 mg kerran vuorokaudessa.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
0,5 mg:n läpinäkymättömät, himmeän keltaiset gelatiinikapselit, joiden toiselle puolelle on painettu punaisella musteella ”GX CE2”.
Varastointi ja käsittely
AVODART Pehmeät 0,5 mg:n gelatiinikapselit ovat pitkulaisia, läpinäkymättömiä, himmeän keltaisia, liivatekapseleita, joihin on painettu ”GX CE2” punaisella syötävällä musteella toisella puolella, ja ne on pakattu 30 ( NDC 0173-0712-15) ja 90 ( NDC 0173-0712-04) lapsiturvallisilla sulkimilla.
Säilytä 25°C (77°F); retket sallitaan 15° - 30°C (59° - 86°F) [katso USP-ohjattu huonelämpötila ].
Dutasteridi imeytyy ihon läpi. AVODART 0,5 mg kapseleita eivät saa käsitellä raskaana olevat naiset tai naiset, jotka voivat tulla raskaaksi, koska dutasteridi voi imeytyä ja aiheuttaa riskin kehittyvälle miessikiölle [ks. VAROITUKSET JA VAROTOIMET ].
Valmistettu: GlaxoSmithKline Research Triangle Park. Tarkistettu: tammikuu 2020
SIVUVAIKUTUKSET
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Kliinisistä tutkimuksista, joissa AVODART 0,5 mg monoterapiana tai yhdistelmänä tamsulosiinin kanssa:
- Yleisimmät haittavaikutukset, jotka raportoitiin AVODART 0,5 mg saaneilla potilailla, olivat impotenssi, heikentynyt libido, rintojen häiriöt (mukaan lukien rintojen suureneminen ja arkuus) ja siemensyöksyhäiriöt. Yleisimmät yhdistelmähoitoa (AVODART 0,5 mg plus tamsulosiini) saaneilla koehenkilöillä raportoidut haittavaikutukset olivat impotenssi, heikentynyt libido, rintojen häiriöt (mukaan lukien rintojen suureneminen ja arkuus), siemensyöksyhäiriöt ja huimaus. Ejakulaatiohäiriöitä esiintyi merkitsevästi enemmän yhdistelmähoitoa saaneilla (11 %) kuin niillä, jotka saivat AVODARTia (2 %) tai tamsulosiinia (4 %) monoterapiana.
- Lumekontrolloiduissa AVODART-tutkimuksissa tutkimus keskeytettiin haittavaikutuksista johtuen 4 %:lla potilaista, jotka saivat 0,5 mg AVODARTia ja 3 %:lla lumelääkettä saaneista potilaista. Yleisin tutkimuksen keskeyttämiseen johtanut haittavaikutus oli impotenssi (1 %).
- Yhdistelmähoitoa arvioivassa kliinisessä tutkimuksessa tutkimus keskeytettiin haittavaikutusten vuoksi 6 %:lla potilaista, jotka saivat yhdistelmähoitoa (AVODART plus tamsulosiini) ja 4 %:lla potilaista, jotka saivat AVODARTia 0,5 mg tai tamsulosiinia monoterapiana. Yleisin haittavaikutus kaikissa hoitoryhmissä, joka johti tutkimuksen keskeyttämiseen, oli erektiohäiriö (1–1,5 %).
Monoterapia
Yli 4 300 BPH:ta sairastavaa miespuolista koehenkilöä jaettiin satunnaisesti saamaan lumelääkettä tai 0,5 mg:n päivittäisiä AVODART-annoksia kolmessa identtisessä kaksivuotisessa lumekontrolloidussa kaksoissokkoutetussa vaiheen 3 hoitotutkimuksessa, joita seurasi 2 vuoden avoin tutkimus. laajennus. Kaksoissokkohoitojakson aikana 2 167 miespuolista henkilöä altistettiin AVODART 0,5 mg:lle, joista 1 772 altistui 1 vuoden ajan ja 1 510 2 vuoden ajan. Kun avoimia laajennuksia sisällytettiin, 1 009 miespuolista henkilöä altistettiin AVODART-annokselle 0,5 mg kolmen vuoden ajan ja 812 henkilöä neljän vuoden ajan. Väestö oli 47–94-vuotiaita (keski-ikä: 66 vuotta) ja yli 90 prosenttia oli valkoisia. Taulukossa 1 on yhteenveto kliinisistä haittavaikutuksista, jotka on raportoitu vähintään 1 %:lla AVODART-hoitoa saaneista potilaista, ja ilmaantuvuus oli suurempi kuin lumelääkettä saaneilla.
Pitkäaikainen hoito (jopa 4 vuotta)
Korkealaatuinen eturauhassyöpä
REDUCE-tutkimus oli satunnaistettu, kaksoissokkoutettu, lumekontrolloitu tutkimus, johon osallistui 8 231 50-75-vuotiasta miestä, joiden seerumin PSA oli 2,5 ng/ml - 10 ng/ml ja negatiivinen eturauhasen biopsia edellisten 6 kuukauden aikana. Koehenkilöt satunnaistettiin saamaan lumelääkettä (n = 4 126) tai 0,5 mg:n päivittäisiä AVODART-annoksia (n = 4 105) enintään 4 vuoden ajan. Keski-ikä oli 63 vuotta ja 91 % oli valkoisia. Koehenkilöille tehtiin protokollan mukaiset eturauhasen biopsiat 2 ja 4 vuoden hoidon jälkeen tai niille tehtiin "syistä johtuvat biopsiat" ei-sovitettuina aikoina, jos se oli kliinisesti aiheellista. Gleason-pisteet 8-10 eturauhassyöpää esiintyi enemmän AVODARTia saaneilla miehillä (1,0 %) verrattuna lumelääkettä saaneisiin miehiin (0,5 %) [ks. KÄYTTÖAIHEET JA KÄYTTÖ , VAROITUKSET JA VAROTOIMET ]. Seitsemän vuotta kestäneessä lumekontrolloidussa kliinisessä tutkimuksessa toisella 5-alfa-reduktaasi-inhibiittorilla (finasteridi 5 mg, PROSCAR) havaittiin samanlaisia tuloksia Gleason-pistemäärän 8-10 eturauhassyövän osalta (finasteridi 1,8 % vs. lumelääke 1,1 %).
Kliinistä hyötyä ei ole osoitettu AVODARTilla hoidetuilla eturauhassyöpäpotilailla.
Lisääntymis- ja rintasairaudet
Kolmessa keskeisessä plasebokontrolloidussa BPH-tutkimuksessa AVODARTilla 0,5 mg, kunkin neljän vuoden ajan, ei havaittu näyttöä lisääntyneistä seksuaalisista haittavaikutuksista (impotenssi, heikentynyt libido ja siemensyöksyhäiriö) tai rintojen häiriöistä hoidon keston pidentyessä. Näistä kolmesta tutkimuksesta yksi rintasyöpätapaus oli dutasteridiryhmässä ja yksi tapaus lumeryhmässä. Yhtään rintasyöpätapausta ei raportoitu missään hoitoryhmässä 4 vuotta kestäneessä CombAT- tai 4 vuoden REDUCE-tutkimuksessa.
Dutasteridin pitkäaikaisen käytön ja miehen rintaneoplasian välistä yhteyttä ei tällä hetkellä tunneta.
Yhdistelmä alfasalpaajahoidon kanssa (CombAT)
Yli 4800 miespuolista BPH-potilasta jaettiin satunnaisesti saamaan 0,5 mg AVODARTia 0,5 mg, 0,4 mg tamsulosiinia tai yhdistelmähoitoa (0,5 mg AVODARTia plus 0,4 mg tamsulosiinia) kerran päivässä 4 vuoden kaksoissokkotutkimuksessa. Kaiken kaikkiaan 1 623 potilasta sai monoterapiaa AVODARTilla; 1 611 henkilöä sai monoterapiaa tamsulosiinilla; ja 1 610 henkilöä sai yhdistelmähoitoa. Väestö oli iältään 49-88 vuotta (keski-ikä: 66 vuotta) ja 88 % oli valkoisia. Taulukossa 2 on yhteenveto haittavaikutuksista, joita ilmoitettiin vähintään 1 %:lla yhdistelmäryhmän potilaista, ja ilmaantuvuus oli suurempi kuin potilailla, jotka saivat monoterapiaa AVODART 0,5 mg:lla tai tamsulosiinilla.
Sydämen vajaatoiminta
CombAT:ssa 4 vuoden hoidon jälkeen yhdistelmätermi sydämen vajaatoiminnan ilmaantuvuus yhdistelmähoitoryhmässä (12/1 610; 0,7 %) oli suurempi kuin kummassakaan monoterapiaryhmässä: AVODART 0,5 mg, 2/1 623 (0,1 %) ja tamsulosiini, 9/1 611 (0,6 %). Yhdistelmäsydämen vajaatoimintaa tutkittiin myös erillisessä 4 vuotta kestäneessä lumekontrolloidussa tutkimuksessa, jossa arvioitiin AVODARTia miehillä, joilla oli riski saada eturauhassyöpä. Sydämen vajaatoiminnan ilmaantuvuus oli 0,6 % (26/4 105) potilailla, jotka saivat AVODARTia 0,5 mg, verrattuna 0,4 %:iin (15/4 126) lumelääkettä saaneilla. Suurimmalla osalla potilaista, joilla oli sydämen vajaatoiminta molemmissa tutkimuksissa, oli samanaikaisia sairauksia, jotka liittyivät suurempaan sydämen vajaatoiminnan riskiin. Siksi numeerisen epätasapainon kliinistä merkitystä sydämen vajaatoiminnassa ei tunneta. Syy-yhteyttä AVODARTin yksin tai tamsulosiinin kanssa yhdistettynä sydämen vajaatoiminnan välillä ei ole osoitettu. Kummassakaan tutkimuksessa ei havaittu epätasapainoa yleisten kardiovaskulaaristen haittatapahtumien ilmaantuvuudessa.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu AVODARTin hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen. Nämä reaktiot on valittu sisällytettäviksi niiden vakavuuden, ilmoitustiheyden tai mahdollisen syy-yhteyden AVODARTiin yhdistelmän vuoksi.
Immuunijärjestelmän häiriöt
Yliherkkyysreaktiot, mukaan lukien ihottuma, kutina, urtikaria, paikallinen turvotus, vakavat ihoreaktiot ja angioedeema.
Neoplasmat
Miehen rintasyöpä.
Psykiatriset häiriöt
Masentunut.
Lisääntymisjärjestelmän ja rintojen häiriöt
Kiveskipu ja kivesten turvotus.
HUUMEIDEN VUOROVAIKUTUKSET
Sytokromi P450 3A:n estäjät
Dutasteridi metaboloituu ihmisissä laajalti sytokromi P450 (CYP)3A4- ja CYP3A5-isoentsyymien vaikutuksesta. Voimakkaiden CYP3A4-estäjien vaikutusta dutasteridiin ei ole tutkittu. Mahdollisten lääkkeiden välisten yhteisvaikutusten vuoksi ole varovainen määrättäessä AVODARTia potilaille, jotka käyttävät voimakkaita, kroonisia CYP3A4-entsyymin estäjiä (esim. ritonaviiria) [ks. KLIININEN FARMAKOLOGIA ].
Alfa-adrenergiset antagonistit
AVODARTin anto yhdessä tamsulosiinin tai teratsosiinin kanssa ei vaikuta kummankaan alfa-adrenergisen antagonistin vakaan tilan farmakokinetiikkaan. Tamsulosiinin tai teratsosiinin annon vaikutusta dutasteridin farmakokineettisiin parametreihin ei ole arvioitu.
Kalsiumkanavan antagonistit
Verapamiilin tai diltiatseemin samanaikainen käyttö vähentää dutasteridin puhdistumaa ja lisää dutasteridialtistusta. Muutoksen dutasteridialtistuksessa ei pidetä kliinisesti merkittävänä. Annoksen muuttamista ei suositella [katso KLIININEN FARMAKOLOGIA ].
Kolestyramiini
Yhden 5 mg:n AVODARTin 0,5 mg:n kerta-annoksen ja 1 tunnin kuluttua 12 g:n kolestyramiinin antaminen ei vaikuta dutasteridin suhteelliseen hyötyosuuteen [ks. KLIININEN FARMAKOLOGIA ].
Digoksiini
AVODART 0,5 mg ei muuta digoksiinin vakaan tilan farmakokinetiikkaa, kun sitä annetaan samanaikaisesti annoksella 0,5 mg/vrk 3 viikon ajan [ks. KLIININEN FARMAKOLOGIA ].
Varfariini
AVODARTin 0,5 mg/vrk samanaikainen anto 3 viikon ajan varfariinin kanssa ei muuta S- tai R-varfariini-isomeerien vakaan tilan farmakokinetiikkaa eikä muuta varfariinin vaikutusta protrombiiniaikaan [ks. KLIININEN FARMAKOLOGIA ].
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Vaikutukset eturauhasspesifiseen antigeeniin (PSA) ja PSA:n käyttöön eturauhassyövän havaitsemisessa
Kliinisissä tutkimuksissa AVODART 0,5 mg alensi seerumin PSA-pitoisuutta noin 50 % 3-6 kuukauden kuluessa hoidon aloittamisesta. Tämä lasku oli ennustettavissa koko PSA-arvojen alueella potilailla, joilla oli oireinen BPH, vaikka se voi vaihdella yksilöillä. AVODART 0,5 mg voi myös aiheuttaa seerumin PSA:n laskua eturauhassyövän yhteydessä. AVODART 0,5 mg:aa käyttävien miesten PSA-sarjan tulkitsemiseksi uusi PSA-lähtötaso on määritettävä vähintään 3 kuukauden kuluttua hoidon aloittamisesta ja PSA-arvoa on seurattava säännöllisesti sen jälkeen. Kaikki vahvistettu nousu alimmasta PSA-arvosta AVODART-hoidon aikana voi olla merkki eturauhassyövän esiintymisestä, ja se on arvioitava, vaikka PSA-tasot olisivat edelleen normaalin alueen sisällä miehillä, jotka eivät käytä 5-alfareduktaasin estäjää. AVODARTin noudattamatta jättäminen voi myös vaikuttaa PSA-testin tuloksiin.
Erillisen PSA-arvon tulkitsemiseksi miehellä, jota on hoidettu AVODARTilla 0,5 mg vähintään 3 kuukautta, PSA-arvo tulee kaksinkertaistaa, jotta sitä voidaan verrata hoitamattomien miesten normaaleihin arvoihin. Vapaan kokonais-PSA:n suhde (prosentti vapaa PSA) pysyy vakiona jopa AVODARTin vaikutuksen alaisena. Jos lääkärit päättävät käyttää vapaan PSA:n prosenttiosuutta apuna eturauhassyövän havaitsemisessa AVODART-hoitoa saavilla miehillä, sen arvon muuttaminen ei näytä tarpeelliselta.
Dutasteridin ja tamsulosiinin samanaikainen käyttö johti samanlaisiin seerumin PSA-arvoihin kuin dutasteridimonoterapia.
Korkealaatuisen eturauhassyövän riski kasvaa
50–75-vuotiailla miehillä, joilla oli aiemmin negatiivinen eturauhassyövän biopsia ja joiden lähtötason PSA oli 2,5 ng/ml - 10,0 ng/ml ja jotka saivat AVODARTia 4 vuoden Reduction by Dutasteride of Prostate Cancer Events (REDUCE) -tutkimuksessa Gleason-pistemäärän 810 eturauhassyövän lisääntynyt ilmaantuvuus lumelääkettä saaneisiin miehiin verrattuna (AVODART 1,0 % vs. lumelääke 0,5 %) [ks. KÄYTTÖAIHEET JA KÄYTTÖ , HAITTAVAIKUTUKSET ]. Seitsemän vuotta kestäneessä lumekontrolloidussa kliinisessä tutkimuksessa toisella 5-alfa-reduktaasi-inhibiittorilla (finasteridi 5 mg, PROSCAR) havaittiin samanlaisia tuloksia Gleason-pistemäärän 8-10 eturauhassyövän osalta (finasteridi 1,8 % vs. lumelääke 1,1 %).
alfa-reduktaasin estäjät voivat lisätä korkea-asteisen eturauhassyövän riskiä. Ei ole varmistettu, vaikuttiko viiden alfareduktaasin estäjän vaikutus eturauhasen tilavuutta vähentäviin tekijöihin tai tutkimukseen liittyviin tekijöihin näiden tutkimusten tuloksiin.
Muiden urologisten sairauksien arviointi
Ennen AVODART 0,5 mg -hoidon aloittamista on otettava huomioon muut urologiset sairaudet, jotka voivat aiheuttaa samanlaisia oireita. Lisäksi BPH ja eturauhassyöpä voivat esiintyä rinnakkain.
AVODART 0,5 mg:n transdermaalinen altistuminen raskaana oleville naisille – riski miessikiölle
Raskaana olevat tai mahdollisesti raskaana olevat naiset eivät saa käsitellä AVODART-kapseleita. Dutasteridi voi imeytyä ihon läpi ja voi aiheuttaa tahattoman sikiön altistumisen ja mahdollisen riskin miessikiölle. Jos raskaana oleva nainen joutuu kosketuksiin vuotavien dutasteridikapseleiden kanssa, kosketusalue on pestävä välittömästi saippualla ja vedellä [ks. Käyttö tietyissä populaatioissa ]. Dutasteridi voi imeytyä ihon läpi eläinkokeiden perusteella [katso Ei-kliininen toksikologia ].
Veren luovutus
AVODART-hoitoa saavien miesten ei tule luovuttaa verta ennen kuin viimeisestä annoksesta on kulunut vähintään 6 kuukautta. Tämän lykätyn ajanjakson tarkoituksena on estää dutasteridin antaminen raskaana olevalle naiselle verensiirron vastaanottajalle.
Vaikutus siemennesteen ominaisuuksiin
Dutasteridin 0,5 mg/vrk vaikutuksia siemennesteen ominaisuuksiin arvioitiin terveillä miehillä 52 viikon hoidon ja 24 viikon hoidon jälkeisen seurannan ajan. Viikon 52 kohdalla lumelääkkeeseen verrattuna dutasteridihoito vähensi keskimäärin siittiöiden kokonaismäärää, siemennesteen tilavuutta ja siittiöiden liikkuvuutta; vaikutukset siittiöiden kokonaismäärään eivät olleet palautuvia 24 viikon seurannan jälkeen. Siittiöiden konsentraatio ja siittiöiden morfologia eivät muuttuneet, ja kaikkien siemennesteen parametrien keskiarvot pysyivät normaaleissa rajoissa kaikissa aikapisteissä. Dutasteridin vaikutuksen kliinistä merkitystä siemennesteen ominaisuuksiin yksittäisen potilaan hedelmällisyyteen ei tunneta [ks. Käyttö tietyissä populaatioissa ].
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( POTILASTIEDOT ).
PSA-valvonta
Kerro potilaille, että AVODART alentaa seerumin PSA-tasoja noin 50 % 3–6 kuukauden kuluessa hoidon aloittamisesta, vaikka se voi vaihdella yksilöllisesti. PSA-seulonnan saaville potilaille PSA-tason nousu AVODART-hoidon aikana voi olla merkki eturauhassyövän olemassaolosta, ja terveydenhuollon tarjoajan tulee arvioida se [ks. VAROITUKSET JA VAROTOIMET ].
Korkealaatuisen eturauhassyövän riski kasvaa
Kerro potilaille, että korkea-asteinen eturauhassyöpä lisääntyi miehillä, joita hoidettiin viidellä alfareduktaasin estäjää (jotka on tarkoitettu BPH-hoitoon), mukaan lukien AVODART 0,5 mg, verrattuna lumelääkettä saaneisiin tutkimuksiin, joissa tarkasteltiin näiden lääkkeiden käyttöä. lääkkeet vähentämään eturauhassyövän riskiä [katso KÄYTTÖAIHEET JA KÄYTTÖ , VAROITUKSET JA VAROTOIMET , HAITTAVAIKUTUKSET ].
AVODARTin transdermaalinen altistuminen raskaana oleville tai mahdollisesti raskaana oleville naisille – riski miessikiölle
Kerro potilaille, että raskaana olevat tai mahdollisesti raskaana olevat naiset eivät saa käsitellä AVODART 0,5 mg -kapseleita, koska dutasteridi voi imeytyä ja aiheuttaa riskin kehittyvälle miessikiölle. Dutasteridi voi imeytyä ihon läpi ja aiheuttaa tahattoman sikiön altistumisen. Jos raskaana oleva tai mahdollisesti raskaana oleva nainen joutuu kosketuksiin vuotavien AVODART 0,5 mg -kapseleiden kanssa, kosketusalue on pestävä välittömästi saippualla ja vedellä [ks. VAROITUKSET JA VAROTOIMET , Käyttö tietyissä populaatioissa ].
Vaikutukset siemennesteen parametreihin
Kerro miehille, että AVODART 0,5 mg voi vaikuttaa siittiöiden ominaisuuksiin, mutta vaikutusta hedelmällisyyteen ei tunneta [ks. VAROITUKSET JA VAROTOIMET , Käyttö tietyissä populaatioissa ].
Veren luovutus
Kerro AVODART 0,5 mg:lla hoidetuille miehille, että heidän ei pitäisi luovuttaa verta ennen kuin vähintään 6 kuukautta viimeisen annoksen jälkeen, jotta raskaana olevat naiset eivät saa dutasteridia verensiirron kautta [ks. VAROITUKSET JA VAROTOIMET ]. Seerumin dutasteridipitoisuudet ovat havaittavissa 4-6 kuukauden ajan hoidon päättymisen jälkeen [katso KLIININEN FARMAKOLOGIA ].
AVODART on GSK-yritysryhmän omistama tai sille lisensoitu tavaramerkki.
Muut luetellut tuotemerkit ovat omistajiensa omistamia tai niille lisensoituja tavaramerkkejä, eivätkä ne ole GSK-yritysryhmän omistuksessa tai niille lisensoituja. Näiden merkkien valmistajat eivät ole sidoksissa GSK-yritysryhmään tai sen tuotteisiin eivätkä tue sitä.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeneesi
Kahden vuoden karsinogeenisuustutkimus suoritettiin B6C3F1-hiirillä annoksilla 3, 35, 250 ja 500 mg/kg/vrk uroksilla ja 3, 35 ja 250 mg/kg/vrk naarailla; hyvänlaatuisten hepatosellulaaristen adenoomien lisääntynyt ilmaantuvuus havaittiin annoksella 250 mg/kg/vrk (290 kertaa MRHD 0,5 mg:n vuorokausiannoksella) vain naarashiirillä. Kaksi kolmesta tärkeimmistä ihmisen metaboliitista on havaittu hiirissä. Altistuminen näille metaboliiteille hiirillä on joko pienempi kuin ihmisillä tai sitä ei tunneta.
Han Wistar -rotilla tehdyssä kaksivuotisessa karsinogeenisuustutkimuksessa urosten annoksilla 1,5, 7,5 ja 53 mg/kg/vrk ja naarailla 0,8, 6,3 ja 15 mg/kg/vrk Leydig-solujen määrä lisääntyi. adenoomat kiveksissä 135-kertaisella MRHD:llä (53 mg/kg/vrk ja enemmän). Leydig-solujen liikakasvun ilmaantuvuus lisääntyi 52-kertaisella MRHD:llä (urosrotille annokset 7,5 mg/kg/vrk tai enemmän). Positiivinen korrelaatio Leydig-solujen proliferatiivisten muutosten ja verenkierron luteinisoivan hormonin tason nousun välillä on osoitettu käytettäessä 5 alfa-reduktaasin estäjää, ja se on yhdenmukainen hypotalamus-aivolisäke-kives-akseliin kohdistuvan vaikutuksen kanssa 5-alfa-reduktaasin eston jälkeen. Tuumoreita aiheuttavilla annoksilla luteinisoivan hormonin tasot nousivat rotilla 167 %. Tässä tutkimuksessa tärkeimpien ihmisen metaboliittien karsinogeenisuus testattiin noin 1-3 kertaa odotettuun kliiniseen altistukseen verrattuna.
Mutageneesi
Dutasteridin genotoksisuus testattiin bakteerimutageneesimäärityksessä (Ames-testi), kromosomipoikkeavuusmäärityksessä kiinanhamsterin munasarjasoluissa ja mikrotumamäärityksessä rotilla. Tulokset eivät osoittaneet emolääkkeen genotoksisuutta. Kaksi tärkeintä ihmisen metaboliittia olivat myös negatiivisia joko Amesin testissä tai lyhennetyssä Amesin testissä.
Hedelmällisyyden heikkeneminen
Sukukypsien urosrottien hoito dutasteridilla 0,1-kertaisella MRHD:llä (eläinannokset 0,05 mg/kg/vrk tai enemmän enintään 31 viikon ajan) keskimääräisen seerumipitoisuuden perusteella johti annoksesta ja ajasta riippuvaiseen hedelmällisyyden laskuun kaikilla annoksilla ; vähentynyt cauda epididymal (absoluuttinen) siittiöiden määrä, mutta ei siittiöiden pitoisuus (annoksilla 50 ja 500 mg/kg/vrk); lisäkiveksen, eturauhasen ja siemenrakkuloiden painon pieneneminen; ja mikroskooppiset muutokset (tubulusepiteelin sytoplasminen vakuolaatio lisäkiveksissä ja/tai epiteelin vähentynyt sytoplasminen pitoisuus, mikä vastaa eturauhasen ja siemenrakkuloiden vähentynyttä eritysaktiivisuutta) lisääntymiselimissä kaikilla annoksilla ilman isälle aiheutuvaa toksisuutta. Hedelmällisyysvaikutukset kumoutuivat toipumisviikolla 6 kaikilla annoksilla, ja siittiöiden määrät olivat normaalit 14 viikon toipumisjakson lopussa. Mikroskooppisia muutoksia ei enää ollut toipumisviikolla 14 0,1-kertaisella MRHD:llä ja ne palautuivat osittain muissa hoitoryhmissä. Alhaisia dutasteridipitoisuuksia (0,6 - 17 ng/ml) havaittiin hoitamattomien naarasrottien seerumissa, jotka parittelivat hoidettujen urosrottien kanssa (10 - 500 mg/kg/vrk 29 - 30 viikon ajan), mikä on 16 - 110 kertaa MRHD. keskimääräinen seerumipitoisuus. Hoitamattomien naarasrottien urospuolisissa jälkeläisissä, jotka parittelivat hoidettujen urosrottien kanssa, ei esiintynyt feminisaatiota, vaikka naarasrotilla havaittiin havaittavia dutasteridipitoisuuksia veressä.
Naarasrotilla tehdyssä hedelmällisyystutkimuksessa annoksella 4 viikkoa ennen parittelua varhaiseen tiineyteen asti dutasteridin oraalinen antaminen annoksilla 0,05, 2,5, 12,5 ja 30 mg/kg/vrk johti pentueen koon pienenemiseen lisääntyneen resorption ja feminisoitumisen vuoksi. urossikiöiden sikiöistä (pienentynyt anogenitaalinen etäisyys) 2–10 kertaa MRHD (eläinannokset 2,5 mg/kg/vrk tai suurempi) keskimääräisen seerumin pitoisuuden perusteella, kun emolle on toksisia vaikutuksia (kehon painon nousun vähentyminen). Sikiön painot laskivat myös noin 0,02 kertaa MRHD:tä (rotan annos 0,05 mg/kg/vrk tai suurempi) keskimääräisen seerumipitoisuuden perusteella, ilman vaikutusta, ilman emolle toksisuutta.
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
AVODART 0,5 mg on vasta-aiheinen raskauden aikana, koska se voi vahingoittaa miespuolista sikiötä [ks. VASTA-AIHEET ]. AVODARTia ei ole tarkoitettu käytettäväksi naisilla.
AVODART 0,5 mg on 5-alfa-reduktaasin estäjä, joka estää testosteronin muuttumisen dihydrotestosteroniksi (DHT), hormoniksi, joka on välttämätön miesten sukupuolielinten normaalille kehitykselle. Poikkeavuudet miessikiöiden sukupuolielimissä on odotettu fysiologinen seuraus tämän muuntumisen estymisestä. Nämä tulokset ovat samanlaisia kuin havainnot miespuolisilla vauvoilla, joilla on geneettinen 5-alfa-reduktaasin puutos.
Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2–4 prosenttia ja 15–20 prosenttia.
Eläinten lisääntymistutkimuksissa dutasteridi esti ulkoisten sukuelinten normaalia kehitystä urospuolisilla jälkeläisillä, kun sitä annettiin rotille tai kaniineille organogeneesin aikana alle ihmiselle suositeltua enimmäisannostusta (MRHD) 0,5 mg vuorokaudessa ilman emolle toksisuutta. Kun MRHD oli 15-kertainen, rotilla havaittiin pitkittynyttä raskautta, vähentynyttä lisääntymiselinten painoa ja viivästynyttä murrosikää urospuolisilla jälkeläisillä, ja vaikutuksettomat tasot olivat alle MRHD:n 0,5 mg päivässä. Kaneilla havaittiin myös istukan painon nousua, ja vaikutuksettomat tasot olivat alle MRHD:n 0,5 mg päivässä (ks. Data ).
Vaikka dutasteridi erittyy ihmisen siemennesteeseen, lääkeainepitoisuus naispuolisessa ihmiskumppanissa on noin 100 kertaa pienempi kuin pitoisuudet, jotka aiheuttavat poikkeavuuksia miehen sukupuolielimissä eläinkokeissa (ks. Data ). Apinoilla, joille annosteltiin organogeneesin aikana veren pitoisuuksia, jotka olivat verrattavissa tai suuremmat kuin naispuolisen ihmiskumppanin arvioidaan altistuvan, urospuolisten jälkeläisten ulkoisiin sukuelimiin ei kohdistunut haitallisia vaikutuksia. Hoitamattomien naarasrottien urospuolisissa jälkeläisissä, jotka parittelivat hoidettujen urosrottien kanssa, ei feminisoitumista tapahtunut, vaikka naarasrotilla havaittiin havaittavia dutasteridipitoisuuksia veressä [ks. Ei-kliininen toksikologia ].
Data
Ihmistiedot
Korkein mitattu dutasteridin siemennestepitoisuus hoidetuilla miehillä oli 14 ng/ml. Vaikka dutasteridia havaitaan siemennesteessä, olettaen, että 50 kg painava nainen altistuu 5 ml:lle siemennestettä ja imeytyy 100 %:sti, naisen odotettu dutasteridipitoisuus veressä siemennesteen läpi olisi noin 0,0175 ng/ml. Tämä pitoisuus on noin 100 kertaa pienempi kuin veren pitoisuudet, jotka aiheuttavat poikkeavuuksia miesten sukupuolielimissä eläinkokeissa. Dutasteridi sitoutuu voimakkaasti ihmisen siemennesteen proteiineihin (yli 96 %), mikä saattaa vähentää emättimeen imeytyvään dutasteridin määrää.
Eläinten tiedot
Rotilla tehdyssä alkion ja sikiön kehitystutkimuksessa dutasteridin oraalinen antaminen 10 kertaa pienemmällä annoksella kuin MRHD 0,5 mg päivässä (perustuen miesten keskimääräisiin veren pitoisuuksiin) johti sikiön miehen sukupuolielinten feminisoitumiseen (pienensi anogenitaalinen etäisyys 0,05 mg:lla). /kg/vrk, vaikutukseton tason puuttuessa) ilman emolle toksisuutta. Lisäksi nännin kehittymistä, hypospadioita ja esinahkarauhasten laajentumista esiintyi emojen sikiöillä, joita hoidettiin annoksilla 2,5 mg/kg/vrk tai suuremmilla annoksilla (noin 15 kertaa MRHD). Sikiön painon alenemista ja siihen liittyvää viivästynyttä luutumista havaittiin äidin toksisuuden (kehon painon nousun vähentymisen) yhteydessä, kun äidin altistuminen oli noin 15 kertaa MRHD (annos 2,5 mg/kg/vrk tai suurempi). Kuolleena syntyneiden pentujen määrä lisääntyi emoilla, joita hoidettiin annoksella 30 mg/kg/vrk (noin 111 kertaa MRHD) ja vaikutuksettoman tason ollessa 12,5 mg/kg/vrk.
Kanin alkion ja sikiön kehitystutkimuksessa annettiin suun kautta 28-kertaisia annoksia MRHD:tä (30 mg/kg/vrk tai enemmän) miesten keskimääräisten veren pitoisuuksien perusteella tiineyspäivinä 7–29 (organogeneesin aikana ja myöhään). ulkoisten sukupuolielinten kehitysvaihe). Sikiöiden sukupuolielinten papillan histologinen arviointi paljasti todisteita urossikiön feminisoitumisesta sekä kallon fuusioitumisesta ja istukan painon kasvusta kaikilla annoksilla ilman äidille kohdistuvaa toksisuutta. Toinen alkion ja sikiön kehitystutkimus kaneilla, joille annosteltiin koko raskauden ajan (organogeneesi ja myöhempi ulkoisten sukupuolielinten kehitysvaihe [raskauspäivät 6–29]) 0,3 kertaa MRHD (annokset 0,05 mg/kg/vrk tai suuremmat, ilman vaikutuksen taso), tuotti myös näyttöä miespuolisten sikiöiden sukuelinten feminisoitumisesta ja istukan painon lisääntymisestä kaikilla annoksilla ilman emolle toksisuutta.
Alkion ja sikiön kehitystutkimuksessa raskaana olevat reesusapinat altistettiin suonensisäisesti organogeneesin aikana (raskauspäivät 20–100) veren dutasteridipitoisuudelle, joka oli verrattavissa naispuolisen ihmisen arvioituun dutasteridialtistukseen tai sitä korkeammalle. Dutasteridia annettiin raskauspäivinä 20-100 (organogeneesin aikana) annoksina 400, 780, 1 325 tai 2 010 ng/vrk (12 apinaa/ryhmä). Apinoiden jälkeläisten urospuolisten ulkoisten sukuelinten feminisoitumista ei havaittu. Sikiön lisämunuaisten painon pienenemistä, sikiön eturauhasen painon laskua ja sikiön munasarjojen ja kivesten painon nousua havaittiin suurimmalla testatulla annoksella. Perustuen korkeimpaan mitattuun dutasteridin siemennesteen konsentraatioon hoidetuilla miehillä (14 ng/ml), nämä annokset apinoilla edustavat jopa 16 kertaa 50 kg painavan naaraan mahdollista maksimialtistusta 5 ml:lle siemennestettä päivittäin dutasteridi- hoidetuista miehistä olettaen 100 %:n imeytymisen. Tässä tutkimuksessa apinoille annetut annostasot (ng/kg perusteella) ovat 32-186 kertaa nimellisannos (ng/kg), jolle naaras mahdollisesti altistuisi siemennesteen kautta. Ei tiedetä, tuottavatko kanit tai reesusapinat ihmisen tärkeimpiä metaboliitteja.
Suun kautta suoritetussa pre- ja postnataalisessa kehitystutkimuksessa rotilla havaittiin urospuolisten sukuelinten feminisoitumista. Pienempi anogenitaalinen etäisyys havaittiin 0,05-kertaisella MRHD:llä ja suuremmalla (0,05 mg/kg/vrk ja enemmän) ilman vaikutuksetonta tasoa, joka perustui miesten keskimääräisiin veren tasoihin AUC-arviona. Hypospadioita ja nännin kehittymistä havaittiin annoksella 2,5 mg/kg/vrk tai suuremmalla (14 kertaa MRHD tai suurempi, ei-vaikutustasolla 0,05 mg/kg/vrk). Annokset 2,5 mg/kg/vrk ja sitä suuremmat johtivat myös tiineyden pitkittymiseen vanhempana olevilla naarailla, urospuolisilla jälkeläisillä pidentyneeseen esinahkaan erottumiseen kuluvaan aikaan, naaraspuolisten jälkeläisten emättimen aukon lyhenemiseen sekä eturauhasen ja siemenrakkuloiden painot urospuolisilla jälkeläisillä. Lisääntynyt kuolleena syntyvyys ja heikentynyt vastasyntyneiden elinkelpoisuus jälkeläisillä havaittiin annoksella 30 mg/kg/vrk (102 kertaa MRHD emomyrkyllisyyden läsnä ollessa [painon lasku]).
Imetys
Riskien yhteenveto
AVODARTia ei ole tarkoitettu käytettäväksi naisilla. Dutasteridin esiintymisestä äidinmaidossa, vaikutuksista imetettävään lapseen tai vaikutuksista maidontuotantoon ei ole saatavilla tietoa.
Naaraat ja urokset, joilla on lisääntymispotentiaali
Hedelmättömyys
Miehet
Dutasteridin 0,5 mg/vrk vaikutuksia siemennesteen ominaisuuksiin arvioitiin 18–52-vuotiailla normaaleilla vapaaehtoisilla (n = 27 dutasteridi, n = 23 lumelääke) 52 viikon hoidon ja 24 viikon hoidon jälkeisen seurannan ajan. Viikon 52 kohdalla siittiöiden kokonaismäärän, siemennesteen tilavuuden ja siittiöiden liikkuvuuden keskimääräiset prosentuaaliset laskut lähtötilanteesta olivat 23 %, 26 % ja 18 % dutasteridiryhmässä, kun oikaistiin lumelääkeryhmässä lähtötilanteeseen verrattuna. Siittiöiden konsentraatio ja siittiöiden morfologia eivät muuttuneet. 24 viikon seurannan jälkeen keskimääräinen prosentuaalinen muutos siittiöiden kokonaismäärässä dutasteridiryhmässä pysyi 23 % alhaisempi kuin lähtötaso. Vaikka kaikkien siemennesteen parametrien keskiarvot pysyivät kaikissa aikapisteissä normaaleissa rajoissa eivätkä vastanneet kliinisesti merkitsevän muutoksen ennalta määritettyjä kriteerejä (30 %), kahdella dutasteridiryhmässä siittiöiden määrä laski yli 90 % lähtötasosta. 52 viikkoa, osittain toipuminen 24 viikon seurannassa. Dutasteridin vaikutuksen kliinistä merkitystä siemennesteen ominaisuuksiin yksittäisen potilaan hedelmällisyyteen ei tunneta [ks. VAROITUKSET JA VAROTOIMET ].
Käyttö lapsille
AVODART 0,5 mg ei ole tarkoitettu käytettäväksi lapsipotilailla. Turvallisuutta ja tehokkuutta lapsipotilailla ei ole osoitettu.
Geriatrinen käyttö
Kolmessa kliinisessä tutkimuksessa 2 167 miespuolisesta koehenkilöstä, joita hoidettiin AVODARTilla 0,5 mg, 60 % oli vähintään 65-vuotiaita ja 15 % vähintään 75-vuotiaita. Näiden ja nuorempien koehenkilöiden välillä ei havaittu yleisiä eroja turvallisuudessa tai tehossa. Muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa, mutta joidenkin vanhempien henkilöiden suurempaa herkkyyttä ei voida sulkea pois [ks. KLIININEN FARMAKOLOGIA ].
Munuaisten vajaatoiminta
AVODART 0,5 mg:n annosta ei tarvitse muuttaa potilailla, joilla on munuaisten vajaatoiminta (ks KLIININEN FARMAKOLOGIA ].
Maksan vajaatoiminta
Maksan vajaatoiminnan vaikutusta dutasteridin farmakokinetiikkaan ei ole tutkittu. Koska dutasteridi metaboloituu laajalti, altistuminen voi olla suurempi maksan vajaatoimintapotilailla. Kliinisessä tutkimuksessa, jossa 60 koehenkilöä sai 5 mg (10 kertaa terapeuttinen annos) päivittäin 24 viikon ajan, ei kuitenkaan havaittu ylimääräisiä haittavaikutuksia verrattuna niihin, jotka havaittiin terapeuttisella annoksella 0,5 mg [ks. KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
Vapaaehtoisilla tehdyissä tutkimuksissa on annettu kerta-annoksia dutasteridia aina 40 mg:aan asti (80 kertaa terapeuttinen annos) 7 päivän ajan ilman merkittäviä turvallisuusongelmia. Kliinisessä tutkimuksessa 5 mg:n päivittäisiä annoksia (10-kertainen terapeuttinen annos) annettiin 60 koehenkilölle 6 kuukauden ajan ilman muita haittavaikutuksia kuin terapeuttisilla 0,5 mg:n annoksilla.
Dutasteridille ei ole spesifistä vastalääkettä. Siksi yliannostustapauksissa tulee antaa oireenmukaista ja tukevaa hoitoa tarvittaessa ottaen huomioon dutasteridin pitkä puoliintumisaika.
VASTA-AIHEET
AVODART 0,5mg on vasta-aiheinen seuraavissa tapauksissa:

- Raskaus. Dutasteridin käyttö on vasta-aiheista raskaana oleville naisille. Eläinten lisääntymis- ja kehitystoksisuustutkimuksissa dutasteridi esti urossikiön ulkoisten sukupuolielinten kehitystä. Siksi AVODART 0,5 mg voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle [ks. VAROITUKSET JA VAROTOIMET , Käyttö tietyissä populaatioissa ].
- Potilaat, joilla on aiemmin osoitettu kliinisesti merkittävää yliherkkyyttä (esim. vakavat ihoreaktiot, angioedeema) AVODARTille tai muille 5-alfa-reduktaasin estäjille (ks. HAITTAVAIKUTUKSET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Dutasteridi estää testosteronin muuttumista DHT:ksi. DHT on androgeeni, joka on ensisijaisesti vastuussa eturauhasen alkukehityksestä ja myöhemmästä laajentumisesta. Testosteroni muuntaa DHT:ksi 5-alfa-reduktaasientsyymin toimesta, joka esiintyy kahtena isoformina, tyyppi 1 ja tyyppi 2. Tyypin 2 isoentsyymi on aktiivinen ensisijaisesti lisääntymiskudoksissa, kun taas tyypin 1 isoentsyymi on vastuussa myös testosteronin konversiosta iho ja maksa.
Dutasteridi on kilpaileva ja spesifinen sekä tyypin 1 että tyypin 2 5-alfa-reduktaasi-isoentsyymien estäjä, jonka kanssa se muodostaa stabiilin entsyymikompleksin. Dissosiaatio tästä kompleksista on arvioitu in vitro ja in vivo -olosuhteissa, ja se on erittäin hidasta. Dutasteridi ei sitoudu ihmisen androgeenireseptoriin.
Farmakodynamiikka
Vaikutus 5-alfa-dihydrotestosteroniin ja testosteroniin
Päivittäisten dutasteridin annosten maksimivaikutus DHT:n vähentämiseen on annoksesta riippuvainen ja havaitaan 1–2 viikon kuluessa. 1 ja 2 viikon päivittäisen 0,5 mg:n dutasteridiannoksen jälkeen seerumin DHT-pitoisuuden mediaani pieneni 85 % ja 90 %. BPH-potilailla, joita hoidettiin dutasteridilla 0,5 mg/vrk 4 vuoden ajan, seerumin DHT:n vähenemisen mediaani oli 94 % 1 vuoden kohdalla, 93 % 2 vuoden kohdalla ja 95 % sekä 3 että 4 vuoden kohdalla. Seerumin testosteronin nousun mediaani oli 19 % sekä 1 että 2 vuoden kohdalla, 26 % 3 vuoden kohdalla ja 22 % 4 vuoden kohdalla, mutta keskimääräinen ja mediaanitaso pysyivät fysiologisella alueella.
BPH-potilailla, joita hoidettiin annoksella 5 mg/vrk dutasteridia tai lumelääkettä enintään 12 viikon ajan ennen eturauhasen transuretraalista resektiota, keskimääräiset DHT-pitoisuudet eturauhaskudoksessa olivat merkittävästi alhaisemmat dutasteridiryhmässä verrattuna lumelääkkeeseen (784 ja 5793 pg/g). P
Aikuisilla miehillä, joilla on geneettisesti perinnöllinen tyypin 2 5-alfa-reduktaasin puutos, on myös alentuneet DHT-tasot. Näillä viidellä alfareduktaasipuutteellisella miehellä on pieni eturauhanen koko elämänsä ajan, eivätkä he kehitä BPH:ta. Näillä henkilöillä ei ole havaittu muita 5-alfa-reduktaasin puutteeseen liittyviä kliinisiä poikkeavuuksia lukuun ottamatta syntymässä esiintyviä urogenitaalivaurioita.
Vaikutukset muihin hormoneihin
Terveillä vapaaehtoisilla 52 viikon hoito dutasteridilla 0,5 mg/vrk (n = 26) ei aiheuttanut kliinisesti merkitseviä muutoksia plaseboon verrattuna (n = 23) sukupuolihormoneja sitovan globuliinin, estradiolin, luteinisoivan hormonin, follikkelia stimuloivan hormonin, tyroksiini (vapaa T4) ja dehydroepiandrosteroni. Tilastollisesti merkitsevä, lähtötasoon mukautettu keskimääräinen nousu lumelääkkeeseen verrattuna havaittiin kokonaistestosteronissa 8. viikolla (97,1 ng/dl, P
Muut tehosteet
Plasman lipidipaneeli ja luun mineraalitiheys arvioitiin 52 viikon dutasteridin 0,5 mg kerran vuorokaudessa jälkeen terveillä vapaaehtoisilla. Luun mineraalitiheys ei muuttunut kaksoisenergiaröntgenabsorptiometrialla mitattuna lumelääkkeeseen tai lähtötasoon verrattuna. Lisäksi dutasteridi ei vaikuttanut plasman lipidiprofiiliin (eli kokonaiskolesteroliin, matalatiheyksiset lipoproteiinit, korkeatiheyksiset lipoproteiinit, triglyseridit). Kliinisesti merkittäviä muutoksia lisämunuaisen hormonivasteissa adrenokortikotrooppisen hormonin (ACTH) stimulaatioon ei havaittu alaryhmässä (n = 13) 1 vuoden terveiden vapaaehtoisten tutkimuksessa.
Farmakokinetiikka
Imeytyminen
Pehmeän gelatiinikapselin 0,5 mg:n kerta-annoksen jälkeen dutasteridin seerumin huippupitoisuuksien (Tmax) saavuttamiseen kuluu 2–3 tuntia. Absoluuttinen hyötyosuus viidellä terveellä henkilöllä on noin 60 % (vaihteluväli: 40 % - 94 %). Kun lääkettä annettiin ruoan kanssa, seerumin maksimipitoisuudet laskivat 10–15 %. Tällä vähennyksellä ei ole kliinistä merkitystä.
Jakelu
Farmakokineettiset tiedot kerta-annosten ja toistuvien oraalisten annosten jälkeen osoittavat, että dutasteridin jakautumistilavuus on suuri (300-500 l). Dutasteridi sitoutuu voimakkaasti plasman albumiiniin (99,0 %) ja happamaan alfa-1-glykoproteiiniin (96,6 %).
Terveillä koehenkilöillä (n = 26) tehdyssä tutkimuksessa, joka sai dutasteridia 0,5 mg/vrk 12 kuukauden ajan, siemennesteen dutasteridipitoisuudet olivat keskimäärin 3,4 ng/ml (vaihteluväli: 0,4-14 ng/ml) 12 kuukauden kohdalla ja, kuten seerumissa, saavutettiin vakaana. -valtiopitoisuudet 6 kuukauden kohdalla. Keskimäärin 12 kuukauden kohdalla 11,5 % seerumin dutasteridipitoisuuksista jakautui siemennesteeseen.
Aineenvaihdunta ja eliminaatio
Dutasteridi metaboloituu laajalti ihmisissä. In vitro -tutkimukset osoittivat, että dutasteridi metaboloituu CYP3A4- ja CYP3A5-isoentsyymien vaikutuksesta. Molemmat näistä isoentsyymeistä tuottivat 4'-hydroksidutasteridi-, 6-hydroksidutasteridi- ja 6,4'-dihydroksidutasteridimetaboliitit. Lisäksi CYP3A4 muodosti 15-hydroksidutasteridimetaboliitin. Dutasteridi ei metaboloidu in vitro ihmisen sytokromi P450:n isoentsyymien CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 ja CYP2E1 toimesta. Ihmisen seerumissa vakaan tilan saavuttamisen jälkeen muuttumatonta dutasteridia, 3 päämetaboliittia (4'-hydroksidutasteridi, 1,2-dihydrodutasteridi ja 6-hydroksidutasteridi) ja 2 vähäistä metaboliittia (6,4'-dihydroksidiutasteridi ja 15) -hydroksidutasteridi), on havaittu massaspektrometrisellä vasteella. Asemissa 6 ja 15 olevien hydroksyylilisäysten absoluuttista stereokemiaa ei tunneta. In vitro 4'-hydroksidutasteridi ja 1,2-dihydrodutasteridi metaboliitit ovat paljon vähemmän tehokkaita kuin dutasteridi molempia ihmisen 5-alfa-reduktaasin isoformeja vastaan. 6β-hydroksidutasteridin aktiivisuus on verrattavissa dutasteridin aktiivisuuteen.
Dutasteridi ja sen metaboliitit erittyivät pääasiassa ulosteisiin. Prosentteina annoksesta oli noin 5 % muuttumatonta dutasteridia (~1 % - ~15 %) ja 40 % dutasteridiin liittyviä metaboliitteja (~2 % - ~90 %). Virtsasta löydettiin vain pieniä määriä muuttumatonta dutasteridia (
Dutasteridin terminaalinen eliminaation puoliintumisaika vakaassa tilassa on noin 5 viikkoa. Keskimääräinen vakaan tilan seerumin dutasteridipitoisuus oli 40 ng/ml 0,5 mg/vrk yhden vuoden ajan. Päivittäisen annostelun jälkeen seerumin dutasteridipitoisuudet saavuttavat 65 % vakaan tilan pitoisuudesta 1 kuukauden kuluttua ja noin 90 % 3 kuukauden kuluttua. Dutasteridin pitkän puoliintumisajan vuoksi seerumipitoisuudet pysyvät havaittavissa (yli 0,1 ng/ml) jopa 4-6 kuukautta hoidon lopettamisen jälkeen.
Tietyt populaatiot
Pediatriset potilaat
Dutasteridin farmakokinetiikkaa ei ole tutkittu alle 18-vuotiailla.
Geriatriset potilaat
Annosta ei tarvitse muuttaa vanhuksilla. Dutasteridin farmakokinetiikkaa ja farmakodynamiikkaa arvioitiin 36 terveellä miespuolisella koehenkilöllä, jotka olivat iältään 24–87 vuotta, 5 mg:n kerta-annoksen jälkeen. Tässä kerta-annostutkimuksessa dutasteridin puoliintumisaika piteni iän myötä (noin 170 tuntia 20–49-vuotiailla miehillä, noin 260 tuntia 50–69-vuotiailla miehillä ja noin 300 tuntia yli 70-vuotiailla miehillä). Kolmessa keskeisessä tutkimuksessa dutasteridilla hoidetuista 2 167 miehestä 60 % oli vähintään 65-vuotiaita ja 15 % 75-vuotiaita tai vanhempia. Näiden potilaiden ja nuorempien potilaiden välillä ei havaittu yleisiä eroja turvallisuudessa tai tehossa.
Mies- ja naispotilaat
AVODART on vasta-aiheinen raskauden aikana, eikä sitä ole tarkoitettu käytettäväksi naisilla [katso VASTA-AIHEET , VAROITUKSET JA VAROTOIMET ]. Dutasteridin farmakokinetiikkaa naisilla ei ole tutkittu.
Rotu- ja etniset ryhmät
Rodun vaikutusta dutasteridin farmakokinetiikkaan ei ole tutkittu.
Potilaat, joilla on munuaisten vajaatoiminta
Munuaisten vajaatoiminnan vaikutusta dutasteridin farmakokinetiikkaan ei ole tutkittu. Kuitenkin alle 0,1 % vakaan tilan 0,5 mg:n dutasteridiannoksesta erittyy ihmisen virtsaan, joten munuaisten vajaatoimintaa sairastavien potilaiden annostusta ei ole odotettavissa.
Potilaat, joilla on maksan vajaatoiminta
Maksan vajaatoiminnan vaikutusta dutasteridin farmakokinetiikkaan ei ole tutkittu. Koska dutasteridi metaboloituu laajalti, altistuminen voi olla suurempi maksan vajaatoimintapotilailla.
Huumeiden vuorovaikutustutkimukset
Sytokromi P450:n estäjät
Kliinisiä lääkeinteraktiotutkimuksia ei ole suoritettu CYP3A-entsyymin estäjien vaikutuksen arvioimiseksi dutasteridin farmakokinetiikkaan. In vitro -tietojen perusteella dutasteridin pitoisuudet veressä voivat kuitenkin suurentua CYP3A4/5-estäjien, kuten ritonaviirin, ketokonatsolin, verapamiilin, diltiatseemin, simetidiinin, troleandomysiinin ja siprofloksasiinin, läsnä ollessa.
Dutasteridi ei estä tärkeimpien ihmisen sytokromi P450 -isoentsyymien (CYP1A2, CYP2C9, CYP2C19, CYP2D6 ja CYP3A4) mallisubstraattien metaboliaa in vitro pitoisuudella 1 000 ng/ml, joka on 25 kertaa suurempi kuin vakaan tilan seerumipitoisuudet ihmisillä. .
Alfa-adrenergiset antagonistit
Terveillä vapaaehtoisilla tehdyssä yhden sekvenssin jakotutkimuksessa tamsulosiinin tai teratsosiinin anto yhdessä AVODARTin kanssa ei vaikuttanut kummankaan alfa-adrenergisen antagonistin vakaan tilan farmakokinetiikkaan. Vaikka tamsulosiinin tai teratsosiinin annon vaikutusta dutasteridin farmakokineettisiin parametreihin ei arvioitu, DHT-pitoisuuksien prosentuaalinen muutos oli samanlainen pelkällä AVODART-valmisteella 0,5 mg verrattuna yhdistelmähoitoon.
Kalsiumkanavan antagonistit
Populaatiofarmakokineettisessä analyysissä dutasteridin puhdistuman havaittiin pienenevän, kun sitä annettiin samanaikaisesti CYP3A4-estäjien verapamiilin (-37 %, n = 6) ja diltiatseemin (-44 %, n = 5) kanssa. Sitä vastoin puhdistuman pienenemistä ei havaittu, kun amlodipiinia, toista kalsiumkanavan salpaajaa, joka ei ole CYP3A4:n estäjä, annettiin samanaikaisesti dutasteridin kanssa (+7 %, n = 4).
Puhdistuksen vähenemistä ja sitä seuraavaa dutasteridialtistuksen lisääntymistä verapamiilin ja diltiatseemin kanssa ei pidetä kliinisesti merkitsevänä. Annoksen muuttamista ei suositella.
Kolestyramiini
Yksittäinen 5 mg:n AVODART 0,5 mg:n annos, jota seurasi 12 g kolestyramiinia 1 tunnin kuluttua, ei vaikuttanut dutasteridin suhteelliseen biologiseen hyötyosuuteen 12 normaalilla vapaaehtoisella.
Digoksiini
20 terveellä vapaaehtoisella tehdyssä tutkimuksessa AVODART 0,5 mg ei muuttanut digoksiinin vakaan tilan farmakokinetiikkaa, kun sitä annettiin samanaikaisesti annoksella 0,5 mg/vrk 3 viikon ajan.
Varfariini
Tutkimuksessa, johon osallistui 23 tervettä vapaaehtoista, 3 viikon AVODART-hoito 0,5 mg/vrk ei muuttanut S- tai R-varfariini-isomeerien vakaan tilan farmakokinetiikkaa eikä varfariinin vaikutusta protrombiiniaikaan, kun sitä annettiin varfariinin kanssa.
Muu samanaikainen hoito
Vaikka erityisiä yhteisvaikutustutkimuksia ei suoritettu muilla yhdisteillä, noin 90 % AVODART-hoitoa saaneiden kolmen satunnaistetun, kaksoissokkoutetun, lumekontrolloidun turvallisuus- ja tehotutkimuksen potilaista käytti muita lääkkeitä samanaikaisesti. Kliinisesti merkittäviä haitallisia yhteisvaikutuksia ei voitu katsoa johtuvan AVODARTin ja samanaikaisen hoidon yhdistelmästä, kun AVODARTia annettiin samanaikaisesti antihyperlipidemioiden, angiotensiinikonvertaasientsyymin (ACE) estäjien, beetasalpaajien, kalsiumkanavasalpaajien, kortikosteroidien, diureettien, ei-steroidisten antibioottien kanssa. -tulehduslääkkeet (NSAID:t), tyypin V fosfodiesteraasin estäjät ja kinoloniantibiootit.
Eläinten toksikologia ja/tai farmakologia
Keskushermoston toksikologiset tutkimukset
Rotilla ja koirilla toistuva dutasteridin oraalinen antaminen johti joillakin eläimillä merkkejä epäspesifisestä, palautuvasta, keskusvälitteisestä toksisuudesta ilman siihen liittyviä histopatologisia muutoksia altistuksilla, jotka olivat 425-kertaisia ja 315-kertaisia (peruslääkkeen) odotettua kliinistä altistusta vastaan. .
Kanin ihon kautta imeytyminen
Kanin ihon kautta tehdyssä farmakokinetiikkatutkimuksessa dutasteridin imeytyminen ihon kautta CAPMUL:ssa (glyseryylioleaatti) kaneilla johti seerumipitoisuuksiin 2,7-40,5 mcg/h/ml annoksilla 1-20 mg/ml tai 56-100 %. käytetystä dutasteridista imeytymään tukkeutuneissa ja pitkittyneissä olosuhteissa. Suun kautta annettavat AVODART-pehmeät gelatiinikapselit sisältävät 0,5 mg dutasteridia liuotettuna kapryyli/kapriinihapon ja butyloidun hydroksitolueenin mono-diglyseridien seokseen. Vedessä oleva dutasteridi imeytyi kaneissa minimaalisesti (2 000 mg/kg).
Kliiniset tutkimukset
Monoterapia
AVODARTia 0,5 mg/vrk (n = 2 167) tai lumelääkettä (n = 2 158) arvioitiin BPH:a sairastavilla miespuolisilla koehenkilöillä kolmessa 2-vuotisessa lumekontrolloidussa kaksoissokkoutetussa monikeskustutkimuksessa, joissa kussakin oli 2 vuoden avoin jatkotutkimus ( n = 2 340). Yli 90 % koeväestöstä oli valkoihoisia. Koehenkilöt olivat vähintään 50-vuotiaita, joiden seerumin PSA oli ≥1,5 ng/ml ja
Vaikutus oirepisteisiin
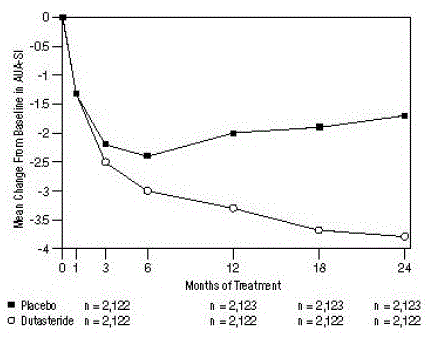
Oireet kvantifioitiin käyttämällä AUA-SI-kyselylomaketta, joka arvioi virtsan oireita (epätäydellinen tyhjentyminen, tiheys, ajoittaisuus, kiireellisyys, heikko virtaus, rasitus ja nokturia) arvioimalla asteikolla 0-5, jolloin mahdollinen kokonaispistemäärä on 35. korkeammat numeeriset oireiden kokonaispistemäärät, jotka edustavat suurempaa oireiden vakavuutta. Lähtötason AUA-SI-pisteet kolmessa tutkimuksessa oli noin 17 yksikköä molemmissa hoitoryhmissä.
Dutasteridia saaneiden potilaiden oireet paranivat tilastollisesti merkitsevästi lumelääkkeeseen verrattuna 3. kuukauteen mennessä yhdessä tutkimuksessa ja 12. kuukauteen mennessä kahdessa muussa keskeisessä tutkimuksessa. Kuukauden 12 kohdalla keskimääräinen lasku lähtötasosta AUA-SI-oireiden kokonaispisteissä kolmessa yhdistetyssä tutkimuksessa oli -3,3 yksikköä dutasteridilla ja -2,0 yksikköä lumelääkettä saaneilla, kun keskimääräinen ero kahden hoitoryhmän välillä oli -1,3 (vaihteluväli: -1,1 -1,5 yksikköön kussakin kolmesta tutkimuksesta, P
Nämä tutkimukset suunniteltiin ennakoivasti arvioimaan vaikutuksia oireisiin perustuen eturauhasen kokoon lähtötilanteessa. Miehillä, joiden eturauhasen tilavuus oli ≥ 40 cc, keskimääräinen lasku oli -3,8 yksikköä dutasteridilla ja -1,6 yksikköä lumelääkeryhmällä, ja keskimääräinen ero kahden hoitoryhmän välillä oli -2,2 kuukaudessa 24. Miehillä, joiden eturauhasen tilavuus oli
Kuva 1: AUA-SI-pistemäärän muutos lähtötasosta (satunnaistettu, kaksoissokkoutettu, plasebokontrolloidut kokeet yhdistetty)
AUA-SI-pisteet vaihtelevat 0-35.
Vaikutus akuuttiin virtsan pidättymiseen ja BPH:hen liittyvän leikkauksen tarpeeseen
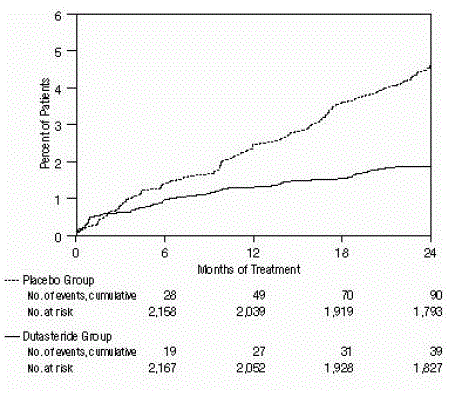
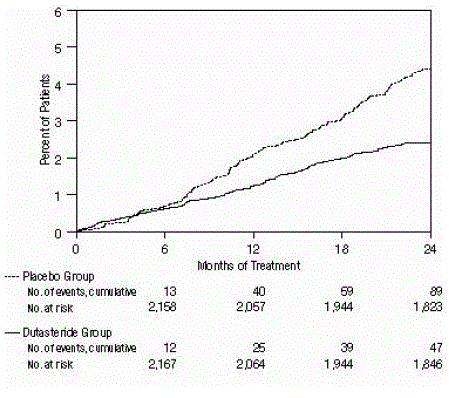
Tehoa arvioitiin myös 2 vuoden hoidon jälkeen katetrointia vaativien AUR:ien ja BPH:hen liittyvien urologisten kirurgisten toimenpiteiden esiintyvyyden perusteella. Plaseboon verrattuna AVODARTin käyttöön liittyi tilastollisesti merkitsevästi pienempi AUR:n ilmaantuvuus (1,8 % AVODARTilla vs. 4,2 % lumelääkettä saaneilla, P
Kuva 2: Prosenttiosuus potilaista, joille kehittyy akuutti virtsanpidätys 24 kuukauden aikana (satunnaistetut, kaksoissokkoutetut, lumekontrolloidut tutkimukset yhdistettynä)
Kuva 3: Prosenttiosuus potilaista, joille on leikattu eturauhasen hyvänlaatuinen liikakasvu 24 kuukauden aikana (satunnaistetut, kaksoissokkoutetut, lumekontrolloidut tutkimukset yhdistetty)
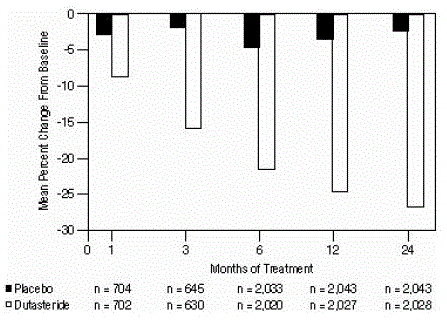
Vaikutus eturauhasen volyymiin
Kokeeseen pääsyä varten vaadittiin vähintään 30 cc:n eturauhasen tilavuus transrektaalisella ultraäänellä mitattuna. Keskimääräinen eturauhasen tilavuus tutkimukseen tullessa oli noin 54 cc.
Tilastollisesti merkitseviä eroja (AVODART 0,5 mg vs. lumelääke) havaittiin aikaisintaan hoidon jälkeisessä eturauhasen tilavuuden mittauksessa kussakin tutkimuksessa (kuukausi 1, kuukausi 3 tai kuukausi 6), ja ne jatkuivat kuukauteen 24. Kuukaudella 12 keskimääräinen prosentuaalinen muutos eturauhasen tilavuus kolmessa yhdistetyssä tutkimuksessa oli -24,7 % dutasteridilla ja -3,4 % lumelääkkeellä; keskimääräinen ero (dutasteridi miinus lumelääke) oli -21,3 % (vaihteluväli: -21,0 % - -21,6 % kaikissa kolmessa tutkimuksessa, P
Kuva 4: Eturauhasen tilavuuden prosentuaalinen muutos lähtötasosta (satunnaistettu, kaksoissokkoutettu, plasebokontrolloidut kokeet yhdistetty)
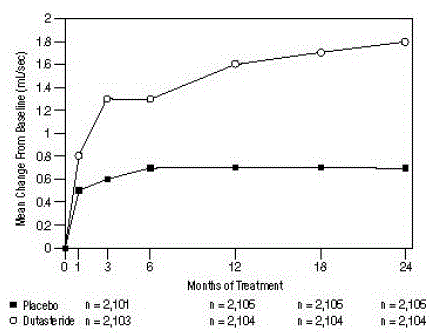
Vaikutus maksimivirtsan virtausnopeuteen
Tutkimukseen osallistumiseen vaadittiin keskimääräinen huippuvirtsan virtausnopeus (Qmax) ≤15 ml/s. Qmax oli lähtötasolla noin 10 ml/s kolmessa keskeisessä tutkimuksessa.
Erot näiden kahden ryhmän välillä olivat tilastollisesti merkitseviä lähtötasosta kuukauden 3 kohdalla kaikissa kolmessa tutkimuksessa, ja ne säilyivät 12. kuukauteen asti. Kuukaudella 12 Qmax:n keskimääräinen nousu kolmessa yhdistetyssä tutkimuksessa oli 1,6 ml/s AVODART 0,5 mg:n ja 0,7 ml:n kohdalla. /s lumelääkettä varten; keskimääräinen ero (dutasteridi miinus lumelääke) oli 0,8 ml/s (vaihteluväli: 0,7-1,0 ml/s kussakin kolmessa kokeessa, P
Kuva 5: Qmax-muutos lähtötasosta (satunnaistettu, kaksoissokkoutettu, plasebokontrolloidut kokeet yhdistetty)
Yhteenveto kliinisistä kokeista
Kolmen suuren, hyvin kontrolloidun tehokkuustutkimuksen tiedot osoittavat, että AVODART-hoito (0,5 mg kerran vuorokaudessa) vähentää sekä AUR- että BPH-peräisten kirurgisten toimenpiteiden riskiä lumelääkkeeseen verrattuna, parantaa BPH-oireita, vähentää eturauhasen tilavuutta ja lisää maksimiarvoa. virtsan virtausnopeudet. Nämä tiedot viittaavat siihen, että AVODART 0,5 mg pysäyttää BPH-tautiprosessin miehillä, joilla on laajentunut eturauhanen.
Yhdistelmä alfasalpaajahoidon kanssa (CombAT)
Yhdistelmähoidon (AVODART 0,5 mg/vrk plus tamsulosiini 0,4 mg/vrk, n = 1 610) tehoa verrattiin pelkkään AVODARTiin 0,5 mg (n = 1 623) tai pelkkään tamsulosiiniin (n = 1 611) 4 vuoden satunnaistetussa monikeskuksessa. , kaksoissokkoutettu kokeilu. Tutkimukseen osallistumisen kriteerit olivat samanlaiset kuin lumelääkekontrolloiduissa kaksoissokkoutetuissa monoterapian tehokkuustutkimuksissa, jotka on kuvattu kohdassa 14.1. Kahdeksankymmentäkahdeksan prosenttia (88 %) tutkimukseen osallistuneista oli valkoisia. Noin 52 % potilaista oli aiemmin altistunut 5-alfa-reduktaasi-inhibiittorille tai alfa-adrenergiselle-antagonistihoidolle. Hoitoon satunnaisesti määrätyistä 4 844 potilaasta 69 % yhdistelmäryhmässä, 67 % AVODARTia 0,5 mg saaneessa ryhmässä ja 61 % tamsulosiiniryhmässä suoritti 4 vuoden kaksoissokkohoidon.
Vaikutus oirepisteisiin
Oireet kvantifioitiin käyttämällä kansainvälisen eturauhasoireiden (IPSS) 7 ensimmäistä kysymystä (identtinen AUA-SI:n kanssa). Lähtötason pistemäärä oli noin 16,4 yksikköä jokaisessa hoitoryhmässä. Yhdistelmähoito oli tilastollisesti parempi kuin kutakin monoterapiahoitoa oirepisteiden pienentämisessä kuukauden 24 kohdalla, tämän päätetapahtuman ensisijaisena ajankohtana. Kuukaudella 24 keskimääräiset muutokset lähtötasosta (± SD) IPSS-oireiden kokonaispisteissä olivat -6,2 (±7,14) yhdistelmällä, -4,9 (±6,81) AVODARTilla ja -4,3 (±7,01) tamsulosiinilla keskimääräisellä erolla. yhdistelmän ja AVODARTin 0,5 mg välillä -1,3 yksikköä (P
Kuva 6: Kansainvälisten eturauhasoireiden pistemäärän muutos lähtötilanteesta 48 kuukauden aikana (satunnaistettu, kaksoissokkoutettu, rinnakkaisryhmäkoe [CombAT-kokeilu])
![International Prostate Symptom Score Change from Baseline over a 48Month Period (Randomized, Double-blind, Parallel-Group Trial [CombAT Trial]) - Illustration](/pics/2c593062c2292f0c5f6fbb051709e8ad.jpg)
Vaikutus akuuttiin virtsan pidättymiseen tai BPH:hen liittyvän leikkauksen tarpeeseen
Neljän vuoden hoidon jälkeen yhdistelmähoito AVODART 0,5 mg:n ja tamsulosiinin kanssa ei vähentänyt AUR- tai BPH-leikkausten ilmaantuvuutta verrattuna AVODART-monoterapiaan.
Vaikutus maksimivirtsan virtausnopeuteen
Lähtötason Qmax oli noin 10,7 ml/s jokaisessa hoitoryhmässä. Yhdistelmähoito oli tilastollisesti parempi kuin kutakin monoterapiahoitoa Qmax:n nostamisessa kuukauden 24 kohdalla, tämän päätetapahtuman ensisijaisena ajankohtana. Kuukaudella 24 Qmax:n keskimääräinen nousu lähtötasosta (± SD) oli 2,4 (±5,26) ml/s yhdistelmälle, 1,9 (±5,10) ml/s AVODART 0,5 mg:lle ja 0,9 (±4,57) ml/sek. tamsulosiini, keskimääräinen ero yhdistelmän ja AVODARTin välillä 0,5 ml/s (P = 0,003; [95 % CI: 0,17, 0,84]) ja yhdistelmän ja tamsulosiinin välillä 1,5 ml/s (P
Yhdistelmähoidon Qmax-arvon lisäparannus verrattuna AVODARTin 0,5 mg monoterapiaan ei ollut enää tilastollisesti merkitsevä kuukauden 48 kohdalla.
Kuva 7: Qmax-muutos lähtötasosta 24 kuukauden aikana (satunnaistettu, kaksoissokkoutettu, rinnakkaisryhmäkoe [CombAT-kokeilu])
![Qmax Change from Baseline over a 24-Month Period (Randomized, Double-blind, Parallel-Group Trial [CombAT Trial]) - Illustration](/pics/432afaf7f6d93bdbd23267906072bcbf.jpg)
Vaikutus eturauhasen volyymiin
Keskimääräinen eturauhasen tilavuus tutkimukseen tullessa oli noin 55 cc. Kuukaudella 24, tämän päätetapahtuman ensisijaisena ajankohtana, eturauhasen tilavuuden keskimääräiset prosentuaaliset muutokset lähtötasosta (±SD) olivat -26,9 % (±22,57) yhdistelmähoidossa, -28,0 % (±24,88) AVODART 0,5 mg:n kohdalla ja 0 % (±31,14) tamsulosiinilla, keskimääräinen ero yhdistelmän ja AVODARTin 0,5 mg välillä 1,1 % (P = NS; [95 % CI: -0,6, 2,8]) ja yhdistelmän ja tamsulosiinin välillä -26,9 % (P
POTILASTIEDOT
AVODART (av o dart) (dutasteridi) kapselit
AVODART 0,5 mg on tarkoitettu vain miesten käyttöön.
Lue nämä potilastiedot ennen kuin aloitat AVODART 0,5 mg:n käytön ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Nämä tiedot eivät korvaa terveydenhuollon tarjoajan kanssa puhumista terveydentilastasi tai hoidostasi.
Mikä on AVODART 0,5 mg?
AVODART 0,5 mg on reseptilääke, joka sisältää dutasteridia. AVODART 0,5 mg käytetään hyvänlaatuisen eturauhasen liikakasvun (BPH) oireiden hoitoon miehillä, joilla on suurentunut eturauhanen:
- parantaa oireita,
- vähentää akuutin virtsan pidättymisen riskiä (virtsan virtauksen täydellinen tukkeutuminen),
- vähentää BPH:hen liittyvän leikkauksen tarpeen riskiä.
Kuka EI saa ottaa AVODARTia?
Älä ota AVODARTia, jos olet:
- raskaana tai voi tulla raskaaksi. AVODART 0,5 mg voi vahingoittaa sikiötäsi. Raskaana olevat naiset eivät saa koskea AVODART-kapseleihin. Jos nainen, joka on raskaana poikalapsen kanssa, saa tarpeeksi AVODART 0,5 mg -valmistetta kehoonsa nielaisemalla tai koskettamalla AVODARTia, poikalapsella voi syntyä epänormaalia sukupuolielimiä. Jos raskaana oleva tai hedelmällisessä iässä oleva nainen joutuu kosketuksiin vuotavien AVODART 0,5 mg -kapseleiden kanssa, kosketusalue on pestävä välittömästi saippualla ja vedellä.
- lapsi tai teini.
- allerginen dutasteridille tai jollekin AVODARTin aineosalle. Katso tämän pakkausselosteen lopusta täydellinen luettelo AVODARTin ainesosista.
- allerginen muille 5 alfa-reduktaasin estäjille, esimerkiksi PROSCAR (finasteridi) ® -tableteille.
Mitä minun pitäisi kertoa terveydenhuollon tarjoajalle ennen AVODART 0,5 mg:n ottamista?
Ennen kuin otat AVODART 0,5 mg -valmistetta, kerro terveydenhuollon tarjoajallesi, jos:
- sinulla on maksaongelmia
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien reseptilääkkeet ja ilman reseptiä saatavat lääkkeet, vitamiinit ja yrttilisät. AVODART ja muut lääkkeet voivat vaikuttaa toisiinsa ja aiheuttaa sivuvaikutuksia. AVODART 0,5 mg voi vaikuttaa muiden lääkkeiden tehoon, ja muut lääkkeet voivat vaikuttaa AVODART 0,5 mg:n tehoon.
Tunne käyttämäsi lääkkeet. Pidä niistä luetteloa näyttääksesi terveydenhuollon tarjoajalle ja apteekkihenkilökunnalle, kun saat uuden lääkkeen.
Miten minun pitäisi ottaa AVODARTia?
- Ota 1 AVODART-kapseli kerran päivässä.
- Niele AVODART 0,5 mg kapselit kokonaisina. Älä murskaa, pureskele tai avaa AVODART 0,5 mg -kapseleita, koska kapselin sisältö voi ärsyttää huulia, suuta tai kurkkua.
- Voit ottaa AVODART 0,5 mg:n ruoan kanssa tai ilman.
- Jos unohdat ottaa annoksen, voit ottaa sen myöhemmin samana päivänä. Älä korvaa unohtunutta annosta ottamalla 2 annosta seuraavana päivänä.
Mitä minun tulee välttää AVODART 0,5 mg -hoidon aikana?
- Älä luovuta verta AVODART-hoidon aikana tai 6 kuukauteen AVODART-hoidon lopettamisen jälkeen. Tämä on tärkeää, jotta raskaana olevat naiset eivät saa AVODARTia verensiirron kautta.
Mitkä ovat AVODARTin mahdolliset sivuvaikutukset?
AVODART voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Harvinaiset ja vakavat allergiset reaktiot, mukaan lukien:
- kasvojen, kielen tai kurkun turvotus
- vakavat ihoreaktiot, kuten ihon hilseily
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on näitä vakavia allergisia reaktioita.
- Suurempi mahdollisuus saada vakavampi eturauhassyövän muoto.
AVODARTin yleisimpiä sivuvaikutuksia ovat:
- ongelmia erektion saavuttamisessa tai säilyttämisessä (impotenssi)*
- sukupuolihalun (libido) lasku*
- siemensyöksyongelmat*
- suurentuneet tai kipeät rinnat. Jos huomaat rinnoissa kyhmyjä tai vuotoa nännistä, sinun tulee keskustella terveydenhuollon tarjoajan kanssa.
*Jotkin näistä tapahtumista voivat jatkua AVODARTin käytön lopettamisen jälkeen.
AVODART-hoitoa saavilla potilailla on raportoitu masentunutta mielialaa.
AVODART 0,5 mg:n on osoitettu vähentävän siittiöiden määrää, siemennesteen määrää ja siittiöiden liikettä. AVODART 0,5 mg:n vaikutusta miesten hedelmällisyyteen ei kuitenkaan tunneta.
Eturauhasspesifisen antigeenin (PSA) testi: Terveydenhuollon tarjoaja voi tarkistaa sinut muiden eturauhasongelmien, mukaan lukien eturauhassyövän, varalta ennen AVODART-hoidon aloittamista ja AVODART-hoidon aikana. PSA-nimistä verikoetta (eturauhasspesifinen antigeeni) käytetään joskus sen selvittämiseen, onko sinulla eturauhassyöpä. AVODART vähentää verestäsi mitattua PSA:n määrää. Terveydenhuollon tarjoajasi on tietoinen tästä vaikutuksesta ja voi silti käyttää PSA:ta selvittääkseen, onko sinulla eturauhassyöpä. PSA-tasosi kohoaminen AVODART-hoidon aikana (vaikka PSA-tasot olisivat normaalialueella) tulee arvioida terveydenhuollon tarjoajan toimesta.
Kerro terveydenhuollon tarjoajallesi, jos sinulla on jokin haittavaikutus, joka häiritsee sinua tai joka ei katoa.
Nämä eivät ole kaikkia AVODARTin mahdollisia sivuvaikutuksia. Lisätietoja saat terveydenhuollon tarjoajalta tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka minun pitäisi säilyttää AVODART 0,5 mg?
- Säilytä AVODART 0,5 mg kapseleita huoneenlämmössä (59 °F - 86 °F tai 15 °C - 30 °C).
- AVODART 0,5 mg kapselit voivat muuttaa muotoaan ja/tai värjäytyä, jos niitä säilytetään korkeissa lämpötiloissa.
- Älä käytä AVODART 0,5 mg -valmistetta, jos kapselisi ovat epämuodostuneet, värjäytyneet tai vuotavat.
- Hävitä turvallisesti pois tarpeettomat lääkkeet.
Pidä AVODART 0,5 mg ja kaikki lääkkeet poissa lasten ulottuvilta.
Lääkkeitä määrätään joskus muihin kuin potilasselosteessa mainittuihin tarkoituksiin. Älä käytä AVODART 0,5 mg -valmistetta sairauteen, johon sitä ei ole määrätty. Älä anna AVODARTia muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Tämä potilasseloste sisältää yhteenvedon tärkeimmistä AVODART-tiedoista. Jos haluat lisätietoja, keskustele terveydenhuollon tarjoajasi kanssa. Voit kysyä apteekista tai terveydenhuollon tarjoajalta tietoja AVODART 0,5 mg:sta, joka on kirjoitettu terveydenhuollon ammattilaisille.
Lisätietoja saat osoitteesta www.AVODART.com tai soittamalla numeroon 1-888-825-5249.
Mitä ainesosia AVODART 0,5 mg sisältää?
Aktiivinen ainesosa: dutasteridi.
Inaktiiviset ainesosat: butyloitu hydroksitolueeni, rautaoksidi (keltainen), gelatiini (sertifioiduista BSE-vapaista naudan lähteistä), glyseriini, kapryyli-/kapriinihapon mono-diglyseridit, titaanidioksidi ja syötävä punainen muste.
Miten AVODART toimii?
Eturauhasen kasvua aiheuttaa veressä oleva dihydrotestosteroni (DHT) -niminen hormoni. AVODART vähentää DHT:n tuotantoa kehossa, mikä johtaa laajentuneen eturauhasen kutistumiseen useimmilla miehillä. Vaikka joillakin miehillä on vähemmän ongelmia ja oireita 3 kuukauden AVODART-hoidon jälkeen, vähintään 6 kuukauden hoitojakso on yleensä tarpeen nähdäksesi, toimiiko AVODART 0,5 mg sinulle.
Yhdysvaltain elintarvike- ja lääkevirasto on hyväksynyt nämä potilastiedot.
