Silmätipat: Lumigan 3ml Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Lumigan on ja miten sitä käytetään?
Lumigan 3ml on reseptilääke, jota käytetään tietyntyyppisten glaukooman ja ripsien hypotrikoosin aiheuttamien kohonneen silmänsisäisen paineen oireiden hoitoon. Lumigania voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Lumigan kuuluu lääkeryhmään nimeltä Antiglaucoma, Prostaglandin Agonists.
Ei tiedetä, onko Lumigan turvallinen ja tehokas lapsille.
Mitkä ovat Lumiganin mahdolliset sivuvaikutukset?
Lumigan voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- silmien turvotus,
- silmän punoitus,
- vakava epämukavuus silmissä,
- kuoriutuminen tai valuminen silmästä,
- näkö muuttuu ja
- punaiset, turvonneet tai kutisevat silmäluomet
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Lumiganin yleisimpiä sivuvaikutuksia ovat:
- silmien punoitus
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Lumiganin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
LUMIGAN® (bimatoprosti oftalminen liuos) 0,03 % on synteettinen prostamidianalogi, jolla on silmän verenpainetta alentava vaikutus. Sen kemiallinen nimi on (Z)-7-[(1R,2R,3R,5S)-3,5-dihydroksi-2[(1E,3S)-3-hydroksi-5-fenyyli-1-pentenyyli]syklopentyyli]- 5-N-etyylihepteenamidi, ja sen molekyylipaino on 415,58. Sen molekyylikaava on C25H37NO4. Sen kemiallinen rakenne on:
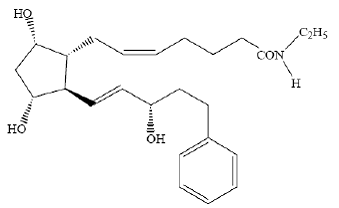
Bimatoprosti on jauhe, joka liukenee hyvin etyylialkoholiin ja metyylialkoholiin ja liukenee heikosti veteen. LUMIGAN® 0,03% on kirkas, isotoninen, väritön, steriili oftalminen liuos, jonka osmolaliteetti on noin 290 mOsmol/kg.
LUMIGAN® 0,03 % sisältää Aktiivinen: bimatoprosti 0,3 mg/ml; Ei-aktiiviset: bentsalkoniumkloridi 0,05 mg/ml; natriumkloridia; natriumfosfaatti, kaksiemäksinen; sitruunahappo; ja puhdistettua vettä. Natriumhydroksidia ja/tai kloorivetyhappoa voidaan lisätä pH:n säätämiseksi. Sen pH on säilyvyyden aikana 6,8-7,8.
INDIKAATIOT
LUMIGAN® (bimatoprosti oftalminen liuos) 0,01% on tarkoitettu kohonneen silmänpaineen vähentämiseen potilailla, joilla on avokulmaglaukooma tai silmän hypertensio.
ANNOSTELU JA HALLINNOINTI
Suositeltu annos on yksi tippa sairaaseen silmään (silmiin) kerran päivässä illalla. LUMIGAN® (bimatoprosti oftalminen liuos) 0,01% ei saa antaa useammin kuin kerran päivässä, koska on osoitettu, että prostaglandiinianalogien useammin antaminen voi vähentää silmänsisäistä painetta alentavaa vaikutusta.
Silmänsisäisen paineen lasku alkaa noin 4 tunnin kuluttua ensimmäisestä annosta, ja suurin vaikutus saavutetaan noin 8-12 tunnin kuluessa.
LUMIGAN® 0,01 % voidaan käyttää samanaikaisesti muiden paikallisesti käytettävien oftalmisten lääkevalmisteiden kanssa silmänsisäisen paineen alentamiseksi. Jos käytetään useampaa kuin yhtä paikallisesti käytettävää silmälääkettä, tulee lääkkeiden annostella vähintään viiden (5) minuutin välein.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
Oftalminen liuos, joka sisältää bimatoprostia 0,1 mg/ml.
Varastointi ja luovutus
LUMIGAN® (bimatoprosti oftalminen liuos) 0,01% toimitetaan steriilinä läpinäkymättömässä valkoisessa matalatiheyksisessä polyeteenissä olevissa silmäannostelupulloissa ja -kärkissä, joissa on turkoosi polystyreenikorkki seuraavissa koossa:
Täytä 2,5 ml 5 ml:n astiaan - NDC 0023-3205-03 5 ml:n täyttö 10 ml:n astiaan - NDC 0023-3205-05 7,5 ml:n täyttö 10 ml:n astiaan - NDC 0023-3205-08
Varastointi: Säilytä 2°C - 25°C (36°F - 77°F).
Avaamisen jälkeen LUMIGAN® 0,01% voidaan käyttää pullossa olevaan viimeiseen käyttöpäivään asti.
Jakelija: Allergan USA, Inc. Madison, NJ 07940. Tarkistettu: maaliskuu 2022
SIVUVAIKUTUKSET
Seuraavat haittavaikutukset on kuvattu muualla merkinnöissä:
- Pigmentaatio, mukaan lukien blefaraalinen pigmentaatio ja iiriksen hyperpigmentaatio [katso VAROITUKSET JA VAROTOIMET ]
- Ripsien muutokset [katso VAROITUKSET JA VAROTOIMET ]
- Silmänsisäinen tulehdus [katso VAROITUKSET JA VAROTOIMET ]
- Makulaarinen turvotus [katso VAROITUKSET JA VAROTOIMET ]
- Yliherkkyys [katso VASTA-AIHEET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
12 kuukautta kestäneessä kliinisessä tutkimuksessa, jossa käytettiin bimatoprostia 0,01 % silmäliuoksilla, yleisin haittavaikutus oli sidekalvon hyperemia (31 %). Noin 1,6 % potilaista keskeytti hoidon sidekalvon hyperemian vuoksi. Muut haittavaikutukset (raportoitu 1–4 %:lla potilaista), joihin liittyy LUMIGAN® 0,01 % tässä tutkimuksessa sisälsi sidekalvon turvotusta, sidekalvon verenvuotoa, silmien ärsytystä, silmäkipua, silmän kutinaa, silmäluomen punoitusta, silmäluomien kutinaa, ripsien kasvua, hypertrichoosia, tiputuskohdan ärsytystä, pistemäistä keratiittia, ihon hyperpigmentaatiota, näön hämärtymistä ja näön hämärtymistä vähennetty.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu hyväksynnän jälkeisen käytön aikana LUMIGAN® 0,01 %. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen. Nämä reaktiot, jotka on valittu sisällytettäväksi joko niiden vakavuuden, ilmoitustiheyden tai mahdollisen syy-yhteyden vuoksi LUMIGAN® , tai näiden tekijöiden yhdistelmää ovat: astman kaltaiset oireet, huimaus, silmien kuivuus, hengenahdistus, silmävuoto, silmän turvotus, vieraskappaleen tunne, päänsärky, yliherkkyys mukaan lukien silmäallergian ja allergisen ihotulehduksen merkit ja oireet, kohonnut verenpaine, lisääntynyt kyynelvuoto, silmäluomien ja silmäluomien muutokset mukaan lukien silmäluomien uurteen syveneminen ja valonarkuus.
HUUMEIDEN VUOROVAIKUTUKSET
Tietoja ei toimitettu
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Pigmentaatio
Bimatoprosti-silmäliuoksen on raportoitu aiheuttavan muutoksia pigmentoituneisiin kudoksiin. Yleisimmin raportoituja muutoksia ovat olleet iiriksen, silmäluomien (silmäluomen) ja silmäripsien lisääntynyt pigmentaatio. Pigmentaation odotetaan lisääntyvän niin kauan kuin bimatoprostia annetaan. Pigmentaatiomuutos johtuu melanosyyttien lisääntyneestä melaniinipitoisuudesta pikemminkin kuin melanosyyttien määrän lisääntymisestä. Bimatoprostin käytön lopettamisen jälkeen iiriksen pigmentaatio on todennäköisesti pysyvää, kun taas silmän ympärillä tapahtuvan kudoksen pigmentaation ja ripsien muutosten on raportoitu olevan palautuvia joillakin potilailla. Hoitoa saaville potilaille on kerrottava lisääntyneen pigmentaation mahdollisuudesta. Lisääntyneen pigmentaation pitkäaikaisia vaikutuksia ei tunneta.
Iriksen värin muutos ei ehkä ole havaittavissa useisiin kuukausiin tai vuosiin. Tyypillisesti pupillin ympärillä oleva ruskea pigmentti leviää samankeskisesti iiriksen reunaa kohti ja koko iiris tai sen osat muuttuvat ruskeammiksi. Hoito ei näytä vaikuttavan iiriksen neviin tai pisamioihin. Vaikka LUMIGAN® (bimatoprosti oftalminen liuos) 0,01 % -hoitoa voidaan jatkaa potilailla, joille kehittyy huomattavasti lisääntynyt iiriksen pigmentaatio, nämä potilaat tulee tutkia säännöllisesti.
Ripsien muutokset
LUMIGAN® 0,01% voi vähitellen muuttaa ripsiä ja karvoja hoidetussa silmässä. Nämä muutokset sisältävät ripsien pituuden, paksuuden ja ripsien määrän lisääntymisen. Ripsien muutokset ovat yleensä palautuvia, kun hoito lopetetaan.
Silmänsisäinen tulehdus
Prostaglandiinianalogien, mukaan lukien bimatoprosti, on raportoitu aiheuttavan silmänsisäistä tulehdusta. Lisäksi, koska nämä tuotteet voivat pahentaa tulehdusta, varovaisuutta tulee noudattaa potilailla, joilla on aktiivinen silmänsisäinen tulehdus (esim. uveiitti).
Makulaarinen turvotus
Makulaturvotusta, mukaan lukien kystoidinen makulaturvotus, on raportoitu bimatoprosti-silmäliuoshoidon aikana. LUMIGAN® 0,01 %:a tulee käyttää varoen afakiapotilailla, pseudofakiapotilailla, joilla on repeytynyt mykiön takakapseli, tai potilailla, joilla on tunnettuja makulaedeeman riskitekijöitä.
Bakteerikeratiitti
On raportoitu bakteeriperäistä keratiittia, joka liittyy paikallisten silmätuotteiden usean annoksen säiliöiden käyttöön. Nämä säiliöt olivat vahingossa kontaminoituneet potilailta, joilla oli useimmissa tapauksissa samanaikainen sarveiskalvosairaus tai silmän epiteelin pinnan häiriö.
Piilolinssien käyttö
LUMIGAN® 0,01% sisältää bentsalkoniumkloridia, joka voi imeytyä ja aiheuttaa pehmeiden piilolinssien värimuutoksia. Piilolinssit tulee poistaa ennen LUMIGAN® 0,01% -instillaatiota ja ne voidaan laittaa takaisin 15 minuutin kuluttua sen antamisesta.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeneesi
Bimatoprosti ei ollut karsinogeeninen hiirille eikä rotille, kun sitä annettiin suun kautta letkuruokinnalla 104 viikon ajan annoksilla 2 mg/kg/vrk ja 1 mg/kg/vrk (192 ja 291 kertaa arvioitu ihmisen systeeminen altistus bimatoprostille 0,03 %). annosteltuna molemmin puolin kerran vuorokaudessa, vastaavasti, veren AUC-tasojen perusteella)
Mutageneesi
Bimatoprosti ei ollut mutageeninen tai klastogeeninen Amesin testissä, hiiren lymfoomatestissä eikä hiiren in vivo mikrotumatesteissä.
Hedelmällisyyden heikkeneminen
Bimatoprosti ei heikentänyt uros- tai naarasrottien hedelmällisyyttä 0,6 mg/kg/vrk annoksiin asti (vähintään 103 kertaa suurempi kuin suositeltu ihmisen altistus bimatoprostille 0,03 %, joka annostellaan kahdenvälisesti kerran vuorokaudessa veren AUC-tasojen perusteella).
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia LUMIGAN® (bimatoprosti oftalminen liuos) 0,01 %:n antamisesta raskaana oleville naisille. Bimatoprostin markkinoille tulon jälkeinen kokemus ei lisää vakavien synnynnäisten epämuodostumien tai keskenmenojen riskiä.
Alkion ja sikiön kehitystutkimuksissa bimatoprostin antaminen raskaana oleville hiirille ja rotille organogeneesin aikana johti aborttiin ja varhaiseen synnytykseen suun kautta annetuilla annoksilla, jotka olivat vähintään 33-kertaisia (hiiret) tai 94-kertaisia (rotat) verrattuna ihmisen altistukseen 0,03 %:n bimatoprostille, joka annosteltiin molemmin puolin kerran päivässä ( käyrän alla olevan verialueen [AUC]-tasojen perusteella). Näitä haittavaikutuksia ei havaittu 2,6-kertaisella (hiirillä) ja 47-kertaisella (rotilla) altistuksessa ihmisen 0,03-prosenttiselle bimatoprostille, joka annosteltiin kahdenvälisesti kerran vuorokaudessa (veren AUC-tasojen perusteella).
Pre/postnataalista kehitystä koskevissa tutkimuksissa bimatoprostin antaminen tiineille rotille organogeneesistä laktaation loppuun johti tiineyden pituuteen ja sikiön painon lyhenemiseen sekä sikiön ja poikasten kuolleisuuden lisääntymiseen suun kautta annetuilla annoksilla, jotka olivat vähintään 41 kertaa suuremmat kuin ihmisen systeeminen altistus bimatoprostille 0,03. % annosteltuna molemmin puolin kerran vuorokaudessa (veren AUC-tasojen perusteella). Rotan jälkeläisillä ei havaittu haittavaikutuksia altistuksilla, joiden arvioitiin olevan 14 kertaa suurempi kuin ihmisen altistuminen 0,03 %:n bimatoprostille, joka annosteltiin kahdenvälisesti kerran vuorokaudessa (veren AUC-tasojen perusteella).
Koska eläinten lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, LUMIGAN® 0,01 % tulee antaa raskauden aikana vain, jos mahdollinen hyöty oikeuttaa mahdollisen riskin sikiölle.
Data
Eläinten tiedot
Alkion ja sikiön kehitystä koskevassa rotalla tehdyssä tutkimuksessa abortti havaittiin tiineillä rotilla, joille annettiin bimatoprostia suun kautta organogeneesin aikana 0,6 mg/kg/vrk (94 kertaa ihmisen systeeminen altistus bimatoprostille 0,03 %, kun bimatoprostia annettiin kerran vuorokaudessa AUC:n perusteella). No Observed Adverse Effect Level (NOAEL) abortille oli 0,3 mg/kg/vrk (arviolta 47 kertaa suurempi kuin ihmisen systeeminen altistus bimatoprostille 0,03 %, joka annostellaan kahdenvälisesti kerran vuorokaudessa, AUC:n perusteella). Rotan sikiöillä ei havaittu poikkeavuuksia annoksilla 0,6 mg/kg/vrk asti.
Hiirillä tehdyssä alkion ja sikiön kehitystä koskevassa tutkimuksessa havaittiin keskenmenoa ja varhaista synnytystä raskaana olevilla hiirillä, joille annettiin bimatoprostia suun kautta organogeneesin aikana annoksina, jotka olivat suurempia tai yhtä suuria kuin 0,3 mg/kg/vrk (33 kertaa ihmisen systeeminen altistus bimatoprostille, joka on 0,03 % kahdenvälisesti kerran vuorokaudessa, AUC:n perusteella). Abortin ja varhaisen synnytyksen NOAEL-arvo oli 0,1 mg/kg/vrk (2,6 kertaa ihmisen systeeminen altistus bimatoprostille, 0,03 % kahdenvälisesti kerran vuorokaudessa, AUC:n perusteella). Hiiren sikiöillä ei havaittu poikkeavuuksia annoksilla 0,6 mg/kg/vrk asti (72 kertaa suurempi kuin ihmisen systeeminen altistus bimatoprostille, 0,03 %, joka annostellaan kahdenvälisesti kerran vuorokaudessa, AUC:n perusteella).
Pre/postnataalisessa kehitystutkimuksessa raskaana olevien rottien hoito bimatoprostilla suun kautta tiineyspäivästä 7. imetyspäivään 20 johti tiineyden pituuden lyhenemiseen, lisääntyneeseen myöhäiseen resorptioon, sikiökuolemiin ja syntymän jälkeiseen poikakuolleisuuteen sekä poikasten painon laskuun annoksilla, jotka olivat suurempia kuin tai yhtä suuri kuin 0,3 mg/kg/vrk. Näitä vaikutuksia havaittiin altistuksilla, jotka olivat vähintään 41 kertaa suuremmat kuin ihmisen systeeminen altistus 0,03 %:lle bimatoprostille, joka annosteltiin kahdenvälisesti kerran vuorokaudessa AUC:n perusteella. Jälkeläisten postnataalisen kehityksen ja parittelukyvyn NOAEL-arvo oli 0,1 mg/kg/vrk (arviolta 14 kertaa suurempi kuin ihmisen systeeminen altistus bimatoprostille 0,03 %, joka annostellaan kahdenvälisesti kerran vuorokaudessa, AUC:n perusteella).
Imetys
Riskien yhteenveto
Ei tiedetä, voisiko LUMIGAN® 0,01 %:n paikallinen silmähoito johtaa riittävään systeemiseen imeytymiseen tuottamaan havaittavia määriä äidinmaitoon. Eläinkokeissa bimatoprostin on osoitettu olevan imettävien rottien rintamaidossa suonensisäisenä annoksena (eli 1 mg/kg) 970 kertaa RHOD (mg/rn 2 perusteella), mutta eläintietoja ei ole saatavilla. kliinisesti merkittävillä annoksilla.
Imetyksen kehitys- ja terveyshyödyt tulee ottaa huomioon, äidin kliininen tarve LUMIGAN® 0,01 %:lle ja LUMIGAN® 0,01 % mahdolliset haitalliset vaikutukset imetettävään lapseen.
Käyttö lapsille
Käyttöä alle 16-vuotiaille lapsipotilaille ei suositella pitkäaikaisen kroonisen käytön seurauksena lisääntyneeseen pigmentaatioon liittyvien mahdollisten turvallisuusongelmien vuoksi.
Geriatrinen käyttö
Mitään yleisiä kliinisiä eroja turvallisuudessa tai tehokkuudessa ei ole havaittu iäkkäiden ja muiden aikuisten potilaiden välillä.
YLIANNOSTUS
Yliannostuksesta ihmisillä ei ole tietoa. Jos LUMIGAN® (bimatoprosti oftalminen liuos) 0,01 % yliannostus tapahtuu, hoidon tulee olla oireenmukaista.
Suun kautta (letkuletkulla) suoritetuissa hiirillä ja rotilla tehdyissä tutkimuksissa annokset 100 mg/kg/vrk asti eivät aiheuttaneet toksisuutta. Tämä annos ilmaistuna mg/m2 on vähintään 210 kertaa suurempi kuin yhden LUMIGAN® 0,01 % pullon vahingossa 10 kg painavalle lapselle.
VASTA-AIHEET
LUMIGAN® 0,01% on vasta-aiheinen potilailla, jotka ovat yliherkkiä bimatoprostille tai jollekin ainesosalle [ks. HAITTAVAIKUTUKSET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Bimatoprosti, prostaglandiinianalogi, on prostaglandiinin synteettinen rakenteellinen analogi, jolla on silmän verenpainetta alentava vaikutus. Se jäljittelee selektiivisesti luonnossa esiintyvien aineiden, prostamidien, vaikutuksia. Bimatoprostin uskotaan alentavan silmänsisäistä painetta (IOP) ihmisillä lisäämällä nesteen ulosvirtausta sekä trabekulaarisen verkon että uveoskleraalisten reittien kautta. Kohonnut silmänpaine on merkittävä riskitekijä glaukoomakentän menetykselle. Mitä korkeampi silmänpainetaso on, sitä suurempi on näköhermovaurion ja näkökentän menetyksen todennäköisyys.
Farmakokinetiikka
Imeytyminen
Kun yksi tippa 0,03 % bimatoprosti-silmäliuosta annettiin kerran päivässä 15 terveen koehenkilön molempiin silmiin kahden viikon ajan, pitoisuudet veressä saavuttivat huippunsa 10 minuutin kuluessa annostelusta ja olivat alle havainnointirajan (0,025 ng/ml) useimmilla koehenkilöillä. 1,5 tuntia annostelun jälkeen. Keskimääräiset Cmax- ja AUC0-24h-arvot olivat samankaltaisia päivinä 7 ja 14 noin 0,08 ng/ml ja 0,09 ng•hr/ml, mikä osoittaa, että vakaa tila saavutettiin ensimmäisen silmän annosteluviikon aikana. Merkittävää systeemistä lääkkeiden kertymistä ei ollut ajan mittaan.
Jakelu
Bimatoprosti jakautuu kohtalaisesti kehon kudoksiin vakaan tilan jakautumistilavuuden ollessa 0,67 l/kg. Ihmisen veressä bimatoprosti on pääasiassa plasmassa. Noin 12 % bimatoprostista pysyy sitoutumattomana ihmisen plasmassa.
Eliminointi
Aineenvaihdunta
Bimatoprosti on tärkein verenkierrossa oleva laji, kun se saavuttaa systeemisen verenkierron silmän annostelun jälkeen. Sitten bimatoprosti hapettuu, N-deetyloituu ja glukuronidoituu, jolloin muodostuu erilaisia metaboliitteja.
Erittyminen
Kun kuudelle terveelle koehenkilölle annettiin suonensisäisesti radioaktiivisesti leimattua bimatoprostia (3,12 mcg/kg), muuttumattoman lääkkeen maksimipitoisuus veressä oli 12,2 ng/ml ja se pieneni nopeasti eliminaation puoliintumisajan ollessa noin 45 minuuttia. Bimatoprostin kokonaispuhdistuma verestä oli 1,5 l/h/kg. Jopa 67 % annetusta annoksesta erittyi virtsaan, kun taas 25 % annoksesta erittyi ulosteeseen.
Kliiniset tutkimukset
12 kuukautta kestäneessä kliinisessä tutkimuksessa potilailla, joilla oli avokulmaglaukooma tai silmänpainetauti ja joiden silmänpaineen keskiarvo lähtötilanteessa oli 23,5 mmHg, LUMIGAN® 0,01 %:n silmänpainetta alentava vaikutus kerran vuorokaudessa (iltaisin) oli jopa 7,5 mmHg.
POTILASTIEDOT
Mahdollisuus pigmentoitumiseen
Kerro potilaille iiriksen lisääntyneestä ruskeasta pigmentaatiosta, joka voi olla pysyvää. Kerro potilaille myös mahdollisesta silmäluomien ihon tummumisesta, joka voi olla palautuva LUMIGAN® (bimatoprosti oftalminen liuos) 0,01 %:n käytön lopettamisen jälkeen.
Mahdollisuus ripsien muutoksiin
Kerro potilaille mahdollisista ripsien ja velluskarvojen muutoksista hoidetussa silmässä LUMIGAN® 0,01% -hoidon aikana. Nämä muutokset voivat johtaa eroihin silmien välillä pituudessa, paksuudessa, pigmentaatiossa, ripsien tai velluskarvojen lukumäärässä ja/tai ripsien kasvusuunnassa. Ripsien muutokset ovat yleensä palautuvia, kun hoito lopetetaan.
Kontin käsittely
Neuvo potilaita välttämään annostelusäiliön kärjen joutumista silmiin, ympäröiviin rakenteisiin, sormiin tai mihin tahansa muuhun pintaan, jotta vältetään liuoksen kontaminaatio tavallisilla silmäinfektioita aiheuttavilla bakteereilla. Saastuneiden liuosten käyttö voi aiheuttaa vakavia silmävaurioita ja sitä seuraavaa näönmenetystä.
Milloin kysyä neuvoa lääkäriltä
Kerro potilaille, että jos heille kehittyy väliaikainen silmäsairaus (esim. trauma tai infektio), silmäleikkaus tai silmäreaktioita, erityisesti sidekalvotulehdusta ja silmäluomen reaktioita, heidän tulee välittömästi kysyä lääkäriltä neuvoa LUMIGAN® 0,01 %:n käytön jatkamisesta. .
Piilolinssien käyttö
Kerro potilaille, että LUMIGAN® 0,01% sisältää bentsalkoniumkloridia, joka voi imeytyä pehmeisiin piilolinsseihin. Piilolinssit tulee poistaa ennen LUMIGAN® 0,01% -instillaatiota ja ne voidaan laittaa takaisin 15 minuutin kuluttua sen antamisesta.
Käytä muiden silmälääkkeiden kanssa
Kerro potilaille, että jos käytetään useampaa kuin yhtä paikallista silmälääkettä, lääkkeet tulee antaa vähintään viiden (5) minuutin välein käyttökertojen välillä.
