Xalatan 2.5ml Latanoprost Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
XALATAN® (latanoprosti) Oftalminen liuos
KUVAUS
Latanoprosti on prostaglandiini F2α -analogi. Sen kemiallinen nimi on isopropyyli-(Z)-7[(1R,2R,3R,5S)3,5-dihydroksi-2-[(3R)-3-hydroksi-5-fenyylipentyyli]syklopentyyli]-5-heptenoaatti. Sen molekyylikaava on C26H40O5 ja sen kemiallinen rakenne on:
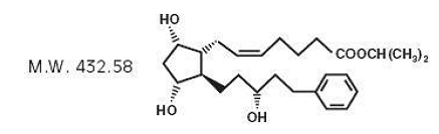
Latanoprosti on väritön tai hieman keltainen öljy, joka liukenee hyvin asetonitriiliin ja liukenee vapaasti asetoniin, etanoliin, etyyliasetaattiin, isopropanoliin, metanoliin ja oktanoliin. Se on käytännössä veteen liukenematon.
XALATAN (latanoprostin oftalminen liuos) 0,005 % toimitetaan steriilinä, isotonisena, puskuroituna latanoprostin vesiliuoksena, jonka pH on noin 6,7 ja osmolaliteetti noin 267 mOsmol/kg. Jokainen ml XALATANia sisältää 50 mikrogrammaa latanoprostia. Säilöntäaineena lisätään bentsalkoniumkloridia, 0,02 %. Inaktiiviset aineet ovat: natriumkloridi, natriumdivetyfosfaattimonohydraatti, vedetön dinatriumvetyfosfaatti ja injektionesteisiin käytettävä vesi. Yksi tippa sisältää noin 1,5 mikrogrammaa latanoprostia.
INDIKAATIOT
XALATAN 2,5 ml on tarkoitettu kohonneen silmänsisäisen paineen alentamiseen potilailla, joilla on avokulmaglaukooma tai silmän hypertensio.
ANNOSTELU JA HALLINNOINTI
Suositeltu annos on yksi tippa sairaaseen silmään (silmiin) kerran päivässä illalla. Jos yksi annos jää väliin, hoitoa tulee jatkaa seuraavalla annoksella normaalisti.
XALATAN-annos ei saa ylittää kerran vuorokaudessa; Kahden tai useamman prostaglandiinin tai prostaglandiinianalogin, mukaan lukien XALATAN 2,5 ml, yhteiskäyttöä ei suositella. On osoitettu, että näiden prostaglandiinilääkkeiden antaminen useammin kuin kerran päivässä voi heikentää silmänsisäistä painetta (IOP) alentavaa vaikutusta tai aiheuttaa paradoksaalisia silmänpaineen nousuja.
IOP:n aleneminen alkaa noin 3-4 tunnin kuluttua annosta ja maksimivaikutus saavutetaan 8-12 tunnin kuluttua.
XALATANia voidaan käyttää samanaikaisesti muiden paikallisesti käytettävien silmälääkevalmisteiden kanssa silmänpaineen alentamiseksi. Jos käytetään useampaa kuin yhtä paikallisesti käytettävää silmälääkettä, tulee lääkkeiden annostella vähintään viiden (5) minuutin välein. Piilolinssit on poistettava ennen XALATAN 2,5 ml:n antamista, ja ne voidaan laittaa takaisin 15 minuutin kuluttua annostelusta.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
Steriili oftalminen liuos, joka sisältää 50 mcg/ml latanoprostia.
Varastointi ja käsittely
XALATAN on kirkas, isotoninen, puskuroitu, säilötty väritön latanoprostiliuos 0,005 % (50 mcg/ml). Se toimitetaan 2,5 ml:n liuoksena 5 ml:n kirkkaassa matalatiheyksistä polyeteenistä koostuvassa pullossa, jossa on kirkas polyeteeninen tippakärki, turkoosi korkeatiheyksinen polyeteeninen kierrekorkki ja peukalointia osoittava kirkas matalatiheyksistä polyeteenistä valmistettu päällyskorkki.
2,5 ml täyttö, 0,005 % (50 mcg/ml): 1 pullon pakkaus: NDC 0013-8303-04 2,5 ml täyttö, 0,005 % (50 mcg/ml): 3 pullon monipakkaus: NDC 0013-8303-01
Varastointi
Suojaa valolta. Säilytä avaamattomia pulloja jääkaapissa 2–8 °C:ssa (36–46 °F). Potilaalle toimituksen aikana pulloa voidaan pitää enintään 40 °C:n (104 °F) lämpötilassa enintään 8 päivän ajan. Kun pullo on avattu käyttöä varten, sitä voidaan säilyttää huoneenlämmössä enintään 25 °C:ssa (77 °F) 6 viikon ajan.
Jakelija: Pharmacia & Upjohn Co., Division of Pfizer Inc., NY, NY 10017. Pfizer Manufacturing Belgium NV Puurs, Belgia. Tarkistettu: n/a
SIVUVAIKUTUKSET
Seuraavista haittavaikutuksista on raportoitu markkinoille tulon jälkeen, ja niitä käsitellään tarkemmin etiketin muissa osissa:
- Iriksen pigmenttimuutokset [katso VAROITUKSET JA VAROTOIMET ]
- Silmäluomen ihon tummuminen [katso VAROITUKSET JA VAROTOIMET ]
- Ripsien muutokset (lisääntynyt pituus, paksuus, pigmentti ja ripsien lukumäärä) [katso VAROITUKSET JA VAROTOIMET ]
- Silmänsisäinen tulehdus (iriitti/uveiitti) [katso VAROITUKSET JA VAROTOIMET ]
- Makulaturvotus, mukaan lukien kystoidinen makulaturvotus [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta kliinisessä käytännössä havaittuja nopeuksia.
XALATAN 2,5 ml tutkittiin kolmessa monikeskustutkimuksessa, satunnaistetussa, kontrolloidussa kliinisessä tutkimuksessa. Potilaat saivat 50 mikrogrammaa/ml XALATANia kerran vuorokaudessa tai 5 mg/ml aktiivista vertailuainetta (timololia) kahdesti päivässä. Tutkitun potilaspopulaation keski-ikä oli 65±10 vuotta. Seitsemän prosenttia potilaista vetäytyi ennen kuuden kuukauden päätepistettä.
Alle 1 % XALATAN 2,5 ml:lla hoidetuista potilaista joutui keskeyttämään hoidon sidekalvon liikakasvun sietokyvyn vuoksi.
Silmätapahtuma/blefariitin merkit ja oireet on tunnistettu "yleisesti havaituiksi" kliinisten tutkimusten tietojen analysoinnin perusteella.
Markkinoinnin jälkeinen kokemus
Seuraavat reaktiot on tunnistettu XALATANin markkinoille tulon jälkeisen käytön aikana kliinisessä käytännössä. Koska ne on raportoitu vapaaehtoisesti tuntemattoman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeille altistumiseen. Reaktiot, jotka on valittu sisällytettäväksi joko niiden vakavuuden, ilmoitustiheyden, mahdollisen syy-yhteyden XALATAN 2,5 ml:aan tai näiden tekijöiden yhdistelmän vuoksi, ovat:
Hermoston häiriöt: Huimaus; päänsärky; toksinen epidermaalinen nekrolyysi
Silmäsairaudet: Ripsien ja ripsien karvojen muutokset silmäluomissa (lisääntynyt pituus, paksuus, pigmentaatio ja ripsien lukumäärä); keratiitti; sarveiskalvon turvotus ja eroosiot; silmänsisäinen tulehdus (iriitti/uveiitti); silmänpohjan turvotus, mukaan lukien kystoidinen makulaturvotus; trikiaasi; silmäluomien ja silmäluomien muutokset, jotka johtavat silmäluomen uurteen syvenemiseen; iiriksen kysta; silmäluomien ihon tummuminen; paikallinen ihoreaktio silmäluomissa; sidekalvotulehdus; silmän sidekalvon pseudopemfigoidi
Hengityselinten, rintakehän ja välikarsinan häiriöt: Astma ja astman paheneminen; hengenahdistus
Ihon ja ihonalaisten kudosten häiriöt: Kutina
Infektiot ja infektiot: Herpes-keratiitti
Sydänhäiriöt: angina pectoris; sydämentykytys; angina epävakaa
Yleiset häiriöt ja hallintosivuston ehdot: Rintakipu
HUUMEIDEN VUOROVAIKUTUKSET
In vitro -tutkimukset ovat osoittaneet, että saostumista tapahtuu, kun timerosaalia sisältäviä silmätippoja sekoitetaan XALATANin kanssa. Jos tällaisia lääkkeitä käytetään, ne tulee antaa vähintään viiden (5) minuutin välein.
Kahden tai useamman prostaglandiinin tai prostaglandiinianalogin, mukaan lukien XALATAN 2,5 ml, yhteiskäyttöä ei suositella. On osoitettu, että näiden prostaglandiinilääkevalmisteiden antaminen useammin kuin kerran päivässä voi heikentää silmänpainetta alentavaa vaikutusta tai aiheuttaa paradoksaalista silmänpaineen nousua.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Pigmentaatio
XALATANin on raportoitu aiheuttavan muutoksia pigmentoituneisiin kudoksiin. Yleisimmin raportoituja muutoksia ovat olleet iiriksen, silmäluomien (silmäluomien) ja silmäripsien lisääntynyt pigmentaatio. Pigmentaation odotetaan lisääntyvän niin kauan kuin latanoprostia annetaan.
Pigmentaatiomuutos johtuu melanosyyttien lisääntyneestä melaniinipitoisuudesta pikemminkin kuin melanosyyttien määrän lisääntymisestä. Latanoprostin käytön lopettamisen jälkeen iiriksen pigmentoituminen on todennäköisesti pysyvää, kun taas periorbitaalikudoksen pigmentaation ja ripsien muutosten on raportoitu palautuvan joillakin potilailla. Hoitoa saaville potilaille on kerrottava lisääntyneen pigmentaation mahdollisuudesta. Yli 5 vuoden kuluttua lisääntyneen pigmentaation vaikutuksia ei tunneta [katso Kliiniset tutkimukset ].
Iriksen värin muutos ei ehkä ole havaittavissa useisiin kuukausiin tai vuosiin. Tyypillisesti pupillin ympärillä oleva ruskea pigmentti leviää samankeskisesti iiriksen reunaa kohti ja koko iiris tai sen osat muuttuvat ruskeammiksi. Hoito ei näytä vaikuttavan iiriksen neviin tai pisamioihin. Vaikka XALATAN 2,5 ml -hoitoa voidaan jatkaa potilailla, joille kehittyy huomattavasti lisääntynyt iiriksen pigmentaatio, nämä potilaat tulee tutkia säännöllisesti [ks. POTILASTIEDOT ].
Ripsien muutokset
XALATAN 2,5 ml voi asteittain muuttaa ripsiä ja karvoja hoidetussa silmässä; Näitä muutoksia ovat lisääntynyt pituus, paksuus, pigmentaatio, ripsien tai karvojen lukumäärä ja ripsien väärä kasvu. Ripsien muutokset ovat yleensä palautuvia, kun hoito lopetetaan [katso POTILASTIEDOT ].
Silmänsisäinen tulehdus
XALATAN 2,5 ml:n käytössä tulee noudattaa varovaisuutta potilailla, joilla on ollut silmänsisäinen tulehdus (iriitti/uveiitti), eikä sitä yleensä tule käyttää potilaille, joilla on aktiivinen silmänsisäinen tulehdus, koska tulehdus voi pahentua.
Makulaarinen turvotus
Makulaturvotusta, mukaan lukien kystoidista makulaturvotusta, on raportoitu XALATAN-hoidon aikana. XALATAN 2,5 ml:n käytössä tulee noudattaa varovaisuutta afakiapotilailla, pseudofakiapotilailla, joilla on repeytynyt mykiön takakapseli, tai potilaille, joilla on tunnettuja makulaedeeman riskitekijöitä.
Herpeettinen keratiitti
Herpes simplex -keratiitin uudelleenaktivoitumista on raportoitu XALATAN-hoidon aikana. XALATAN 2,5 ml:n käytössä tulee noudattaa varovaisuutta potilailla, joilla on ollut herpeettinen keratiitti. XALATAN 2,5 ml:n käyttöä tulee välttää aktiivisen herpes simplex -keratiitin tapauksissa, koska tulehdus voi pahentua.
Bakteerikeratiitti
On raportoitu bakteeriperäistä keratiittia, joka liittyy paikallisten silmätuotteiden usean annoksen säiliöiden käyttöön. Nämä säiliöt olivat vahingossa kontaminoituneet potilailta, joilla useimmissa tapauksissa oli samanaikainen sarveiskalvosairaus tai silmän epiteelin pinnan häiriö [ks. POTILASTIEDOT ].
Käytä piilolinssien kanssa
Piilolinssit on poistettava ennen XALATANin antoa ja ne voidaan asettaa takaisin 15 minuutin kuluttua annon jälkeen.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Latanoprosti ei ollut karsinogeeninen hiirille eikä rotille, kun sitä annettiin suun kautta letkuruokinnalla annoksina 170 mikrog/kg/vrk (noin 2800 kertaa suositeltu enimmäisannos ihmiselle) 20 kuukauden ajan ja rotille 24 kuukauden ajan.
Latanoprosti ei ollut mutageeninen bakteereissa, hiiren lymfoomassa tai hiiren mikrotumatesteissä. Kromosomipoikkeavuuksia havaittiin in vitro ihmisen lymfosyyteillä. Muut in vitro ja in vivo -tutkimukset suunnittelemattomasta DNA-synteesistä rotilla olivat negatiivisia.
Latanoprostilla ei ole havaittu olevan vaikutusta miesten tai naaraan hedelmällisyyteen eläintutkimuksissa.
Käyttö tietyissä populaatioissa
Raskaus
Teratogeeniset vaikutukset
Raskausluokka C.
Lisääntymistutkimuksia on tehty rotilla ja kaniineilla. Kaneilla 4:llä 16 emosta ei ollut elinkelpoisia sikiöitä annoksella, joka oli noin 80 kertaa ihmisen enimmäisannos, ja suurin ei-sikiötä tappava annos kaneilla oli noin 15 kertaa ihmisen enimmäisannos.
Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana oleville naisille. XALATAN 2,5 ml -valmistetta tulee käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa sikiölle mahdollisesti aiheutuvan riskin.
Imettävät äidit
Ei tiedetä, erittyvätkö tämä lääke tai sen metaboliitit äidinmaitoon. Koska monet lääkkeet erittyvät äidinmaitoon, varovaisuutta on noudatettava, kun XALATAN 2,5 ml -valmistetta annetaan imettävälle naiselle.
Käyttö lapsille
Turvallisuutta ja tehokkuutta lapsipotilailla ei ole osoitettu.
Geriatrinen käyttö
Turvallisuudessa tai tehokkuudessa ei ole havaittu yleisiä eroja iäkkäiden ja nuorempien potilaiden välillä.
YLIANNOSTUS
Laskimonsisäinen infuusio 3 mikrog/kg terveille vapaaehtoisille tuotti keskimääräiset plasmapitoisuudet 200 kertaa korkeammat kuin kliinisen hoidon aikana, eikä haittavaikutuksia havaittu. Laskimonsisäiset annokset 5,5-10 mcg/kg aiheuttivat vatsakipua, huimausta, väsymystä, kuumia aaltoja, pahoinvointia ja hikoilua. Jos XALATANin yliannostus tapahtuu, hoidon tulee olla oireenmukaista.
VASTA-AIHEET
Tunnettu yliherkkyys latanoprostille, bentsalkoniumkloridille tai muille tämän tuotteen aineosille.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Latanoprosti on prostanoidiselektiivinen FP-reseptoriagonisti, jonka uskotaan alentavan silmänpainetta (IOP) lisäämällä kammion ulosvirtausta. Eläimillä ja ihmisillä tehdyt tutkimukset viittaavat siihen, että pääasiallinen vaikutusmekanismi on lisääntynyt uveoskleraalinen ulosvirtaus. Kohonnut silmänpaine on merkittävä riskitekijä glaukoomakentän menetykseen. Mitä korkeampi silmänpainetaso on, sitä suurempi on näköhermovaurion ja näkökentän menetyksen todennäköisyys.
Farmakodynamiikka
Ihmisen silmänpaineen lasku alkaa noin 3-4 tunnin kuluttua annosta ja maksimivaikutus saavutetaan 8-12 tunnin kuluttua. IOP:n lasku jatkuu vähintään 24 tuntia.
Farmakokinetiikka
Imeytyminen
Latanoprosti imeytyy sarveiskalvon läpi, jossa isopropyyliesteriaihiolääke hydrolysoituu happomuotoon biologisesti aktiiviseksi.
Jakelu
Jakautumistilavuus ihmisellä on 0,16 ± 0,02 l/kg. Latanoprostin happo voidaan mitata kammion vesiliuoksesta ensimmäisten 4 tunnin aikana ja plasmasta vain ensimmäisen tunnin ajan paikallisen annon jälkeen. Ihmisillä tehdyt tutkimukset osoittavat, että kammion huippupitoisuus saavutetaan noin kaksi tuntia paikallisen annon jälkeen.
Aineenvaihdunta
Latanoprosti, isopropyyliesteriaihiolääke, hydrolysoituu sarveiskalvossa olevien esteraasien vaikutuksesta biologisesti aktiiviseksi hapoksi. Systeemiseen verenkiertoon pääsevä latanoprostin aktiivinen happo metaboloituu ensisijaisesti maksassa 1,2-dinorin ja 1,2,3,4-tetranorin metaboliiteiksi rasvahappojen β-hapetuksen kautta.
Erittyminen
Latanoprostihapon eliminaatio ihmisen plasmasta on nopeaa (t½ = 17 min) sekä suonensisäisen että paikallisen annon jälkeen. Systeeminen puhdistuma on noin 7 ml/min/kg. Maksan β-hapetuksen jälkeen metaboliitit eliminoituvat pääasiassa munuaisten kautta. Noin 88 % annetusta annoksesta erittyy virtsaan paikallisen ja 98 % suonensisäisen annostelun jälkeen.
Kliiniset tutkimukset
Kohonnut IOP perusviiva
Potilailla, joiden silmänpaineen keskiarvo lähtötilanteessa oli 24–25 mmHg ja joita hoidettiin 6 kuukauden ajan monikeskustutkimuksissa, satunnaistetuissa kontrolloiduissa tutkimuksissa, silmänpaine laski 6–8 mmHg. Tämä silmänpaineen aleneminen XALATAN-annoksella 0,005 % kerran vuorokaudessa vastasi 0,5 % timololin vaikutusta kahdesti vuorokaudessa.
Iiriksen lisääntyneen pigmentaation eteneminen
Kolmivuotinen avoin, prospektiivinen turvallisuustutkimus, jossa oli 2 vuoden jatkovaihe, suoritettiin iiriksen lisääntyneen pigmentaation etenemisen arvioimiseksi käytettäessä jatkuvasti XALATANia kerran päivässä lisähoitona 519 avokulmaglaukoomapotilaalla. Analyysi perustui niiden 380 potilaan havaittuihin tapauksiin, jotka jatkoivat jatkovaiheessa.
Tulokset osoittivat, että havaittavasti lisääntynyt iiriksen pigmentaatio alkoi ensimmäisen hoitovuoden aikana suurimmalla osalla potilaista, joille kehittyi huomattavasti lisääntynyt iiriksen pigmentaatio. Potilailla oli edelleen merkkejä iiriksen pigmentaation lisääntymisestä viiden tutkimuksen ajan. Lisääntyneen iiriksen pigmentaation havainnointi ei vaikuttanut tutkimuksessa kirjattujen haittatapahtumien (muiden kuin lisääntyneen iiriksen pigmentaation) esiintyvyyteen, luonteeseen tai vakavuuteen. IOP:n lasku oli samanlainen riippumatta lisääntyneen iiriksen pigmentaation kehittymisestä tutkimuksen aikana.
POTILASTIEDOT
Mahdollisuus pigmentoitumiseen
Kerro potilaille iiriksen lisääntyneestä ruskeasta pigmentaatiosta, joka voi olla pysyvää. Kerro potilaille silmäluomien ihon tummumisen mahdollisuudesta, joka voi olla palautuva XALATAN-hoidon lopettamisen jälkeen [ks. VAROITUKSET JA VAROTOIMET ].
Mahdollisuus ripsien muutoksiin
Kerro potilaille mahdollisista ripsien ja karvojen muutoksista hoidetussa silmässä XALATAN-hoidon aikana. Nämä muutokset voivat johtaa eroihin silmien välillä pituudessa, paksuudessa, pigmentaatiossa, ripsien tai velluskarvojen lukumäärässä ja/tai ripsien kasvusuunnassa. Ripsien muutokset ovat yleensä palautuvia, kun hoito lopetetaan.
Kontin käsittely
Pyydä potilaita välttämään annostelusäiliön kärjen joutumista silmiin tai ympäröiviin rakenteisiin, koska tämä voi saada kärjen kontaminoitumaan tavallisilla bakteereilla, joiden tiedetään aiheuttavan silmätulehduksia. Saastuneiden liuosten käyttö voi aiheuttaa vakavia silmävaurioita ja sitä seuraavaa näönmenetystä [katso VAROITUKSET JA VAROTOIMET ].
Milloin kysyä neuvoa lääkäriltä
Kerro potilaille, että jos heille kehittyy väliaikainen silmäsairaus (esim. trauma tai infektio) tai silmäleikkaus tai jos heille ilmaantuu silmäreaktioita, erityisesti sidekalvotulehdusta ja silmäluomen reaktioita, heidän tulee välittömästi kysyä lääkärin neuvoa toistuvan annoksen käytön jatkamisesta. kontti.
Käytä piilolinssien kanssa
Kerro potilaille, että XALATAN 2,5 ml sisältää bentsalkoniumkloridia, joka saattaa imeytyä piilolinsseihin. Piilolinssit tulee poistaa ennen liuoksen antamista. Linssit voidaan asettaa takaisin 15 minuutin kuluttua XALATANin annon jälkeen.
Käytä muiden silmälääkkeiden kanssa
Jos käytetään useampaa kuin yhtä paikallisesti käytettävää silmälääkettä, tulee lääkkeiden annostella vähintään viiden (5) minuutin välein.
